Réaction chimique
Une réaction chimique est un processus dans lequel un ou plusieurs composés chimiques sont convertis en d'autres et de l'énergie est libérée ou absorbée. En outre, des éléments peuvent être impliqués dans les réactions. Les réactions chimiques sont généralement associées à des changements dans les liaisons chimiques dans les molécules ou les cristaux . En raison d'une réaction chimique, les propriétés des produits peuvent changer considérablement par rapport aux matières premières . Les réactions chimiques n'incluent pas les processus physiques dans lesquels seul l'état physique change, tels que la fusion ou l' évaporation , la diffusion , le mélange de substances pures en mélanges de substances et les réactions nucléaires dans lesquelles les éléments sont convertis en d'autres.
Les réactions consistent généralement en une séquence assez compliquée de sous-étapes individuelles, les réactions dites élémentaires , qui forment ensemble la réaction globale. Le mécanisme de réaction fournit des informations sur la séquence exacte des étapes partielles . Pour la description des réactions chimiques, l' équation de réaction utilisée est représentée graphiquement dans les matières premières, les produits et parfois des intermédiaires importants et via une flèche, la flèche de réaction à relier les uns aux autres.
Les réactions élémentaires et les mécanismes de réaction peuvent être divisés en différents groupes. Les réactions élémentaires comprennent la désintégration d'une molécule en deux ou l'inverse, la synthèse de deux atomes ou molécules en un seul. Les mécanismes de réaction sont souvent classés en fonction de l'évolution des substances impliquées. S'il y a changement du nombre d'oxydation , on parle d' oxydation et de réduction ; un produit solide est créé à partir de substances dissoutes, à partir d'une précipitation .
La mesure dans laquelle une certaine réaction entre deux ou plusieurs partenaires a lieu dépend de la différence d' énergie de Gibbs des produits et des éduits, qui est composée d'un composant enthalpique et d'un composant entropique . Avec des valeurs négatives, l'équilibre réactionnel est du côté des produits. Cependant, il existe également de nombreuses réactions qui sont thermodynamiquement possibles dans ce sens , mais se déroulent cinétiquement très lentement, dans les cas extrêmes si lentement qu'elles ne peuvent pratiquement pas être observées. La raison en est une énergie d'activation trop élevée , qui doit être appliquée pour que la réaction ultérieure soit possible. De telles réactions ont lieu plus rapidement à des températures plus élevées, car un nombre comparativement plus grand de particules impliquées a suffisamment d'énergie pour surmonter la barrière d'activation. Dans de nombreuses réactions, cela est également possible au moyen de la catalyse , dans laquelle ne se produit pas la réaction directe, mais une réaction différente, dans laquelle une troisième substance qui émerge inchangée de la réaction est impliquée. La présence de ce catalyseur réduit l'énergie d'activation requise.
l'histoire
Les réactions chimiques telles que la combustion au feu , la fermentation alcoolique ou la réduction des minerais en métaux - par exemple dans le cas du fer - sont connues depuis très longtemps. Les premières théories pour la transformation des substances ont été développées par des philosophes grecs, par exemple la théorie des quatre éléments d' Empédocle , selon laquelle chaque substance est composée des quatre éléments de base feu, eau, air et terre et peut également être décomposée en celles-ci. Au Moyen Âge, les alchimistes étaient principalement concernés par les réactions chimiques. En particulier, ils ont essayé de convertir le plomb en or , en utilisant, entre autres, des réactions du plomb et des alliages plomb-cuivre avec le soufre .
La production de substances chimiques qui ne se produisent pas dans la nature par des réactions appropriées est connue depuis longtemps. Cela s'applique, par exemple, à l'acide sulfurique et nitrique , dont la première production est attribuée à l'alchimiste controversé Jabir ibn Hayyan . Il a été fabriqué en chauffant des minerais de sulfate et de nitrate tels que le vitriol, l'alun et le salpêtre. Au 17ème siècle, Johann Rudolph Glauber produit pour la première fois de l'acide chlorhydrique et du sulfate de sodium en faisant réagir l'acide sulfurique et le chlorure de sodium . Avec le développement du procédé à chambre de plomb pour la production d'acide sulfurique et du procédé Leblanc pour la production de carbonate de sodium , des réactions chimiques ont également été utilisées industriellement. Avec l'industrialisation croissante, la synthèse industrielle est devenue plus importante et des procédés plus récents et plus efficaces ont été développés. Des exemples sont le procédé de contact pour la production d'acide sulfurique, qui a été utilisé à partir de 1870, ou le procédé Haber-Bosch pour la synthèse de l' ammoniac développé en 1910 .
À partir du XVIe siècle, des chercheurs comme Johan Baptista van Helmont , Robert Boyle ou Isaac Newton ont tenté d' étudier scientifiquement les transformations chimiques observées et de mettre en place des théories sur leur processus. Une réaction importante étudiée a été la combustion , pour laquelle Johann Joachim Becher et Georg Ernst Stahl ont développé la théorie du phlogistique au début du 18e siècle . Cependant, cela s'est avéré faux et pourrait être réfuté en 1785 par Antoine Lavoisier , qui a trouvé l'explication correcte de la combustion comme une réaction avec l'oxygène dans l'air.
Joseph Louis Gay-Lussac a reconnu en 1808 que les gaz réagissent toujours entre eux dans certaines proportions. À partir de là et de la théorie atomique de Dalton , Joseph Louis Proust a développé la loi des proportions constantes , sur laquelle est basée la stoechiométrie et qui a également permis le développement des équations de réaction .
Pour une longue période , on a supposé que organiques réactions sont déterminées par une « spéciale force de vie » (vis Vitalis) et diffèrent donc des réactions non-organiques. Après que Friedrich Wöhler a synthétisé l'urée à partir de précurseurs inorganiques en 1828, cette hypothèse a perdu beaucoup de son importance en chimie. D'autres chimistes qui ont apporté des contributions importantes à l'élucidation des réactions chimiques organiques étaient, par exemple, Justus von Liebig avec sa théorie radicale , Alexander William Williamson , qui a développé la synthèse d' éthers portant son nom , et Christopher Kelk Ingold , qui, entre autres choses , a étudié les mécanismes des réactions de substitution .
Équations de réaction
Les équations dites de réaction sont utilisées pour représenter graphiquement des réactions chimiques . Celles-ci sont constituées de la somme ou des formules structurales des matières premières à gauche et de celles des produits à droite. Entre les deux, il y a une flèche, appelée flèche de réaction , qui indique la direction et le type de réaction. La pointe de la flèche pointe toujours dans la direction dans laquelle la réaction a lieu. Pour les réactions d'équilibre , des flèches doubles sont utilisées qui pointent dans des directions opposées. Les équations de réaction doivent être équilibrées stoechiométriquement . Cela signifie qu'il devrait y avoir le même nombre d'atomes des deux côtés de la flèche de réaction et que les équations devraient être équilibrées par différents nombres de molécules impliquées.
- Équation de réaction simple schématique
Des réactions plus compliquées sont représentées par des schémas de formules qui, en plus des matières premières et des produits, montrent également des produits intermédiaires importants ou des états de transition . Les chemins de réaction sont illustrés par des flèches qui montrent l'attaque de paires d'électrons d' un atome sur d'autres atomes. Dans les équations de réaction de la chimie organique, de petites molécules inorganiques telles que l' eau ou le dioxyde de carbone sont souvent placées sur la flèche (pour les éduits) ou en dessous (pour les produits) ou indiquées par un signe. De plus, les catalyseurs , solvants , conditions spéciales ou autres substances qui jouent un rôle pendant la réaction ne changent cependant pas avec cela sont écrits sur la flèche de réaction.
 Mécanisme de réaction typique en chimie organique (exemple: oxydation de Baeyer-Villiger basée sur la réaction d'un acide percarboxylique avec une cétone )
Mécanisme de réaction typique en chimie organique (exemple: oxydation de Baeyer-Villiger basée sur la réaction d'un acide percarboxylique avec une cétone )
La notation d'une réaction comme rétrosynthèse peut également être utile lors de la planification de synthèses compliquées . Ici, une réaction est écrite à partir de la fin, c'est-à-dire le produit, qui est décomposé par des étapes de synthèse possibles jusqu'à ce que les matières premières possibles soient atteintes. Les rétrosynthèses sont indiquées par une flèche spéciale, la flèche de rétrosynthèse ( ).
Réactions élémentaires
La réaction élémentaire est la plus petite section dans laquelle une réaction chimique peut être décomposée. Les réactions macroscopiquement observables sont construites à partir d'un grand nombre de réactions élémentaires qui se déroulent en parallèle ou l'une après l'autre. La séquence spécifique des réactions élémentaires individuelles est également connue sous le nom de mécanisme de réaction . Une ou deux, rarement trois molécules sont généralement impliquées dans une réaction élémentaire. Les réactions avec plus de molécules sont pratiquement impossibles, car il est extrêmement improbable que plus de trois molécules se rapprochent suffisamment pour réagir en même temps.
Les réactions élémentaires les plus importantes sont les réactions unimoléculaires et bimoléculaires. Dans une réaction unimoléculaire, une seule molécule est impliquée, qui est convertie en une ou plusieurs autres molécules par isomérisation ou désintégration. Ces réactions nécessitent généralement un apport d'énergie, par exemple sous forme de chaleur ou d'irradiation avec de la lumière.
Un exemple de réaction unimoléculaire typique est l ' isomérisation cis - trans , dans laquelle la forme cis d' un composé est convertie en forme trans ou vice versa.

En cas de dissociation , une liaison dans une molécule se sépare et deux parties sont créées. Le clivage peut être réalisé de manière homo- ou hétérolytique . Dans le premier cas, la liaison est scindée de telle manière que chaque partie conserve un électron et des radicaux se forment; dans le cas du clivage hétérolytique, les deux électrons restent avec une partie de la molécule, tandis que l'autre ne retient aucun électrons de la liaison scindée et ainsi des ions sont formés. Les désintégrations jouent un rôle important dans le déclenchement de réactions en chaîne telles que la réaction oxyhydrogène ou les polymérisations .
- Désintégration d'une molécule AB en deux parties plus petites A et B.
Dans les réactions bimoléculaires, deux molécules entrent en collision et réagissent l'une avec l'autre. Une possibilité est que ces deux molécules deviennent une, c'est-à-dire qu'une synthèse a lieu. Cela se produit, par exemple, lorsque deux radicaux réagissent pour former une molécule. Même avec des réactions d'addition en chimie organique, une nouvelle est formée à partir de plusieurs molécules.
Cependant, il est également possible qu'une réaction ne produise pas de molécule stable et qu'une partie seulement d'une molécule soit transférée à l'autre. Ce type de réaction se produit, par exemple, dans les réactions redox et acide-base. Dans les réactions redox, la particule transférée est un électron; dans les réactions acide-base, c'est un proton. Ce type de réaction est également appelé métathèse .
Équilibre chimique
Toute réaction chimique en phase homogène est réversible et peut se dérouler dans les deux sens. Si, par exemple, deux substances réagissent pour en former une troisième, la troisième se décompose également en substances de départ. Les réactions aller-retour sont toujours en concurrence les unes avec les autres et diffèrent en termes de vitesses de réaction différentes . Puisque les vitesses de réaction dépendent également de la concentration, elles changent avec le temps. Les vitesses de la réaction de va-et-vient convergent de plus en plus au fur et à mesure que la réaction progresse jusqu'à ce qu'elles soient finalement les mêmes. À ce stade, les concentrations des substances individuelles dans le mélange réactionnel ne changent plus, un équilibre, appelé équilibre chimique, est atteint.
Outre les propriétés des substances impliquées, la position de l'équilibre dépend de la température et de la pression et est déterminée par l'énergie libre minimale. Souvent, la dérivation de l'enthalpie libre, l'enthalpie libre de réaction, est calculée, qui doit être égale à 0 en équilibre. La dépendance à la pression peut facilement s'expliquer avec le principe du Chatelier , selon lequel un système élude une contrainte telle qu'une augmentation de pression de telle sorte que l'effet est minime.
A ce stade, le rendement maximum d'une réaction a été atteint, car avec la formation supplémentaire d'un produit, la réaction inverse se déroule plus rapidement et est donc préférée jusqu'à ce que l'équilibre soit de nouveau atteint. Cependant, des rendements plus élevés peuvent être obtenus en éliminant les produits du mélange réactionnel dans lequel l'équilibre est perturbé, ou en modifiant la pression ou la température. Les concentrations initiales des substances impliquées n'ont aucune influence sur la position de l'équilibre.
thermodynamique
Les réactions chimiques sont largement déterminées par les lois de la thermodynamique. En principe, chaque réaction a lieu. Cependant, dans de très nombreux cas, l'équilibre est presque entièrement du côté des éduits. Pour qu'une réaction ait lieu, elle doit être exergonique , c'est-à-dire que l' enthalpie libre doit diminuer pendant la réaction. L'enthalpie libre est constituée de deux grandeurs thermodynamiques différentes, l' enthalpie et l' entropie . Celles-ci sont liées les unes aux autres via l'équation fondamentale de l'enthalpie libre.
- G: enthalpie libre, H: enthalpie, T: température, S: entropie, Δ: différences
Les réactions peuvent avoir lieu de plusieurs manières. Une possibilité est la réaction exothermique , dans laquelle Δ H est négatif et de l'énergie est libérée. En fonction de la quantité d'énergie libérée, des structures hautement ordonnées avec une faible entropie peuvent également apparaître. Des exemples typiques de réactions exothermiques avec perte d'entropie sont les précipitations et les cristallisations , dans lesquelles des structures solides ordonnées proviennent de structures désordonnées en phase gazeuse, liquide ou en solution. Dans le cas des réactions endothermiques, par contre, la chaleur est consommée et doit être absorbée par l'environnement. Celles-ci ne peuvent avoir lieu que si l'entropie du système augmente en même temps. Cela peut avoir lieu, par exemple, via la formation de produits de réaction gazeux, qui ont une entropie élevée.
Etant donné que l'entropie dépend de la température et augmente avec l'augmentation de la température, des réactions spécifiques à l'entropie telles que des désintégrations ont lieu de préférence à des températures élevées. Les réactions énergétiques spécifiques telles que les cristallisations, par contre, se déroulent principalement à basse température. Parfois, la direction d'une réaction peut être inversée en modifiant la température.
L' équilibre de Boudouard en est un exemple .
La réaction du dioxyde de carbone et du carbone à l' oxyde de carbone est endothermique, de sorte que l'équilibre à basse température est du côté du dioxyde de carbone. Ce côté n'est préféré qu'à des températures supérieures à 800 ° C en raison de l'entropie plus élevée du côté du monoxyde de carbone.
Les réactions peuvent également être visualisées à travers des changements d' énergie interne . Cela peut également être décrit à l'aide d'une équation fondamentale qui prend en compte , entre autres, l'entropie, les changements de volume et le potentiel chimique . Cette dernière dépend, entre autres, des activités des substances impliquées.
- U: énergie interne, S: entropie, p: pression, μ: potentiel chimique, n: quantité de substance, d: notation différentielle
Cinétique de réaction
La cinétique de la réaction étudie la vitesse à laquelle une réaction se produit. Cela dépend de divers paramètres de la réaction, tels que l'ordre de la réaction , les concentrations des substances impliquées, la température , l' énergie d'activation et d'autres facteurs, pour la plupart déterminés empiriquement. Il existe également diverses théories pour calculer théoriquement les vitesses de réaction pour différents systèmes au niveau moléculaire. Contrairement à la cinétique de réaction, ce domaine de travail est également appelé dynamique de réaction.
Pour les réactions élémentaires, des lois de vitesse simples peuvent être établies, qui diffèrent selon l'ordre de la réaction et montrent la dépendance des concentrations des substances impliquées. Pour une réaction de premier ordre, c'est-à-dire une désintégration d'une substance A, ce qui suit s'applique à la vitesse de réaction v ( k : constante de vitesse, t : temps, [A]: concentration de A, [A] 0 : concentration initiale de A ):
intégré
Dans une réaction de premier ordre, la vitesse de la réaction ne dépend que de la concentration et des propriétés de la substance en décomposition. Puisque la concentration diminue de façon exponentielle avec le temps dans une réaction de premier ordre , une demi-vie constante qui est typique de la réaction respective peut être déterminée. Cette valeur est souvent donnée, notamment dans le cas de désintégrations radioactives qui n'appartiennent pas aux réactions chimiques mais se déroulent également selon une loi de taux de premier ordre . Pour d'autres ordres de réaction et des réactions plus compliquées, il existe des lois de vitesse différentes en conséquence. Pour calculer la constante de vitesse, l' équation d'Arrhenius peut être utilisée, qui montre la dépendance à la température de la constante.
Un modèle simple permettant d'expliquer le déroulement moléculaire d'une réaction chimique et les vitesses de réaction est la théorie des collisions . Avec cela, cependant, seules quelques réactions simples peuvent être calculées raisonnablement correctement. Pour des réactions plus compliquées, des théories plus précises, généralement adaptées à un problème spécifique, doivent être utilisées. Ceux-ci incluent la théorie de l'état de transition , le calcul de la surface d'énergie potentielle, la théorie de Marcus et la théorie RRKM .
Types de réactions
Les réactions peuvent être divisées en différents types, qui diffèrent par le type de particules transférées et les produits formés.
Oxydation et réduction
Si des électrons sont transférés lors d'une réaction entre deux atomes , les états d'oxydation des atomes impliqués changent . L'atome qui émet un ou plusieurs électrons ( appelé agent réducteur ) est oxydé, l'autre, l' agent oxydant , est réduit en conséquence. Puisque les deux réactions se produisent toujours ensemble, on parle également de réaction redox.
Lequel des réactifs impliqués est l'agent réducteur ou oxydant peut être prédit sur la base des électronégativités des éléments impliqués. Les éléments à faible électronégativité, comme la plupart des métaux , donnent facilement des électrons et sont par conséquent oxydés, tandis que les non-métaux à haute électronégativité sont légèrement réduits. Si des ions sont impliqués dans une réaction redox, le niveau d'oxydation de l'ion doit également être pris en compte. Ainsi, les chromates ou permanganates dans lesquels les éléments à des états d'oxydation élevés sont présents, sont des agents oxydants forts.
Le nombre d'électrons qu'un élément libère ou absorbe dans une réaction redox peut souvent être prédit par la configuration électronique des réactifs. Les éléments tentent d'obtenir la configuration des gaz rares et libèrent donc souvent ou acceptent souvent un nombre correspondant d'électrons. Cela vaut en particulier pour de nombreux éléments des groupes principaux tels que les métaux alcalins , les métaux alcalino-terreux ou des halogènes . Cependant, pour les métaux de transition et en particulier les atomes lourds , cela ne s'applique souvent pas en raison de la charge élevée requise pour obtenir la configuration de gaz rare et de l'influence croissante des effets relativistes . Les gaz rares , qui ont déjà une configuration de gaz rares, n'ont donc pas tendance à accepter d'autres électrons et sont très inertes.
Une classe importante de réactions redox sont les réactions électrochimiques . En électrolyse , les électrons du courant électrique agissent comme un agent réducteur. Les réactions électrochimiques ont lieu dans des cellules galvaniques , dans lesquelles la réduction et l'oxydation ont lieu spatialement séparées. Ces réactions sont particulièrement importantes pour la production de nombreux éléments tels que le chlore ou l' aluminium . La réaction inverse, dans laquelle des électrons sont libérés dans des réactions redox et peuvent être utilisés comme énergie électrique, est également possible. C'est le principe de la batterie, dans laquelle l'énergie est stockée chimiquement et convertie en énergie électrique.
Réaction de formation complexe
Dans la réaction de formation du complexe, plusieurs ligands réagissent avec un atome métallique pour former un complexe . Cela se produit parce que des paires d'électrons isolés sur les ligands pénètrent dans les orbitales vides de l'atome métallique et forment une liaison de coordination . Les ligands sont des bases de Lewis qui ont des paires d'électrons isolées. Ceux-ci peuvent être à la fois des ions et des molécules neutres (comme le monoxyde de carbone, l'ammoniac ou l'eau). Le nombre de ligands qui réagissent avec l'atome de métal central peut souvent être prédit à l'aide de la règle des 18 électrons , qui peut être utilisée pour déterminer des complexes particulièrement stables. Selon la théorie du champ cristallin et du champ ligand , la géométrie du complexe joue également un rôle important; les complexes tétraédriques ou octaédriques sont particulièrement courants .
Les réactions peuvent également avoir lieu au sein d'un complexe. Ceux-ci comprennent l' échange de ligands , dans lequel un ou plusieurs ligands sont remplacés par un autre, des réarrangements et des processus redox dans lesquels le niveau d'oxydation de l'atome de métal central change.
Réactions acide-base
Les réactions acide-base sont - dans la définition de Brønsted des acides - des réactions dans lesquelles des protons sont transférés d'une molécule à une autre. Le proton est toujours transféré de l' acide (donneur de protons) à la base (accepteur de protons) (protolyse).
- Réaction acide-base, HA: acide, B: base, A - : base correspondante, HB + : acide correspondant
Etant donné que le transfert du proton de l'acide à la base produit une base et un acide, les soi-disant acides ou bases correspondants, la réaction inverse est également possible. L'acide / base et la base / acide correspondante sont donc toujours en équilibre. Sur quel côté de la réaction se trouve l'équilibre peut être déterminé par les constantes d'acide des substances impliquées. Plus un acide ou une base est fort, plus il est facile de libérer ou d'absorber le proton. Un cas particulier de la réaction acide-base est la neutralisation , dans laquelle un acide et une base réagissent exactement dans le même rapport qu'une solution neutre, c'est-à-dire une solution sans excès d' ions hydroxyde ou oxonium, est formée.
précipitation
La précipitation est une réaction dans laquelle des particules préalablement dissoutes se combinent et deviennent une nouvelle substance insoluble dans l'eau, le précipité. Cela se produit principalement avec les ions dissous, qui se rassemblent lorsque le produit de solubilité est dépassé et forment un sel insoluble . Cela peut être fait, par exemple, en ajoutant un précipitant avec un produit à faible solubilité à un sel déjà dissous ou en éliminant le solvant. Selon les conditions, une substance peut se révéler très différente d'une solution. Si la précipitation se produit rapidement, les ions n'ont pas le temps de s'organiser et un précipité amorphe ou microcristallin se forme. D'autre part, lorsque le produit de solubilité est lentement dépassé et qu'une sursaturation se produit, la précipitation n'a lieu que lentement. Les ions ont donc le temps de s'organiser et des cristaux réguliers se forment . Cela peut également être fait par recristallisation à partir du précipité microcristallin.
Réactions à l'état solide
Des réactions peuvent également avoir lieu entre deux substances solides. Cependant, la diffusion , qui détermine en grande partie la vitesse de la réaction, est très faible, de sorte que les réactions à l'état solide sont en conséquence des réactions lentes. Cela signifie que les réactions à l'état solide doivent généralement être effectuées à des températures élevées. Dans le même temps, les réactifs doivent être répartis aussi finement que possible, car cela crée la plus grande surface possible sur laquelle les deux substances peuvent réagir.
Réactions photochimiques
Le rayonnement électromagnétique joue un rôle crucial dans les réactions photochimiques . La lumière et le rayonnement UV d'une longueur d' onde d'environ 200 à 800 nm sont ici d'une importance particulière . Ce rayonnement excite les électrons dans les atomes et les molécules, et des états excités se forment . Ceux-ci sont très énergétiques en raison des photons absorbés et peuvent libérer de l'énergie à travers divers processus. En plus des processus physiques tels que la fluorescence et la phosphorescence , des réactions sont également possibles ici. Souvent, des ruptures de liaison homolytiques se produisent, de sorte que des radicaux se forment. Par exemple, des réactions en chaîne telles que la réaction oxyhydrogène d' hydrogène et d' oxygène peuvent être déclenchées par des réactions photochimiques . Mais les ionisations , les réactions de transfert d'électrons , les isomérisations ou les réarrangements peuvent également être provoqués par des réactions photochimiques.
La photosynthèse est une réaction photochimique biologiquement très importante , dans laquelle des composés organiques sont synthétisés à partir de dioxyde de carbone et d' eau à l'aide de la lumière . Les réactions photochimiques jouent également un rôle important dans la chimie atmosphérique , par exemple dans l' accumulation et la dégradation de l' ozone .
catalyse
En catalyse, la réaction de deux substances ne se fait pas directement, mais par un détour. Il y a toujours une troisième substance impliquée, le soi-disant catalyseur , qui intervient dans la réaction, mais émerge toujours inchangée de la réaction à la fin. En raison de la catalyse, des réactions cinétiquement inhibées par une énergie d'activation élevée peuvent avoir lieu pendant que cette énergie d'activation est contournée. En conséquence, souvent, seule une petite quantité d'énergie est utilisée et une réaction peut ainsi être réalisée de manière économique. Parfois, les réactions ne sont rendues possibles par les catalyseurs que si, par exemple, des réactions compétitives ont lieu de préférence à des températures autrement nécessaires.
Les catalyseurs peuvent être présents soit dans une phase différente (hétérogène) soit dans la même phase (homogène). Les catalyseurs hétérogènes sont pour la plupart des corps solides, à la surface desquels les réactions ont lieu. En conséquence, la surface du catalyseur doit être aussi grande que possible pour une catalyse efficace. Les réactions catalytiques sur les surfaces sont souvent associées à la chimisorption , dans laquelle une molécule est chimiquement liée à la surface et donc les liaisons à l'intérieur de la molécule sont affaiblies. Cela permet une réaction plus facile.
Les métaux de platine et autres métaux de transition sont particulièrement importants dans la catalyse hétérogène , qui sont utilisés dans de nombreuses réactions techniquement importantes telles que l' hydrogénation , le reformage catalytique ou la synthèse de produits chimiques basiques tels que l'acide nitrique ou l' ammoniac . Les catalyseurs de catalyse homogène peuvent être des acides qui augmentent la nucléophilie d'un groupe carbonyle et permettent ainsi une réaction avec des électrophiles autrement non réactifs, ou des complexes solubles comme dans l' hydroformylation .
Les catalyseurs homogènes présentent l'avantage qu'il n'y a pas de problèmes d'accessibilité du catalyseur et que la surface spécifique est trop petite, les réactifs et le catalyseur peuvent être facilement réunis par mélange et agitation. De plus, le catalyseur, tel qu'un complexe, peut être synthétisé spécifiquement et de manière reproductible pour une réaction. Un inconvénient, cependant, est la séparation difficile du catalyseur du produit, qui peut conduire à la contamination et à la perte du catalyseur habituellement coûteux. C'est pourquoi les catalyseurs hétérogènes sont préférés dans de nombreux procédés industriels.
Réactions en chimie organique
En chimie organique, en plus des réactions qui se produisent également avec des substances inorganiques, telles que les oxydations, les réductions ou les réactions acide-base, il existe de nombreuses autres réactions dans lesquelles des liaisons covalentes se forment entre des atomes de carbone ou du carbone et des hétéroatomes (par exemple, oxygène, azote , halogènes). En plus de la distinction entre les réactions homolytiques et radicalaires, celles-ci sont classées principalement en fonction du type de changement structurel. De nombreuses réactions spéciales en chimie organique sont appelées réactions de nom après leurs découvreurs.
substitution
En substitution, un atome, une partie d'une molécule ou d'un ligand (en chimie complexe, où des substitutions sont également possibles) est échangé contre un autre. Un atome ou une molécule attaquant prend la place d'un autre atome ou molécule qui a été séparé en tant que groupe partant . La liaison de l'atome de carbone ne change pas.
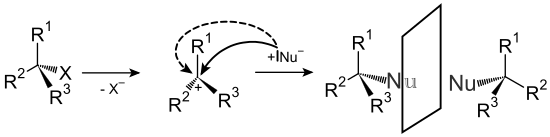
Les réactions de substitution peuvent être divisées en trois types en fonction de la particule attaquante. Dans le cas des substitutions nucléophiles , un nucléophile , c'est-à-dire un atome ou une molécule avec un excès d' électrons et donc une charge négative ou une charge partielle , attaque un atome de carbone approprié et remplace un autre atome ou molécule partielle. Les nucléophiles typiques sont des atomes, des ions ou des groupes d'atomes avec des non-métaux électronégatifs tels que des amines , des halogénures , des thiols , des hydroxydes ou des alcoolates . En plus du nucléophile, le groupe partant joue également un rôle pour déterminer si une substitution a lieu. Les bons groupes partants doivent être faciles à séparer et former des molécules ou des ions aussi stables que possible. Des exemples sont le bromure et l'iodure d'halogénures lourds ou l'azote. Ce type de réaction se retrouve principalement avec les hydrocarbures aliphatiques , avec les aromatiques - puisque les aromatiques ont une densité d'électrons élevée - elle est plutôt rare et ne peut avoir lieu que dans des circonstances particulières avec des groupements très électro-attracteurs sur les aromatiques ( substitution nucléophile aromatique ). Les substitutions nucléophiles peuvent se produire selon deux mécanismes différents, appelés S N 1 et S N 2. Les noms sont dérivés des ordres de réaction selon lesquels les étapes de détermination de la vitesse des deux types de réaction ont lieu.
Dans le mécanisme S N 1, le groupe partant est d'abord séparé, créant un carbocation . Ceci est suivi d'une réaction rapide avec le nucléophile.
Dans le mécanisme S N 2, le nucléophile attaque d'abord, formant un état de transition commun, et alors seulement le groupe partant se sépare. Les deux mécanismes diffèrent dans la stéréochimie des produits obtenus, avec S N 1 une racémisation se produit en raison du carbocation trivalent , tandis qu'avec S N 2 on observe une inversion de la stéréochimie précédemment existante ( inversion de Walden ).
La contrepartie de la substitution nucléophile est la substitution électrophile . Dans ce cas, un électrophile, c'est-à-dire un atome ou une molécule avec une densité électronique inférieure, c'est-à-dire une charge positive ou une charge partielle, est la particule attaquante. Les électrophiles typiques sont, par exemple, les carbocations, l'atome de carbone dans les groupes carbonyle , le trioxyde de soufre ou les cations nitronium . Cette réaction a lieu presque exclusivement avec des hydrocarbures aromatiques, c'est pourquoi on parle souvent d'une substitution aromatique électrophile . Dans le mécanisme, l'attaque de l'électrophile forme initialement ce que l'on appelle le complexe σ, un état de transition dans lequel le système aromatique est suspendu. Le groupe partant, généralement un proton, est ensuite séparé et le système aromatique est restauré.
Dans le troisième type de substitution, la particule attaquante est un radical , c'est pourquoi on l'appelle également substitution radicale . Cela se produit sous la forme d'une réaction en chaîne et a lieu, par exemple, dans la réaction d'alcanes avec des halogènes. Dans un premier temps, par exemple, la lumière, la chaleur ou la désintégration de molécules très instables forment quelques radicaux de démarrage. Dans la réaction en chaîne, la réaction se poursuit par le transfert du radical jusqu'à ce que la chaîne se rompt par la recombinaison de deux radicaux.
- Réactions lors de la réaction en chaîne d'une substitution radicalaire
Ajout / élimination
L' addition et la contrepartie, l' élimination , sont des réactions dans lesquelles le nombre de substituants sur l'atome de carbone change et de multiples liaisons sont formées ou clivées. Dans les réactions d'élimination, des liaisons doubles et triples sont créées en supprimant («éliminant») un substituant sur chaque atome de carbone de la liaison. Pour une élimination, il doit y avoir un groupe partant approprié sur un atome de carbone de la liaison en question, qui peut être séparé relativement facilement. Semblable à la substitution nucléophile, il existe plusieurs mécanismes possibles qui ont lieu en fonction de la molécule et des conditions et sont à leur tour nommés en fonction de l'ordre de réaction respectif. Dans le mécanisme E1, le groupe partant est initialement séparé avec la formation d'un carbocation. Dans l'étape suivante, la double liaison est formée avec la séparation d'un proton. En raison des conditions similaires des deux réactions, l'élimination E1 est toujours en concurrence avec la substitution S N 1.
Le premier ordre de réaction est le mécanisme E1cb, dans lequel le proton est séparé à l'aide d'une base et un carbanion est formé. Dans l'étape suivante, la double liaison est formée avec élimination du groupe partant.
Le mécanisme E2 nécessite également une base. Dans ce cas, cependant, l'attaque de la base et la séparation du groupe partant se déroulent de concert et aucun intermédiaire ionique n'est formé. Contrairement aux éliminations El, la stéréochimie dans le produit peut être déterminée ici, car une réaction de la base en position anti- groupe partant a lieu préférentiellement. En raison de conditions et de réactifs similaires, l'élimination E2 est toujours en concurrence avec la substitution S N 2.
La contrepartie de l'élimination est la réaction d'addition . Dans ce cas, les atomes ou molécules se fixent à des liaisons doubles ou triples et forment des liaisons simples. Réactions d'addition peut avoir lieu aussi bien sur des liaisons multiples CC, à savoir des alcènes ou des alcynes , et sur des liaisons multiples carbone-hétéroatome , tels que des groupes carbonyle , des groupes thiocarbonyle ou nitriles . Comme les substitutions, les ajouts peuvent également être divisés en plusieurs groupes en fonction de la particule attaquante. En addition électrophile , un électrophile, souvent un proton, attaque la double liaison pour former un ion carbénium. Celui-ci réagit avec les nucléophiles pour former le produit.
Il existe deux possibilités pour la formation de l'ion carbénium - de quel côté de la double liaison il se forme préférentiellement dépend, dans le cas d'alcènes asymétriques, de la stabilisation par différents radicaux. La règle de Markovnikov offre une règle quant au produit préféré .
Si l'addition d'un groupe fonctionnel doit avoir lieu sur l'atome de carbone le moins substitué de la double liaison, la substitution électrophile par des acides n'est pas possible. Une possibilité est l' hydroboration , dans laquelle l' atome de bore agit comme un électrophile et attaque donc l'atome de carbone le moins substitué conformément à la règle de Markovnikov. D'autres groupes fonctionnels peuvent ensuite être formés dans une étape supplémentaire par oxydation ou halogénation .
Alors que l'addition électrophile se produit principalement avec les alcènes et alcynes riches en électrons, l' addition nucléophile joue un rôle important dans les liaisons multiples carbone-hétéroatome et, surtout, leur représentant le plus important, le groupe carbonyle . Ceci est souvent associé à une élimination, de sorte que le groupe carbonyle est à nouveau présent après la réaction. Cela peut être fait dans le cas de dérivés d' acide carboxylique tels que les chlorures , esters ou anhydrides d'acide carboxylique qui ont un groupe partant approprié sur le groupe carbonyle. On l'appelle souvent le mécanisme d'élimination d'addition . Ceci est souvent catalysé par des acides ou des bases qui (dans le cas des acides) par fixation à l'atome d'oxygène augmentent l'électrophilie du groupe carbonyle ou (dans le cas des bases) la nucléophilie du nucléophile attaquant.
Selon le principe de la vinylogie, une attaque par addition nucléophile peut également avoir lieu sur la double liaison de composés carbonylés α, β-insaturés tels que les cétones ou les esters . Un représentant important de ce type de réaction est l' addition de Michael .
Comme les substitutions, les additions peuvent être déclenchées non seulement par des nucléophiles et des électrophiles, mais également par des radicaux. Comme pour la substitution de radicaux, l'addition de radicaux a également lieu sous la forme d'une réaction en chaîne. Cette réaction est à la base de la polymérisation radicalaire .
Autres mécanismes de réaction organique
Les réarrangements sont des réactions dans lesquelles les atomes ou les parties moléculaires d'un composé organique sont conservés mais réarrangés. Celles-ci comprennent des réactions de décalage d'hydrure telles que le réarrangement de Wagner-Meerwein , dans lequel un carbocation est initialement formé, qui est ensuite réarrangé en un carbocation plus stable en déplaçant un ion hydrure. Dans la plupart des cas, cependant, les réarrangements sont associés à la rupture et à la reformation des liaisons CC. Des exemples typiques de ceci sont des réarrangements sigmatropiques tels que le réarrangement Cope , dans lequel une liaison C - C est rompue et une autre est formée en même temps dans une réaction cyclique.
Comme les réarrangements sigmatropes, les cycloadditions appartiennent également aux réactions péricycliques . Dans cette réaction, une molécule cyclique est formée de plusieurs, généralement deux, doubles liaisons contenant des molécules. La cycloaddition la plus importante est la réaction de Diels-Alder , une cycloaddition [4 + 2] dans laquelle un diène et un alcène (également appelé diénophile) réagissent pour former un cycloalcène.
En plus de la réaction de Diels-Alder, il y a aussi la cycloaddition [2 + 2] , dans laquelle deux alcènes ou autres composés à doubles liaisons réagissent l'un avec l'autre comme des cétones. Des cycloadditions sont également possibles avec des 1,3-dipôles tels que l' ozone , le diazométhane ou les oxydes de nitrile . La question de savoir si et comment une cycloaddition a lieu dépend de la disposition des orbitales p des doubles liaisons impliquées.
Ceux-ci doivent être positionnés les uns contre les autres de manière à ce que les orbitales avec le même signe de la fonction d'onde se chevauchent et puissent ainsi interagir de manière constructive et former les liaisons simples énergétiquement plus favorables. Les cycloréactions peuvent être induites à la fois thermiquement et photochimiquement par irradiation avec de la lumière. Puisque pendant l'irradiation, des électrons sont amenés dans des orbitales qui ont une disposition et une symétrie différentes, des cycloadditions photochimiquement différentes sont possibles que thermiques. Les réactions de Diels-Alder sont des cycloadditions thermiques, tandis que les [2 + 2] cycloadditions doivent être induites par irradiation.
Les dispositions orbitales limitent les produits possibles et - dans le cas des matières de départ stéréoisomères - également leur stéréoisomérie . La manière dont cela se produit est décrite par les règles de Woodward-Hoffmann .
Réactions biochimiques
Les enzymes sont d'une importance capitale dans les réactions biochimiques . Ces protéines catalysent généralement spécifiquement une seule réaction de sorte que les réactions peuvent être contrôlées très précisément. Cependant, on connaît également des enzymes qui peuvent accélérer catalytiquement plusieurs fonctions spéciales. La réaction a lieu dans une petite partie de l'enzyme, le centre actif , tandis que le reste de l'enzyme est principalement utilisé pour la stabilisation. Le centre actif se trouve dans une fosse ou une rainure de l'enzyme. Pour l'activité catalytique, entre autres, les liaisons à l'enzyme, l' environnement chimique modifié, hydrophobe et la proximité spatiale des réactifs sont responsables, tandis que la forme particulière du centre actif est responsable de la sélectivité.
La totalité des réactions biochimiques dans le corps est appelée métabolisme . L'un des mécanismes les plus importants est le métabolisme de construction , dans lequel des substances naturelles complexes telles que des protéines ou des glucides sont synthétisées à partir de simples précurseurs dans divers processus contrôlés par l' ADN et des enzymes, comme la biosynthèse des protéines . En outre, il y a le métabolisme énergétique , à travers lequel l' énergie nécessaire à une réaction, telle que le métabolisme du bâtiment, est fournie à l'aide de réactions chimiques. Une source importante d'énergie est le glucose , que les plantes peuvent produire pendant la photosynthèse ou qui peut être consommé avec de la nourriture. Cependant, cela ne peut pas être utilisé directement; au lieu de cela, par la respiration cellulaire et la chaîne respiratoire, avec l'aide de l'oxygène, de l' ATP est généré, qui sert de fournisseur d'énergie pour d'autres réactions.
Application technique
Les réactions chimiques et leur mise en œuvre sont au cœur de la chimie technique . Ils sont utilisés en grand nombre pour la synthèse de nouveaux composés à partir de matières premières naturelles telles que le pétrole brut , les minerais , l' air ou les matières premières renouvelables . Souvent, des produits intermédiaires simples sont d'abord synthétisés, à partir desquels des produits finaux tels que des polymères , des détergents , des pesticides , des produits pharmaceutiques ou des colorants sont fabriqués. Les réactions techniques ont lieu dans des réacteurs tels que des réservoirs agités ou des tubes d' écoulement .
Il est particulièrement important que la technologie rende le processus de réaction aussi économique que possible. Celles-ci incluent, par exemple, une utilisation minimale de matières premières et d'énergie, des vitesses de réaction élevées et des rendements élevés avec le moins de déchets possible. L'utilisation de catalyseurs qui à la fois augmente la vitesse de réaction et réduit la consommation d'énergie est donc d'une grande importance. Afin de garantir de petites quantités de déchets, les réactions sont souvent choisies dans des applications techniques à forte économie d'atomes , c'est-à-dire dans lesquelles une grande partie des matières de départ se trouve dans le produit souhaité.
observation
La manière dont les réactions chimiques peuvent être observées et suivies dépend fortement de la vitesse de la réaction. Dans le cas de réactions lentes, des échantillons peuvent être prélevés et analysés pendant la réaction. Les concentrations des ingrédients individuels du mélange réactionnel sont déterminées et l'évolution de la concentration surveillée pendant la réaction. Si les concentrations ne changent plus après un certain temps, la réaction est terminée et l'équilibre est atteint. Pour s'assurer que la réaction ne progresse pas trop pendant la mesure, des méthodes d'analyse rapides et faciles à mettre en œuvre, telles que la chromatographie sur couche mince ou la spectrométrie de masse, sont utilisées. Une observation continue pendant la réaction est également possible en utilisant des méthodes spectroscopiques si, par exemple, la concentration d'une substance colorée dans le mélange peut être déterminée. Si cela n'est pas possible, un marqueur spécial, tel qu'un isotope radioactif , peut parfois être utilisé, dont la concentration est ensuite mesurée. Ceci est utilisé, par exemple, en scintigraphie pour observer les processus métaboliques dans lesquels certains éléments s'accumulent dans des organes individuels. Dans des conditions favorables, les réactions de surface peuvent être observées directement au niveau moléculaire avec un microscope à effet tunnel .
Pour les réactions de détection, ce que l'on appelle les indicateurs de jeu jouent un rôle important, qui sont des substances qui changent, par exemple de couleur lorsqu'un certain point de la réaction est atteint. Les indicateurs acido-basiques, qui changent de couleur dès qu'une solution a été neutralisée et que la valeur du pH passe d'acide à basique ou vice versa, sont surtout connus . Des réactions de précipitation sélective peuvent également être utilisées pour la détection de substances ou, par exemple, dans le processus de séparation des cations pour une séparation avant la détection précise.
Plus une réaction se produit rapidement, plus elle devient difficile à observer. La spectroscopie ultrarapide est utilisée pour les investigations cinétiques des réactions rapides et permet, à l'aide de lasers femtosecondes , une résolution temporelle de l'ordre de la picoseconde ou de la femtoseconde. De cette manière, des états de transition de courte durée peuvent également être observés pendant la réaction.
Littérature
- Entrée sur réaction. Dans: Römpp Online . Georg Thieme Verlag, consulté le 20 juin 2014.
- Peter W. Atkins , Julio de Paula: chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 .
- AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , pp. 186-258.
- Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 .
liens web
- Entrée sur la réaction chimique . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / livre d'or.C01033 .
Preuve individuelle
- ↑ Jost Weyer: Nouvelles interprétations de l'alchimie. Dans: La chimie à notre époque. 1973, 7.6, pages 177-181, doi: 10.1002 / ciuz.19730070604 .
- ^ William H. Brock: l'histoire de la chimie de Vieweg . Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 , pp. 34-55.
- ^ William H. Brock: l'histoire de la chimie de Vieweg . Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 , pp. 104-107.
- ↑ Entrée sur l'équation de réaction chimique . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / livre d'or.C01034 .
- ^ EJ Corey: Conférence de Robert Robinson. Pensée rétrosynthétique - éléments essentiels et exemples. Dans: Chem. Soc. Rev. 1988, 17, pages 111-133, doi: 10.1039 / CS9881700111 .
- ↑ Entrée sur les réactions élémentaires. Dans: Römpp Online . Georg Thieme Verlag, consulté le 20 juin 2014.
- ↑ Peter W. Atkins, Julio de Paula: Chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , pp. 106-108.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , p. 897.
- ↑ Peter W. Atkins, Julio de Paula: Chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , p. 150.
- ↑ Peter W. Atkins, Julio de Paula: Chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , p. 963.
- ^ Un b A. F. Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , pp. 1380-1400.
- ↑ Entrée sur les précipitations. Dans: Römpp Online . Georg Thieme Verlag, consulté le 20 juin 2014.
- ^ Ralf Alsfasser, Erwin Riedel , C. Janiak, HJ Meyer: Chimie inorganique moderne. 3. Édition. de Gruyter, 2007, ISBN 978-3-11-019060-1 , p. 171.
- ↑ Peter W. Atkins, Julio de Paula: Chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , pp.937-950.
- ↑ Christoph Elschenbroich: Organometallchemie. 6e édition, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8 , p. 263.
- ↑ Reinhard Brückner : mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , pp. 63-77.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , pp.203-206.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 16.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 183.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 192.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 172.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 125.
- ↑ Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II, Volume 2. 6ème édition, Springer, 2008, ISBN 978-3-540-77106-7 , p. 273.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , p. 580.
- ↑ Manfred Lechner, Klaus Gehrke, Eckhard Nordmeier: Makromolekulare Chemie. 3e édition, Birkhäuser, Bâle 2003, ISBN 3-7643-6952-3 , pp. 53–65.
- ↑ Eberhard Breitmaier, Günther Jung: Chimie organique. 5e édition, Thieme, Stuttgart 2005, ISBN 3-13-541505-8 , pp.447-453.
- ↑ Reinhard Brückner: mécanismes de réaction. 3e édition, Spektrum Akademischer Verlag, Munich 2004, ISBN 3-8274-1579-9 , pp. 637–647.
- ^ RB Woodward, Roald Hoffmann: stéréochimie des réactions électrocycliques. Dans: J. Am. Chem. Soc. 1965, 87, 2, pages 395-397, doi: 10.1021 / ja01080a054 .
- ^ Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. 16e édition, Georg Thieme Verlag, 2005, ISBN 978-3-13-357815-8 , pp. 55-56.
- ^ Gerhard Emig, Elias Klemm: Chimie technique. 5e édition, Springer, 2005, ISBN 978-3-540-23452-4 , pp. 33-34.
- ↑ Barry Trost : L'économie atomique - une recherche d'efficacité synthétique. Dans: Science . 1991, 254, pages 1471-1477, doi: 10.1126 / science.1962206 .
- ↑ Thomas Waldmann, Daniela Künzel, Harry E. Hoster, Axel Groß, R. Jürgen Behm: Oxydation d'un adlayer organique: une vue à vol d'oiseau. Dans: Journal of the American Chemical Society. 134, n ° 21, 2012, pages 8817-8822, doi: 10.1021 / ja302593v .
- ↑ Peter W. Atkins, Julio de Paula: Chimie physique. 4e édition, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , p. 987.











![{\ displaystyle v = - {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = k \ cdot [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02e857d43648c97f61048ef4d2b8d945278946db)
![\ mathrm {[A]} _ {t} = \ mathrm {[A]} _ {0} \ cdot e ^ {- k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/896c5da2771260d7b5dbd5f28a9406cda180e268)