cristal

Un cristal est un solide dont les éléments constitutifs - par ex. B. Les atomes , les ions ou les molécules sont régulièrement disposés dans une structure cristalline . Les matières cristallines bien connues sont le sel de table , le sucre , les minéraux et la neige - mais aussi les métaux . En raison de l'arrangement régulier des atomes ou des molécules, les cristaux n'ont pas de symétries continues, mais discrètes ; on parle d'ordre à longue distance ou de symétrie translationnelle .
La science des propriétés et des formes des cristaux est la cristallographie . La métallographie et la minéralogie sont étroitement liées .
Définition plus précise, distinctions
Un cristal est un corps homogène car il est matériellement et physiquement uniforme. Mais de nombreuses propriétés physiques dépendent de la direction spatiale, i. H. un cristal est anisotrope .
Avant 1992, les cristaux étaient définis par leur périodicité : En ce sens, un cristal est périodiquement constitué en trois dimensions à partir d'unités structurelles constantes. Cette unité structurelle est appelée maille élémentaire ou maille élémentaire .
Depuis 1992, un cristal est défini selon l' Union internationale de cristallographie IUCr par ses ordres de diffraction discrets (lorsqu'il est éclairé par des rayons X). Il a donc un ordre à longue distance , mais n'est pas nécessairement périodique. Cette définition a été renforcée par les quasicristaux découverts en 1984 , qui forment un sous-groupe des cristaux apériodiques . Néanmoins, les cristaux périodiques forment de loin le plus grand sous-groupe de cristaux.
Une distinction est faite en fonction des caractéristiques de la forme extérieure
- cristaux inaltérés, dits idiomorphes ( du grec ancien ἲδιος idios possèdent et forme de morph ) et
- cristaux de xénomorphe (grec ancien ξένος Xenos étrange et morph shape) dont la forme extérieure est déterminée par des interfaces étrangères .
La forme extérieure du cristal idiomorphe indique la structure cristalline respective . Donc z. B. Les cristaux de chlorure de sodium qui ont poussé sans être dérangés (sel de table, halite minérale) sont en forme de cube. Même avec des cristaux idiomorphes, il existe généralement une certaine distorsion dans la nature, c'est-à-dire que les longueurs des bords (mais pas les angles) peuvent s'écarter considérablement de la forme idéale (cf. loi de la constance des angles ).
La forme externe d'un cristal est déterminée par les caractéristiques indépendantes de l' habit et du costume du cristal . Les faces cristallines sont comme des plans de réseau par les indices de Miller décrits.
Les types de cristaux peuvent également être différenciés par le type de liaison entre leurs éléments constitutifs (par exemple, cristal ionique ).
Puisque la propriété caractéristique des cristaux est l'arrangement régulier dans les trois directions spatiales , des corps sont également concevables dont les éléments constitutifs ne sont répétés que dans une ou deux directions spatiales. On peut alors parler de cristaux unidimensionnels et bidimensionnels . Les protéines membranaires sont présentes dans la nature , qui sont disposées sous forme de cristaux bidimensionnels dans la biomembrane . Un exemple est la bactériorhodopsine . En biologie structurale , des cristaux 2D sont cultivés afin de déterminer les positions atomiques des macromolécules cristallisées par cryomicroscopie électronique .
Outre les cristaux, il existe également des corps qui n'ont pas d'ordre interne à longue distance et sont appelés amorphes . Un exemple est le verre (également connu sous le nom de cristal au plomb et autre verre de cristal ).
Si un liquide est anisotrope et présente donc certaines des propriétés d'un cristal, il s'agit d'un cristal liquide .
Origine du mot
Le terme cristal vient du mot grec κρύσταλλος krýstallos (à κρύος krýos « glacial, givre, glace »). Tout d'abord, dans l'œuvre d'Homère , cela signifie « glace » - plus tard tout ce qui ressemble à la glace, léger et transparent. Le cristal de roche en particulier , mais aussi les pierres précieuses colorées et le verre sont ainsi appelés (par exemple chez Strabon et Claudius Aelianus ).
Dans la déjà ancienne Grèce alimenté les mines étaient probablement quartz cristaux découverts. Ils ont été pris pour de la glace qui a dû se former à des températures si basses qu'elle ne pouvait plus fondre. Ce point de vue était répandu jusqu'au début du Moyen Âge. Depuis le latin Crystallus (également cristallus , en particulier « cristal de roche », et lapis cristallus ), l' ancien haut allemand nom cristallographique a été formé, qui a changé de cristal au fil du temps . Au 19ème siècle, le cristal était également utilisé .
Structure et classification des cristaux périodiques

La direction et la longueur des vecteurs par lesquels une structure cristalline peut être déplacée de sorte que les positions atomiques se répètent sont décrites par les vecteurs de translation ou de base. Par conséquent, la structure de chaque type de cristal est représentée avec son propre système de coordonnées spécifique , le système d'axes . En plus du déplacement, une structure cristalline peut également être tournée mentalement autour de ces axes jusqu'à ce que la structure tournée coïncide avec la structure d'origine. Parce que la symétrie de translation doit être préservée, les symétries de rotation ne peuvent se produire que qui décrivent une, deux, trois, quatre ou six répétitions dans une rotation complète (360 °). On parle d'axes à 1, 2, 3, 4 ou 6 chiffres. Il existe des cristaux qui, en plus des axes de rotation et de translations, présentent d'autres éléments de symétrie , à savoir des plans miroirs et des centres d'inversion , ainsi que des couplages entre ces symétries pour former des inversions de rotation , des réflexions de glissement et des vissages .
Les propriétés de symétrie sont utilisées pour classer les cristaux. Le nombre de combinaisons envisageables et de possibilités de couplage d'éléments de symétrie est limité (voir aussi théorie des groupes ). Il existe 17 groupes cristallographiques plans dans les cristaux bidimensionnels et 230 groupes spatiaux cristallographiques dans les cristaux tridimensionnels , tous répertoriés dans les International Tables for Crystallography , Vol .
Si un nouveau cristal est examiné, le groupe spatial est initialement inconnu. Lors de la description de la forme externe du cristal, il ne peut être attribué qu'à l'un des 32 groupes de points (également appelés classes de cristal). Ces groupes de points décrivent les propriétés de symétrie macroscopique des cristaux et résument les groupes spatiaux qui ne diffèrent que par la symétrie de translation. La traduction ne joue aucun rôle dans l'observation externe des cristaux. Parce que les angles entre les faces cristallines sont les mêmes pour chaque type de cristal et sont souvent compatibles avec une symétrie de rotation (par exemple 90 ° pour halite avec une symétrie de rotation quadruple), sept systèmes cristallins sont utilisés pour décrire la morphologie cristalline , dans laquelle la position et la longueur relative des axes des cellules différenciées. Un cristal est triclinique , monoclinique , orthorhombique , tétragonal , trigonal , hexagonal ou cubique , selon son appartenance au système cristallin correspondant .
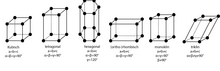
Auguste Bravais a classé les différentes grilles de translation possibles. Ces grilles sont constituées de parallélépipèdes identiques dont les coins représentent les points de grille. Afin de pouvoir décrire la symétrie de certains réseaux, il a autorisé non seulement des cellules unitaires primitives (avec un point de réseau par cellule) mais également des cellules unitaires plus grandes qui sont centrées sur le visage ou le corps. Un exemple de cellule unitaire centrée sur le visage est illustré à la Fig. 5. Il y a 14 grilles de Bravais dans l'espace tridimensionnel .
Dans l' analyse de la structure cristalline , les diagrammes de diffusion de la diffraction des rayons X peuvent être divisés en onze groupes ponctuels centrosymétriques, appelés groupes de Laue ou classes de Laue . Parce que même avec des structures cristallines non centrosymétriques, des motifs de diffraction centrosymétriques apparaissent, car les réflexions se produisent sous forme de paires de Friedel avec normalement la même intensité. Les groupes de Lau peuvent donc être dérivés en ajoutant un centre de symétrie au groupe ponctuel du cristal.
La structure cristalline n'est pas spécifique à une substance, c'est-à-dire qu'une substance avec une certaine composition chimique peut avoir différentes structures thermodynamiquement stables en fonction des conditions extérieures (pression, température). Les différentes structures cristallines d'une même substance sont appelées modifications ; l'existence de diverses modifications est appelée polymorphisme . Les modifications représentent différentes phases en termes de physico- chimie , dont les plages de stabilité peuvent être représentées dans des diagrammes de phases . En plus de tous les noms propres, les modifications individuelles ou les phases d'une substance sont généralement numérotées consécutivement avec de petites lettres grecques (pour le fer, par exemple α- ( ferrite ), γ- ( austénite ), -, -fer ; voir le diagramme fer Carbone ).
Cristallisation
Un cristal est créé lorsque des atomes ou des molécules forment une structure régulière avec un ordre à longue distance. Dans les systèmes mono-substance , la cristallisation s'effectue à partir d'une autre phase cristallisée, à partir de la vapeur ou de la masse fondue . De plus, des cristaux peuvent se former à partir de systèmes à plusieurs composants, à savoir à partir d'une solution . Pour permettre la cristallisation, l'état des atomes ou des molécules ne doit pas être en équilibre. Dans le cas de la vapeur et des solutions, on parle de sursaturation , dans le cas d'un bain de fusion, de surfusion .
La vitesse joue un rôle dans la croissance des cristaux. Dans le cas d'une fusion, par exemple, la température doit descendre assez lentement en dessous du point de fusion . Ensuite, le mouvement thermique des atomes individuels devient si petit que les liaisons mutuelles ne peuvent plus être rompues par des vibrations - un réseau uniforme se forme, caractérisé par un ordre à longue distance. Si, par contre, la température de la fonte chute si rapidement que les atomes ne peuvent pas s'arranger périodiquement, il se crée un matériau amorphe, un verre qui n'a qu'un ordre à courte distance . En raison de sa structure ordonnée sur un réseau, le cristal a une enthalpie libre inférieure à celle du verre amorphe .
La formation d'un cristal est un processus exergonique : bien que l' entropie dans le système diminue (en raison d'une augmentation de l'ordre à longue distance), à des températures allant jusqu'au point de fusion, cela est surcompensé par une diminution de l' enthalpie due à l'attraction entre les particules (= chaleur de cristallisation).
Le point de départ de la formation des cristaux est un noyau cristallin qui se développe à mesure que la température baisse. S'il y a beaucoup de tels noyaux cristallins ou si la cristallisation commence à plusieurs endroits en même temps, un polycristal est créé . Dans de nombreux cas, deux cristaux de même structure et composition mais d'orientation différente dans l'espace ( cristal jumeaux ) croissent ensemble pendant la cristallisation .
La recristallisation est la modification d'une structure cristalline causée par des changements de facteurs externes tels que les conditions de pression et de température. Ici le solide cristallin change de modification .
La production artificielle de cristaux est connue sous le nom de cristallisation .
Propriétés
Les cristaux inorganiques non métalliques sont plus durs , mais aussi plus cassants. En équilibre thermodynamique, tous les métaux se solidifient généralement sous forme cristalline.
Le comportement de la lumière dans les cristaux est décrit par l' optique cristalline . Les propriétés et phénomènes importants qui y sont associés sont l'activité optique , la polarisation , la biréfringence et le pléochroïsme . Les structures diélectriques périodiques , appelées cristaux photoniques , présentent de nouvelles propriétés optiques.
Certains cristaux, par ex. B. les cristaux de quartz ont des propriétés piézoélectriques . Ils créent une tension électrique lorsqu'ils sont déformés et se déforment lorsqu'une tension électrique est appliquée. Cet effet est dans les briquets piézo utilisés pour générer des étincelles . Dans l' électronique piézoélectrique servent oscillateurs à quartz comme horloge (par exemple. Comme dans les montres à quartz ). Certains cristaux piézoélectriques, mais pas tous, convertissent une différence de température en séparation de charge. Cette propriété est appelée pyroélectricité . De tels cristaux sont utilisés dans les détecteurs de mouvement et les capteurs de température . Un cas particulier de la pyroélectricité est la ferroélectricité : Avec les cristaux ferroélectriques, la polarisation de la polarisation électrique peut être inversée en appliquant une tension.
Rupture de réseau
Un vrai cristal contient des défauts de réseau , c'est-à-dire que l'arrangement périodique tridimensionnel des atomes est perturbé. Il y a des erreurs de point, des erreurs de ligne, des erreurs de zone et des erreurs de volume. Les erreurs ponctuelles sont les seules erreurs de réseau qui se produisent également dans l'équilibre thermodynamique . Un cristal sans défauts de réseau aurait un état d' entropie minimale et ne peut pas être atteint selon la deuxième loi de la thermodynamique . Les monocristaux cultivés en laboratoire ont une densité de dislocations de l'ordre de 10 3 - 10 5 cm -2 , les cristaux réguliers et polycristaux de 10 5 - 10 9 cm -2 et les cristaux fortement déformés jusqu'à 10 14 cm -2 . Pour les propriétés cristallo-optiques , les erreurs de point et de volume sont généralement des défauts de ligne caractéristiques ( dislocations ) et des défauts de surface ( joints de grains ), contrairement aux propriétés mécaniques.
Formulaires et exemples
Monocristal et polycristal
En règle générale, un solide cristallin se présente sous la forme d'un polycristal et non d'un monocristal, c'est-à-dire qu'il se compose de nombreux petits cristaux ( cristallites ) qui sont séparés les uns des autres par des joints de grains . Par exemple, les objets métalliques, les fils, etc. sont généralement des polycristaux. Il existe un corps de différents types de cristaux , les interfaces entre eux sont appelées limites de phase .
Minéraux
De nombreux minéraux sont capables de développer une variété de formes et de couleurs de cristaux. Les exemples les plus connus sont, d'une part, le quartz , dont les formes couvrent toute la gamme allant de l'incolore macrocristallin ( cristal de roche ) à la couleur microcristalline ( agate ) et, d'autre part, la calcite avec une richesse de variétés similaire .
Les plus gros cristaux du monde ont été découverts dans la mine de Naica en 2000 . Ils sont constitués de gypse de type Marienglas , mesurent jusqu'à 14 m de long et pèsent jusqu'à 50 tonnes.
Le diamant , une forme cristalline du carbone , est le minéral naturel le plus dur. Le silicium cristallise également sous forme de diamant .
Applications techniques
Le silicium est actuellement la substance la plus fréquemment utilisée en grande quantité sous forme de monocristal (monocristal), notamment dans la technologie des semi-conducteurs . Aujourd'hui, un cristal cylindrique "tiré" de la fonte d'un diamètre de 30 cm est courant, un procédé qui remonte à Jan Czochralski vers 1916.
L'arséniure de gallium (GaAs), qui est également utilisé comme semi-conducteur, a la structure dite de mélange de zinc .
La nanotechnologie traite, entre autres, des nanocristaux .
De petits cristaux de diamant, de corindon et de carbure de silicium sont utilisés en suspension, en vrac ou liés comme abrasifs, les diamants individuels également comme outils de coupe.
Les cristaux piézo peuvent être des microphones ou des haut-parleurs, des capteurs de force ou des actionneurs.
Les préparations dans les usines chimiques sont nettoyées par recristallisation.
Cependant, la cristallisation est indésirable dans la fabrication du verre. Dans la production de métal, on s'efforce généralement d'obtenir les cristallites ou les grains les plus fins possibles.
Cristaux organiques
Substances organiques, par ex. Des cristaux, tels que le sucre et les protéines , se forment - ces derniers, cependant, que dans des cas exceptionnels. Par exemple, les peroxysomes des plantes contiennent des cristaux de catalase qui peuvent être visualisés en microscopie électronique . L' enzyme catalase est une protéine. La cristallographie des protéines s'intéresse à la croissance cristalline des protéines pour l' analyse structurelle .
Colloïdes
Les colloïdes forment généralement des paracristaux parce que tous les blocs de construction ne sont pas identiques, les blocs de construction eux-mêmes sont généralement anisotropes et parce que des liaisons fortes et faibles entre les atomes et les groupes d'atomes coexistent. Les suspensions de sphères dures monodispersées , en revanche, peuvent former des cristaux car les éléments constitutifs sont tous identiques et isotropes.
Littérature
- Walter Borchardt-Ott : Cristallographie. Springer, Berlin 2002. ISBN 3-540-43964-1 .
- Dorothy G. Bell : Théorie des groupes et réseaux cristallins. Dans : Examen de la physique moderne. Volume 26, n° 3, 1954, page 311.
- Charles Kittel : Introduction à la physique du solide. Oldenbourg, Munich 2002. ISBN 3-486-27219-5 .
- Will Kleber , Hans-Joachim Bautsch , Joachim Bohm : Introduction à la cristallographie. Verlag Technik, Berlin 1998. ISBN 3-486-27319-1 .
- Werner Massa : Détermination de la structure cristalline. Teubner, Wiesbaden 2009. ISBN 978-3-8348-0649-9 .
- Ulrich Müller : Chimie structurale inorganique. Teubner, Wiesbaden 2004. ISBN 3-519-33512-3 .
- Lesley Smart, Elaine Moore : Introduction à la chimie du solide. Vieweg, Wiesbaden 1997, ISBN 3-528-06773-X .
- Robert F. Symes et RR Harding : pierres précieuses et cristaux. Trésors mystérieux de la terre; Apparence, développement, traitement , Gerstenberg Verlag, Hildesheim 1991, ISBN 3-8067-4560-9 .
liens web
- Atlas minéral : Cristal (Wiki)
- The Giant Crystal Project - Documentation des plus gros cristaux du monde
- Informations sur le système cristallin et la synthèse cristalline
- Minéraux alpins - cristal
Remarques
- ↑ rotation inversions se composent de rotation et d' inversion; ils sont généralement marqués avec et ainsi de suite.
- Les réflexions glissantes consistent en une translation et une réflexion ; Symbole dépendant de l'axe de translation
- Les vis consistent en une rotation et une translation ; z. B. est le symbole de la rotation de 180° et de la translation d'un demi vecteur de grille
Preuve individuelle
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 14.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 19.
- ^ "Dictionnaire en ligne" de l'Union internationale de cristallographie.
- ↑ Hayato Yamashita, Kislon Voitchovsky, Takayuki Uchihashi, Sonia Antoranz Contera, John F. Ryan et Toshio Ando (2009) : Dynamics of bactériorhodopsin 2D crystal observe by high speed atatomic force microscopy, Journal of Structural Biology, Volume 167, Issue 2, Pages 153-158, ISSN 1047-8477 , doi : 10.1016 / j.jsb.2009.04.011 .
- ^ Michael G. Rossmann et Eddy Arnold, rédacteurs (2001) : International Tables for Crystallography Volume F : Crystallography of Biological Macromolecules. Kluwer Academic Publishers, Dordrecht et al., pages 459f.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 199.
- ^ Wilhelm Pape : Dictionnaire concis de la langue grecque. Dictionnaire concis grec-allemand. 3. Édition. Brunswick 1914.
- ↑ Otto Zekert (Ed.) : Dispensatorium pro pharmacopoeis Viennensibus en Autriche 1570. Ed. Par l'Association des pharmaciens autrichiens et la Société pour l'histoire de la pharmacie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, page 140.
- ↑ Wouter S. van den Berg (éd.) : Eene Middelnederlandsche vertaling van het Antidotarium Nicolaï (Ms. 15624–15641, Kon. Bibl. Te Brussel) avec le texte latin du premier uitgave van het Antidotarium Nicolaï imprimé. Edité par Sophie J. van den Berg, NV Boekhandel en Drukkerij EJ Brill , Leiden 1917, p.230.
- ↑ Wolfgang Pfeifer et al. Dictionnaire étymologique allemand. dtv, Munich 1995, ISBN 3-423-03358-4 , page 735.
- ↑ a b Helmut GF Winkler: Cent ans de réseau de Bravais. Dans : Les sciences naturelles. Volume 37, n° 17, 1950, pp. 385-390, doi : 10.1007 / BF00738360 .
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 17.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 23.
- ^ Siegfried Haussühl (1993) : Kristallgeometrie. Maison d'édition Weinheim. ISBN 3-527-29018-4 , page 66.
- ↑ Werner Massa (1996) : Détermination de la structure cristalline Teubner Verlag. ISBN 3-519-13527-2 , page 60ff.
- ^ Siegfried Haussühl (1993) : Kristallgeometrie. Maison d'édition Weinheim. ISBN 3-527-29018-4 , page 57.
- ^ Theo Hahn, Ed. (2005) : Tables internationales pour la chrystallographie, Volume A. Springer Verlag. ISBN 0-7923-6590-9 .
- ↑ Zbigniew Dauter et Mariusz Jaskolski (2010) : Comment lire (et comprendre) le volume A des tables internationales de cristallographie : une introduction pour les non-spécialistes. J. Appl. Cristal. ( ISSN 0021-8898 ), 43, 1150–1171, doi : 10.1107 / S0021889810026956 , en ligne (PDF ; 3,3 Mo) consulté le 20 décembre 2010.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 67.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 22.
- ^ Theo Hahn, Ed. (2005) : Tables internationales pour la chrystallographie, Volume A. Springer Verlag. ISBN 0-7923-6590-9 , page 762.
- ^ Will Kleber, Hans-Joachim Bautsch, Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 202
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , p. 267-272.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 262.
- ^ Will Kleber, Hans-Joachim Bautsch et Joachim Bohm (1990) : Introduction à la cristallographie. Technologie de la maison d'édition. ISBN 3-341-00479-3 , page 264.
- ↑ H. Föll et al. : Introduction to Materials Science I. TF du CAU de Kiel, consulté le 23 octobre 2020 .
- ↑ Magazine GEO n°05/08. Spéléologie : Dans la chambre des géants de cristal , page 2 sur 4 .
- ↑ Elmar Weiler et Lutz Nover (2008) : Botanique générale et moléculaire. Georg Thieme Verlag, Stuttgart et New York. ISBN 978-3-13-147661-6 , page 73, figure 2.21 et page 327, figure 10.8.