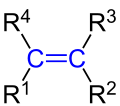Alcènes
| Alcènes |
|
Formule développée générale pour les alcènes avec la double liaison caractéristique C = C entre deux atomes de carbone hybrides sp 2 ( marqués en bleu ). Ce qui suit s'applique: R 1 à R 4 sont des atomes d'hydrogène ou des radicaux alkyles. Dans les diènes, l'un des radicaux R 1 à R 4 est un groupe alcényle . |
| L'éthylène - également appelé éthylène - est l'alcène le plus simple. |
| Propène, souvent appelé propylène. |
| 1-butène ou 1-butène |
| Isobutène, nom IUPAC correct: 2-méthylpropène. |
| cis -2-butène ou ( Z ) -2-butène |
| trans -2-butène ou ( E ) -2-butène |
Les alcènes (anciennement également oléfines ) sont des composés chimiques du groupe des hydrocarbures aliphatiques qui ont une double liaison carbone-carbone dans n'importe quelle position dans la molécule. Les alcènes sont des composés insaturés contrairement aux alcanes , dans lesquels toutes les valences de l'atome de carbone sont couvertes ( saturées ). Les alcènes se produisent à petite échelle dans le pétrole , dans la nature, ils sont utilisés comme phéromones et phytohormones . Ce sont les produits de base les plus importants de la chimie organique industrielle.
Les alcènes forment une série homologue avec la formule brute générale C n H 2n commençant par éthène . Le nom obsolète oléfines dérive de l'ancien nom oléfine d'éthène, car il forme des liquides huileux insolubles dans l'eau avec des halogènes, qui consistent en haloalcanes . Il existe également des alcènes cycliques, les cycloalcènes , dont le représentant le plus important est le cyclohexène .
caractéristiques
Les alcènes de l'éthène (C 2 H 4 ) au butène (C 4 H 8 ) sont gazeux et donc très volatils. Du pentène à 5 au pentadécène à 15 atomes de carbone, les alcènes sont liquides. Les alcènes avec plus de 15 atomes de carbone sont solides (dans chaque cas dans des conditions standard ). Les alcènes sont peu solubles dans l'eau; ils brûlent avec une flamme de suie. Les alcènes sont réactifs. La double liaison faible offre un point d'attaque pour les réactifs, plus précisément c'est la liaison π qui est attaquée électrophile. Les alcènes réagissent avec les halogènes pour former des dihaloalcanes. Cela se produit par une addition électrophile.
Voici les alcènes les plus importants de l'éthène (C 2 H 4 ) au décène (C 10 H 20 ) avec des noms et des formules empiriques:
- Éthène : C 2 H 4
- Propène : C 3 H 6
- Butène : C 4 H 8
- Pentène : C 5 H 10
- Sorcières : C 6 H 12
- Heptène : C 7 H 14
- Octène : C 8 H 16
- Non : C 9 H 18
- Décène : C 10 H 20
Il existe plusieurs isomères structuraux du butène et des alcènes supérieurs. La formule empirique générale des alcènes non substitués est: C n H 2n .
Nomenclature et isomères
Nomenclature générale
En général, les alcènes sont nommés selon IUPAC de la même manière que les alcanes, le suffixe -an étant remplacé par -en .
La position de la double liaison dans la chaîne carbonée est indiquée dans le nom par un nombre qui désigne l'atome de carbone où commence la double liaison. Il compte comme un groupe fonctionnel et doit être pris en compte pour l'ordre de numérotation, c'est-à-dire avoir le plus petit nombre possible. Dans le cas de molécules à plusieurs groupes fonctionnels, le nombre est placé directement avant le -en , sinon également avant le nom. Les doubles liaisons multiples sont précédées du chiffre grec correspondant.
| ( EZ ) nomenclature des alcènes. La priorité CIP des quatre substituants est a > b et c > d . |
En plus de l ' isomérie structurale , dans laquelle les atomes de carbone sont disposés différemment, l' isomérie cis - trans peut également se produire dans les alcènes à la double liaison C = C.
Puisque la double liaison, contrairement à la liaison simple, ne peut pas tourner librement, il peut y avoir deux arrangements possibles lorsque des atomes ou des groupes d'atomes sont attachés à la double liaison. Les isomères cis-trans diffèrent par leurs propriétés physiques et chimiques. Ils peuvent être distingués par le moment dipolaire et par spectroscopie IR . Alors que le cis est mentionné dans le nom de la connexion, le trans peut également être omis.
L' isomérie cis - trans peut être retracée à l'exemple des but-2-ènes isomères . Dans le cis -but-2-ène, les deux groupes méthyle se trouvent en tant que résidus de chaîne de ce côté (latin: cis ), c'est- à- dire du même côté. Dans le cas du trans -but-2-ène, les groupes méthyle sont de l'autre côté (latin: trans ) de la double liaison.
L' IUPAC a remplacé la désignation cis / trans (car elle est facilement trompeuse s'il y a plus de deux substituants; il suffit de regarder ( E ) -2-bromo-1-chloro-1-fluoro-éthène!) Par E / Z , où ( e ) ( e ntgegengesetzt) généralement - mais pas toujours - pour les peuplements trans et ( Z ) ( z ogether) pour cis . La position mutuelle des substituants avec la priorité CIP la plus élevée est donnée. Pour plus d'informations, voir isomérie ( E , Z ) .
Traditionnellement, certaines substances simples à isomérie ( E , Z ) ont des noms différents: l'acide fumarique [( E ) -butènedioïque] et l'acide maléique [( Z ) -butènedioïque] et leurs dérivés en sont des exemples.
Sert et polyènes
Les composés avec deux doubles liaisons sont appelés diènes , et ceux avec trois doubles liaisons sont appelés triènes . Ceux-ci sont appelés polyènes en général . La dénomination des molécules suit les mêmes règles que pour les alcènes mono-insaturés, voir 1,3-butadiène et isoprène . Le nombre d ' isomères cis - trans possibles augmente considérablement car il existe des isomères cis - trans pour chacune des doubles liaisons .
utilisation
En raison de la double liaison très réactive, les alcènes sont des matières premières importantes pour de nombreux autres matériaux de base dans l'industrie chimique.
Les alcènes sont utilisés comme carburants et pour la production d' hydrocarbures halogénés , d' alcools , de cétones , de glycols , d'oxydes d'oléfines, de plastiques et de composants détergents . Le propène est utilisé pour la synthèse de par ex. B. glycérine , phénol , alcool isopropylique , résines époxy et nécessaires à la polymérisation du polypropylène .
Méthode de production
Processus de fabrication en général
Les alcènes peuvent être préparés par diverses méthodes. Une possibilité est la déshydrogénation pyrolytique et le clivage des alcanes ( craquage ). Les alcanes à chaîne courte sont divisés en alcènes et en hydrogène à 450-500 ° C en présence de catalyseurs à oxydes mixtes. Dans le cas des alcanes supérieurs, cependant, ce procédé n'a pas beaucoup de sens car il peut produire de nombreux isomères différents , dont la séparation est très laborieuse, voire impossible.
Une autre possibilité de produire des alcènes est l'hydrogénation partielle des alcynes . Les alcynes sont hydrogénés en présence du catalyseur Lindlar . Ce catalyseur légèrement empoisonné empêche l'hydrogénation supplémentaire des alcènes en alcanes . Parce que la molécule d'hydrogène s'approche de la triple liaison d'un côté, seuls les alcènes ( Z ) sont formés.
- L'éthyne est hydrogénée en éthène en absorbant un équivalent d' hydrogène.
β éliminations
En général, les composés avec le fragment structurel CH-CX peuvent être convertis en un alcène avec le fragment structurel C = C par séparation de HX. Dans l'éduit avec le fragment de structure CH-CX, le H et le groupe X sont liés à des atomes de carbone directement adjacents.
Déshydratation
La déshydratation des alcools a lieu dans un environnement acide. L'eau peut être éliminée beaucoup plus facilement des alcools tertiaires que des alcools secondaires ou même primaires.
Les alcools peuvent également être déshydratés en alcènes à des températures élevées (par exemple environ 200 à 250 ° C) en utilisant des catalyseurs poreux avec une surface interne élevée (comme l'oxyde d'aluminium Al 2 O 3 ). Les alcools secondaires de type CH 3 -CHOH-CH 2 -R (R = radical alkyle ) conduisent à un mélange de 1-oléfines, de cis-2- et de trans-2-oléfines:
Déshydrohalogénation
De manière analogue, les haloalcanes peuvent être convertis en alcènes. Contrairement à la déshydratation des alcools, cette réaction, appelée déshydrohalogénation, a lieu dans des conditions basiques. Ici aussi, les halogénures d'hydrogène tertiaires peuvent être déshydrohalogénés plus facilement que les halogénures secondaires, et ceux-ci à leur tour plus facilement que les halogénures d'hydrogène primaires.
- Le chloréthane est déshydrohalogéné en éthène et en acide chlorhydrique.
Règle Saytzeff
La régiosélectivité peut être observée dans ces β-éliminations. Plusieurs produits peuvent être créés dans certaines circonstances. La règle Saytzeff s'applique :
En plus du groupe OH ou de l'atome d'halogène, l'hydrogène est éliminé de l'atome C voisin qui a le moins d'atomes d'hydrogène. En d'autres termes, l'alcène le plus fortement substitué est formé.

Déshalogénation
La troisième β-élimination possible est la déshalogénation des 1,2-dihaloalcanes. Dans les alcools, en présence de zinc, deux atomes d'halogène du même type sont éliminés des atomes de carbone voisins. Cela crée l'alcène et l'halogène sous forme moléculaire:
- Le 1,2-dibromoéthane est déshalogéné en éthène et en brome.
Déshydratation
Les alcènes peuvent être obtenus à partir d' alcanes par déshydrogénation partielle . A cet effet, l'hydrogène est éliminé de l'alcane correspondant. Le nombre d'atomes de carbone reste le même.
Pyrolyse des hydroxydes d'ammonium quaternaire
Des alcènes sont formés lors de la pyrolyse d'hydroxydes d'ammonium quaternaire si au moins un groupe alcane sur l'azote a 2 atomes de carbone ou plus. La mise en œuvre est la suivante:
Réactions typiques
Le mécanisme de réaction typique des alcènes est l'addition électrophile . La méthode de détection typique pour les alcènes, le test de l'eau de brome, est basée sur cette réaction : des alcènes ou d'autres hydrocarbures insaturés sont combinés avec de l'eau de brome de couleur brune, du brome étant ajouté à l'alcène et le mélange se décolorant rapidement.
Ajout d'halogénures d'hydrogène
L'addition d'halogénures d'hydrogène est similaire à l'addition d'halogènes tels que le brome. Bien que des produits de réaction théoriquement différents soient concevables dans l'addition d'alcènes asymétriques, en fonction de l'atome de carbone impliqué dans la double liaison auquel l'atome d'halogène est attaché, la réaction d'addition se déroule de préférence de manière régiosélective selon la règle de Markovnikov .
Une réaction régiosélective est un changement chimique qui se produit de préférence à l'un de plusieurs emplacements possibles. L' ion carbénium le plus stable est toujours formé comme produit intermédiaire par réaction avec le proton H + de l'acide halohydrique. Les effets de mésomérie sont toujours plus importants que les effets inductifs pour cette considération. L'halogénure s'ajoute alors au C + de l'ion carbénium. Si la stabilisation de la mésomérie de l'ion carbénium n'est pas possible, la règle de Markovnikov peut être appliquée: dans le cas d'alcènes asymétriques, l'addition électrophile d'halogénures d'hydrogène a lieu de telle manière que l'halogène se lie préférentiellement à l'atome de carbone qui a le moins d'atomes d'hydrogène; l'atome d'hydrogène d'autre part à l'atome de carbone le plus riche en hydrogène. La raison en est que les groupes alkyle agissent comme donneurs d'électrons ( effet + I et hyperconjugaison ) et favorisent ainsi la distribution (délocalisation) de la charge positive. La stabilité des ions carbénium positifs est plus grande, plus les groupes alkyles sont liés à l'atome de carbone chargé. Par conséquent, un ion carbénium tertiaire est plus stable qu'un ion secondaire et primaire. Il en va de même pour les radicaux (voir écart # 2), car ceux-ci souffrent également d'un manque d'électrons.
Des écarts par rapport à la règle de Markovnikov se produisent, entre autres, avec l'addition radicale et l' hydroboration . Ces réactions produisent le produit anti-Markovnikov:
- En hydroboration, l'atome de bore (électrophile) est ajouté à l'atome de carbone partiellement chargé négatif (substitué inférieur) de la double liaison, tandis que l'atome d'hydrogène (nucléophile) est ajouté à l'atome de carbone partiellement chargé positivement (substitué supérieur). Puisque l'atome d'hydrogène est principalement l'électrophile, ce renversement des rôles enfreint la règle.
- Dans l'addition radicale de z. B. Le bromure d'hydrogène n'attaque pas la double liaison de l'électrophile (hydrogène), mais un radical brome la double liaison. L'atome de brome se lie à l'atome de carbone le moins substitué de sorte que le radical se forme sur l'atome le plus fortement substitué. Le manque d'électrons sur le radical peut être stabilisé par hyperconjugaison avec les substituants et par l'effet + I. Ce n'est qu'alors que ce radical attaque une autre molécule H-Br et acquiert ainsi son atome d'hydrogène, qui se trouve alors sur l'atome de carbone le plus fortement substitué et enfreint ainsi la règle.
Réaction avec de l'acide sulfurique concentré
Le dépôt a lieu selon la règle de Markovnikov , à moins que les effets mésomères ne dominent. Techniquement, ce procédé est utilisé pour préparer des alcools à partir d'alcènes. L' acide alkyl sulfurique peut être facilement converti en alcools par hydrolyse .
Réaction avec l'acide hypochloreux
Cette réaction est régiosélective. L'atome de chlore se fixe à l'atome de carbone, qui a le plus d'atomes d'hydrogène si aucun effet mésomère ne se produit. La réaction avec le chlorure de nitrosyle et le bromure de nitrosyle en alcènes a également lieu avec l'addition.
Réaction avec un agent oxydant
L'oxydation a lieu soit avec du tétroxyde d'osmium, soit avec une solution alcaline de permanganate de potassium . Tout d'abord, un ester cyclique est formé avec une addition cis , l' hydrolyse conduit à un cis - 1,2-diol .
Ozonation des doubles liaisons C = C
Lorsque l' ozone passe en alcènes anhydres, des ozonides se forment , qui sont explosifs lorsqu'ils sont secs. L' ozonolyse clive complètement la double liaison et permet ainsi de déterminer la structure d'une chaîne carbonée une réaction importante car le clivage produit des informations sur l'emplacement de la double liaison. L'ozone peut être généré par le rejet de l'oxygène atmosphérique dans un ozoniseur.
Hydrogénation catalytique
L' hydrogénation est l'addition d' hydrogène à la double liaison, qui devient ainsi une simple liaison, à l'aide d'un catalyseur . La réaction a lieu à température ambiante en présence de platine ou de palladium saturé d'hydrogène.
Exemple:
Conversion d' alcènes cis en trans et vice versa
Les ( E ) -alcènes [exemple: ( E ) -stilbène , point de fusion 124 ° C ] peuvent être convertis photochimiquement en ( Z ) -alcènes [exemple: ( Z ) -stilbène, point de fusion 1 ° C ]. La réaction est réversible. - Dans de rares cas exceptionnels (exemple: ranitidine ), la barrière énergétique pour la conversion d'alcènes spécialement substitués est si basse à température ambiante que la forme ( E ) se transforme spontanément en forme ( Z ) et vice versa. En d'autres termes: l' isomère ( E ) et l'isomère ( Z ) peuvent être en équilibre l'un avec l'autre dans de rares cas exceptionnels.
preuve
Un alcène (par exemple l'éthène) est introduit dans l' eau de brome brun pour une détection non spécifique de la double liaison, en particulier pour la distinguer des alcanes . La réaction peut également être effectuée sans ajout d'énergie, par ex. B. lumière, expire. La molécule d'alcène ajoute un atome de brome à chaque atome de carbone de la double liaison C = C selon le mécanisme de réaction de l'addition électrophile ; l' haloalcane correspondant est formé comme produit de réaction . Par exemple:
- Le brome et l'éthène réagissent pour former du 1,2-dibromoéthane
L'eau de brome est décolorée à cause de cette réaction; un alcane introduit ne décolorerait pas l'eau de brome brune. Cependant, les phénols et de nombreux composés réducteurs décolorent également une solution de brome.
L' échantillon dit de Baeyer est utilisé pour la détection générale des doubles liaisons ou alcènes C = C. L'alcène est introduit dans une solution de permanganate de potassium en milieu faiblement alcalin ou acide, après quoi la solution vire au brun ou devient incolore. Il se forme de l'alcool et du dioxyde de manganèse ou des ions manganèse (II).
Littérature
- Allinger , Cava , de Jongh , Johnson , Lebel , Stevens : Organic Chemistry , 1ère édition, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X , pp. 222-240.
- Beyer / Walter : Textbook of Organic Chemistry , 19e édition, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2 , pp. 62-76.
- Morrison / Boyd : Textbook of Organic Chemistry , 3e édition, Verlag Chemie, Weinheim 1986, ISBN 3-527-26067-6 , pp. 305-370.
- Streitwieser / Heathcock : Organic Chemistry , 1ère édition, Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8 , pages 305-361.
- K. Peter C. Vollhardt , Neil E. Schore : Organic Chemistry , 4e édition, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8 , pp. 509-560.
liens web
- Entrée aux alcènes . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / goldbook.A00224 Version: 2.3.3.
Preuve individuelle
- ↑ Dirk Dautzenberg, Helmut Knözinger: Influence of Steric and Inductive Effects on Product Distribution in the Dehydrration of Secondary Alcohols on Alumina , Journal of Catalysis 33, 142-144 (1974) doi : 10.1016 / 0021-9517 (74) 90254-1 .
- ↑ Dirk Dautzenberg, Helmut Knözinger: Effets inductifs et distributions de produits dans la déshydratation des alcools secondaires sur l'alumine. Réponse aux commentaires de BH Davis, Journal of Catalysis 58, 496-497 (1979) doi : 10.1016 / 0021-9517 (79) 90288-4 .
- ^ LF Fieser et M. Fieser: Manuel de chimie organique , 3e édition, Verlag Chemie, Weinheim / Bergstr. 1957, p. 260.
- ^ Siegfried Hauptmann : Chimie organique , 2e édition, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8 , p. 283.