Monoxyde de carbone
| Formule structurelle | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
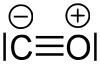
| ||||||||||||||||||||||
| Général | ||||||||||||||||||||||
| Nom de famille | Monoxyde de carbone | |||||||||||||||||||||
| Autres noms |
|
|||||||||||||||||||||
| Formule moléculaire | CO | |||||||||||||||||||||
| Brève description |
gaz incolore et inodore |
|||||||||||||||||||||
| Identifiants externes / bases de données | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propriétés | ||||||||||||||||||||||
| Masse molaire | 28,01 g mol -1 | |||||||||||||||||||||
| État physique |
gazeux |
|||||||||||||||||||||
| densité |
1,25 kg m -3 (0°C, 1013 mbar) |
|||||||||||||||||||||
| Point de fusion |
−205.07 °C |
|||||||||||||||||||||
| point d'ébullition |
−191,5°C |
|||||||||||||||||||||
| solubilité |
30 mg l -1 dans l'eau (20°C) |
|||||||||||||||||||||
| Moment dipolaire | ||||||||||||||||||||||
| consignes de sécurité | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
DFG / Suisse : 30 ml m -3 ou 35 mg m -3 |
|||||||||||||||||||||
| Données toxicologiques | ||||||||||||||||||||||
| Propriétés thermodynamiques | ||||||||||||||||||||||
| H f 0 | ||||||||||||||||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | ||||||||||||||||||||||
Le monoxyde de carbone (langue technique monoxyde de carbone , communément monoxyde de carbone ) est un composé chimique de carbone et d' oxygène de formule empirique CO. Le monoxyde de carbone est un gaz incolore, inodore, insipide et toxique . Elle résulte, entre autres, de la combustion incomplète de substances carbonées avec un apport insuffisant d'oxygène. Formellement, le gaz est l' anhydride de l'acide formique , mais il se dissout à peine dans l'eau.
Le monoxyde de carbone est inflammable et brûle avec l'oxygène dans une flamme bleue transparente pour former du dioxyde de carbone . Il est très réactif à des températures élevées et réagit avec divers métaux de transition pour former des carbonyles métalliques . Le monoxyde de carbone réagit avec le soufre pour former du sulfure de carbonyle , avec des hydroxydes alcalins en formiates , et avec des halogènes tels que le fluor ou le chlore, il réagit pour former des halogénures de carbonyle tels que le fluorure de carbonyle ou le phosgène . Le monoxyde de carbone réagit avec les composés azoïques pour former des isocyanates et avec l'ammoniac pour former du formamide toxique . En tant que composant du gaz de synthèse , il réagit dans la synthèse Fischer-Tropsch pour former divers hydrocarbures et leurs produits d'oxydation . Il est également utilisé pour la synthèse du méthanol et de l' isobutanol . Composant du gaz de ville , il a été utilisé en Allemagne comme combustible et gaz d'éclairage jusqu'à la seconde moitié du 20e siècle .
Le gaz est toxique car il se lie plus fortement à l' hémoglobine que l'oxygène et empêche ainsi l'oxygène d'être transporté dans le sang. L' intoxication au monoxyde de carbone fait souvent partie du processus d' inhalation de fumée et de la maladie des mines après inhalation de gaz toxiques dans l' exploitation minière ; il peut être fatal dans un court laps de temps.
nomenclature
Dans la norme allemande retirée DIN 32640 « Éléments chimiques et composés inorganiques simples - noms et symboles » de décembre 1986, l'orthographe « monoxyde de carbone » avec « oo » est recommandée car, selon les règles IUPAC pour la nomenclature de la chimie inorganique, fin les voyelles des chiffres grecs préfixés ne peuvent pas être omises.
En revanche, dans l'édition 1990 de la nomenclature IUPAC, l'orthographe « monoxyde de carbone » est utilisée. Concernant l'utilisation des préfixes multiplicatifs, il est dit : « Les voyelles finales des préfixes multiplicatifs ne sont pas laissées de côté, à moins qu'il n'y ait des raisons linguistiques impérieuses. Le monoxyde est l'une de ces exceptions.
histoire
Dès 1000 avant JC Chr. A été utilisé dans la fusion des minerais métalliques , l' effet réducteur du monoxyde de carbone dans le soi-disant Rennöfen utilisé, mais sans connaître la nature du gaz. Les Grecs et les Romains l'utilisaient pour les exécutions . À la fin du XIIIe siècle, Arnaldus de Villanova décrit la toxicité d'un gaz produit par la combustion du bois ; il s'agissait de monoxyde de carbone. Au début du XVIIe siècle, Johan Baptista van Helmont a expérimenté un gaz appelé gaz carbonum , un mélange de dioxyde de carbone et de monoxyde de carbone.
En 1776, le chimiste français Joseph de Lassone produit du monoxyde de carbone en chauffant de l'oxyde de zinc avec du coke . Il a supposé à tort qu'il s'agissait d'hydrogène. Joseph Priestley a fabriqué du monoxyde de carbone en 1799 en faisant passer du dioxyde de carbone sur du fer chaud. William Cruickshank a utilisé la même procédure en 1800. Il a suggéré la composition correcte du CO. Les propriétés toxiques sur les chiens ont été étudiées par Claude Bernard vers 1846.
Au début du XIXe siècle, la demande de gaz lumineux augmente . L'industrie anglaise du gaz de charbon a commencé à développer des procédés de gazéification du charbon à cette époque . Avec le développement des procédés haute pression dans l' industrie chimique au début du 20e siècle, la demande de gaz de synthèse contenant du monoxyde de carbone a fortement augmenté . La gazéification du charbon à grande échelle a été réalisée avec le développement du générateur Winkler , du gazéifieur sous pression Lurgi et plus tard du réacteur Koppers-Totzek .
À l'époque nazie, le monoxyde de carbone était utilisé pour les exécutions. Dans Action T4 , plus de 70 000 personnes handicapées mentales et physiques ont été systématiquement assassinées au monoxyde de carbone de 1940 à 1945 en Allemagne.
Occurrence
Événements atmosphériques
La concentration moyenne de monoxyde de carbone dans l' atmosphère terrestre est d'environ 90 milliardièmes de fraction de volume (le terme anglais pour un milliardième est parties par milliard ; avec l'ajout de "v" pour la fraction de volume, cette unité auxiliaire est généralement abrégée en "ppbv "). L'atmosphère contient environ 400 méga- tonnes (Mt) en totale . Dans l' hémisphère nord , la concentration moyenne est aujourd'hui de 140 ppbv, avant l'industrialisation elle était d'environ 90 ppbv. Dans l' hémisphère sud , la concentration moyenne est restée à son niveau naturel de 50 ppbv.
L'instrument satellite Terra's Measurements Of Pollution In The Troposphere (MOPITT) a créé la première carte mondiale de la concentration de CO dans la basse atmosphère terrestre. La figure MOPITT ci-jointe montre la concentration moyenne de CO d'avril, mai et juin pour les années 2000 à 2004.
Le monoxyde de carbone a une durée de vie atmosphérique moyenne d'environ deux mois. La réaction la plus importante est celle avec les radicaux hydroxyles dans l'atmosphère, qui oxyde 2300 Mt (2000-2800 Mt) de monoxyde de carbone en dioxyde de carbone chaque année. Les sols contribuent environ 300 Mt (200-600 Mt) à l' oxydation du CO chaque année. Le taux d'oxydation dépend de la concentration de radicaux hydroxyles, qui augmente avec un rayonnement solaire plus fort et une teneur en vapeur d'eau plus élevée. Sous les tropiques, la durée de vie est d'environ un mois, dans les latitudes tempérées et nordiques, elle va de deux mois en été à plus d'un an en hiver. Une durée de vie atmosphérique moyenne d'environ un an serait nécessaire pour équilibrer les concentrations de monoxyde de carbone entre les hémisphères nord et sud. Les émissions anthropiques plus élevées dans l'hémisphère nord conduisent donc à une différence significative de concentration entre les hémisphères. En raison des influences météorologiques telles que la mousson indienne et les émissions des zones métropolitaines, il existe des différences considérables de concentration au niveau régional, par exemple en Asie de l'Est .
Dans le monde, environ 2 500 mégatonnes (2 000 à 2 900 Mt) de monoxyde de carbone sont rejetées dans l'atmosphère ou s'y forment chaque année. Environ la moitié de cela est causé par la combustion incomplète de combustibles fossiles ou de biomasse , y compris les feux de forêt et de brousse. Une autre proportion importante n'est formée dans l'atmosphère que par l'oxydation d' hydrocarbures tels que le méthane ou d'autres composés organiques volatils . Au total, environ 60% du monoxyde de carbone est causé par l'homme, le reste est d'origine naturelle.
Les informations sur les taux d'émission mondiaux sont basées sur des estimations et sont sujettes à des facteurs d'incertitude. Les émissions de monoxyde de carbone dues au trafic sont exprimées en 500 Mt (300-600 Mt), les systèmes fixes de production d'énergie à partir de combustibles fossiles émettent 100 Mt (80-200 Mt), la combustion de biomasse 600 Mt (300-800 Mt). L'oxydation du méthane produit 600 Mt (400-800 Mt), la décomposition d'autres composés organiques volatils 500 Mt (300-700 Mt). D'autres sources biogéniques libèrent environ 200 Mt (100-400 Mt), les sols environ 30 Mt et les océans environ 10 Mt par an.
Les sols peuvent être à la fois des sources et des puits de monoxyde de carbone. Dans les régions arides , les sols dégagent du monoxyde de carbone, vraisemblablement par la décomposition abiotique de la matière organique sous l'influence de la lumière et des températures élevées. En dehors des régions arides, la dégradation prédominante est par les procaryotes , en fonction de la teneur en oxygène et en eau du sol, soit par réduction en méthane (agent formant du méthane ) soit par oxydation en dioxyde de carbone.
Les océans sont sursaturés en monoxyde de carbone . Dans l' océan Atlantique , la concentration est d'environ dix à quarante fois la concentration d'équilibre atmosphérique, les sources biologiques étant supposées être responsables. Les océans sont donc une source de monoxyde de carbone atmosphérique, dont la proportion est estimée à 5 à 29 % de la quantité libérée par la combustion.
Une concentration de 3700 ppm ( parties par million ) de monoxyde de carbone a été mesurée dans les gaz des volcans hawaïens . Les volcans ne jouent aucun rôle dans l'équilibre mondial.
La principale bande d' absorption infrarouge du monoxyde de carbone est à un nombre d'onde de 2143 cm -1 ( longueur d'onde d' environ 4,67 µm ) et donc loin du maximum spectral du rayonnement infrarouge terrestre , qui est à un nombre d'onde d'environ 1000 cm -1 (10 µm). Le monoxyde de carbone contribue donc peu à l' effet de serre par absorption directe . Dans la troposphère , l'oxydation des hydrocarbures tels que le méthane en dioxyde de carbone s'effectue également via des radicaux hydroxyles. L'oxydation du méthane produit également du monoxyde de carbone comme produit intermédiaire. L'effet du monoxyde de carbone sur l'effet de serre réside dans son importance en tant que puits pour ces radicaux hydroxyles, qui ne sont donc plus disponibles pour la conversion de gaz à effet de serre directs comme le méthane. De plus, le méthanol , le méthane selon le deuxième gaz organique le plus abondant dans l'atmosphère, qui se produit à des concentrations de 0,1 à 10 ppbv , est une source importante de monoxyde de carbone atmosphérique, dans lequel une majeure partie du méthanol est émise par les plantes.
En milieu urbain , les gaz d'échappement des voitures non traités peuvent donner des valeurs comprises entre 100 et 200 ppm. La concentration de monoxyde de carbone dans les gaz d'échappement non dilués d' une automobile sans convertisseur catalytique est d'environ 7000 ppm. Dans les véhicules équipés d'un pot catalytique à trois voies et d'une sonde lambda correctement réglée , le monoxyde de carbone est idéalement utilisé pour réduire les oxydes d'azote , de sorte qu'il est lui-même oxydé en dioxyde de carbone. En raison des températures élevées des gaz d'échappement et de l'ajustement associé de l' équilibre de Boudouard , les gaz d'échappement des voitures particulières équipées de moteurs à essence contiennent toujours une certaine quantité de monoxyde de carbone. Une valeur limite de 1000 ppm est spécifiée dans les normes d'émission Euro 5 et 6 , pour les véhicules à moteur diesel la valeur limite est de 500 ppm. Aux États-Unis, plus de la moitié des émissions de monoxyde de carbone troposphérique en 2002 provenaient du fonctionnement des véhicules, soit environ 61 sur 117 millions de tonnes. Dans les zones métropolitaines, les gaz d'échappement des véhicules étaient responsables d'environ 75 % de toutes les émissions de monoxyde de carbone. Les émissions de monoxyde de carbone de ces sources mobiles ont diminué d'environ 5 % par an depuis le début des années 90.
Le monoxyde de carbone, les oxydes d'azote et les composés hydrocarbonés volatils sont les molécules précurseurs de la formation d' ozone (O 3 ) dans la troposphère. La formation d'ozone s'effectue via l'oxydation du monoxyde d'azote (NO) en dioxyde d'azote (NO 2 ) par des radicaux peroxy , qui se forment par exemple lors de l'oxydation du monoxyde de carbone. Ceux-ci réagissent très rapidement avec le monoxyde d'azote existant pour former du dioxyde d'azote. L'ozone est créé par photolyse du dioxyde d'azote.
La distribution, les sources et les puits de monoxyde de carbone diffèrent entre la troposphère et la stratosphère . Dans la stratosphère, les réactions nucléaires créent en permanence l' isotope du carbone 14 C , par exemple lorsque l' isotope de l' azote 14 N, qui est de loin l' isotope de l' azote le plus courant , est touché par un neutron. Si un neutron est capturé et qu'un proton est séparé, le noyau 14 N devient un noyau 14 C. Le carbone résultant est d'abord oxydé en monoxyde de carbone. Le temps de séjour du monoxyde de carbone dans la stratosphère dépend, entre autres, de la concentration en radicaux hydroxyles par lesquels il est oxydé en dioxyde de carbone.
Présence dans les bâtiments
Dans les bâtiments résidentiels , la concentration normale est de 0,5 à 5 ppm, avec des concentrations allant jusqu'à 15 ppm à proximité des brûleurs à gaz . Le monoxyde de carbone a une densité de 96,5% de la densité de l'air , il est donc légèrement plus léger. S'il y a suffisamment de tirage dans la cheminée , le monoxyde de carbone qui se forme monte rapidement avec les gaz d'échappement chauds à travers la cheminée si le carbone est incomplètement brûlé. S'il y a un mauvais tirage de la cheminée d'un poêle à bois , le monoxyde de carbone peut pénétrer dans l'air ambiant et provoquer un empoisonnement. Les raisons du refoulement des gaz d'échappement ou de leur élimination inadéquate sont nombreuses. Par exemple, le vent, des chaudières vétustes ou mal réglées et mal entretenues, une sorbonne allumée ou un système d'aspirateur central allumé peuvent provoquer une contre-pression, ce qui peut entraîner un refoulement des fumées. Des cheminées et poêles qui fuient, des cheminées mal dimensionnées ou des cheminées bouchées par des nids de guêpes ou d' oiseaux , par exemple , peuvent empêcher l'extraction d'une quantité suffisante de gaz d'échappement. D'autres sources de monoxyde de carbone dans les pièces à vivre sont les barbecues au charbon de bois, les feux de bois ou le fonctionnement de radiateurs radiants alimentés au gaz propane . En outre, les poêles à gaz , les émissions de granulés de bois dans les bunkers à granulés, les gaz d'échappement des voitures des garages attenants et l'utilisation d' équipements d'aération et de générateurs à moteur à combustion interne peuvent être Kohlenstoffmonoxidquellen.
La fumée de tabac contient des niveaux importants de monoxyde de carbone. Dix cigarettes fumées augmentent la concentration d'environ 22 ppm de monoxyde de carbone dans une pièce non ventilée de 30 m³.
Événements extraterrestres
Le monoxyde de carbone est également répandu dans l' espace extraterrestre , en dehors de la terre et de son atmosphère. Il y est créé lorsque le dioxyde de carbone beaucoup plus rare réagit avec l' hydrogène atomique et moléculaire pour former de l' eau et du monoxyde de carbone. Il existe également un certain nombre d'autres réactions de formation, telles que la réaction de cations carbone avec des radicaux hydroxyle pour former du monoxyde de carbone et un proton .
Le monoxyde de carbone a été détectée dans la photosphère du du Soleil et les atmosphères de Vénus , Mars , Jupiter , Saturne , Titan , Uranus, et Neptune . La concentration en monoxyde de carbone dans l'atmosphère vénusienne est d'environ 50 ppm, dans l'atmosphère martienne 700 ppm ont été mesurés. Dans le système solaire externe , le monoxyde de carbone est le deuxième composant le plus abondant dans l'atmosphère extrêmement mince de la planète naine Pluton . Du monoxyde de carbone a également été détecté dans l'atmosphère des exoplanètes .
Le vaisseau spatial Giotto a mesuré 10 % de monoxyde de carbone dans les émissions de gaz de la comète Halley . Du monoxyde de carbone a également été détecté dans les émissions d'autres comètes telles que Hyakutake , Hale-Bopp et Schwassmann-Wachmann 1 . Ces observations ont conduit à la conclusion que le monoxyde de carbone était une source majeure de carbone lors de la formation du système solaire. À l'époque préhistorique du système solaire, des molécules organiques plus complexes telles que les hydrocarbures et les acides gras se sont formées à partir de monoxyde de carbone et d'hydrogène via des réactions de type Fischer-Tropsch , qui peuvent être liées à l'origine de la vie.
Une raie d'émission importante du monoxyde de carbone interstellaire se produisant dans les nuages moléculaires se situe à une longueur d' onde de 2,6 mm et est principalement excitée par des collisions avec des molécules d'hydrogène. L'observation infrarouge et radio du monoxyde de carbone dans les nuages moléculaires est donc utilisée pour la détermination indirecte de la concentration d'hydrogène interstellaire. On suppose que le rapport entre le monoxyde de carbone et l'hydrogène est constant. Les transitions rotationnelles du monoxyde de carbone sont un mécanisme efficace pour convertir l'énergie thermique en rayonnement micro - ondes et infrarouge et sont l'un des mécanismes de refroidissement importants des nuages moléculaires. Ces pertes d'énergie facilitent les conditions d'occurrence d'un effondrement gravitationnel d' un nuage moléculaire dans les zones suffisamment denses d'un nuage moléculaire , ce qui peut conduire à la formation d'étoiles . Indicateur de la présence d'hydrogène, le monoxyde de carbone est l'une des molécules interstellaires les plus étudiées. En mesurant le décalage vers le rouge des transitions rotationnelles du monoxyde de carbone, sa distribution et sa cinématique dans le plan équatorial galactique ont pu être déterminées.
Extraction et présentation
Le monoxyde de carbone peut être obtenu à partir de nombreuses matières premières carbonées telles que B. Le gaz naturel , le biogaz , le pétrole léger , les huiles lourdes , le charbon ou la biomasse peuvent être produits. Si la matière première est du charbon ou du coke, premier gaz générateur (contient environ 25 % de CO en plus de N 2 ), gaz d'eau (CO : H 2 environ 1 : 1) ou gaz de synthèse (CO : H 2 environ 1 : 2) est généré, qui est nettoyé et traité à volonté. Le méthane en tant que matière première conduit au gaz de craquage (CO: H 2 env. 1: 3). Les procédés industriels les plus importants sont la gazéification du charbon , le reformage à la vapeur et l' oxydation partielle des hydrocarbures.
Gazéification du charbon
La gazéification du charbon a lieu dans ce que l'on appelle des générateurs, qui peuvent produire du gaz de générateur, du gaz d'eau ou du gaz de synthèse en fonction du contrôle du processus. Les types de générateurs utilisés sont divers et diffèrent, entre autres, par le type d'alimentation en charbon, l'élimination des scories et les charbons utilisés et leurs granulométries . Outre le générateur de soutirage , le générateur à grille fixe et le générateur à grille rotative , le générateur Winkler , le gazéifieur sous pression Lurgi et le réacteur Koppers-Totzek sont utilisés , ces trois derniers étant principalement utilisés pour la production de gaz de synthèse . En plus des gaz, des goudrons et des gaz enrichis en hydrocarbures sont également obtenus dans des générateurs couvants .
Production d'eau et de gaz de synthèse
Le coke est gazéifié à une température élevée en le faisant réagir avec de la vapeur d'eau et de l'air ou, de préférence, de l'oxygène. La composition du gaz peut être déterminée par la gestion du processus. En alternance entre l'air (période de bulle ou simplement "bulles") et la vapeur d'eau (période de gaz ou "gaz"), du gaz d'eau est généré, seul le gaz généré lors de la réaction avec la vapeur d'eau étant utilisé. Le fonctionnement à l'air sert au soufflage à chaud du coke jusqu'à l' incandescence , fournissant ainsi l'énergie nécessaire à la réaction endothermique eau-gaz. Si les générateurs fonctionnent en continu avec de l'air ou de l'oxygène et de l'eau, le gaz de synthèse est le produit principal.
La variation du contenu énergétique du système, l' enthalpie , est exprimée par le symbole , les réactions endothermiques ayant un signe positif selon la convention. L'exposant zéro représente les conditions standard (100 kPa et 25 ° C). Alors que l'enthalpie indique si un processus est exothermique ou endothermique, la variation de l' énergie de Gibbs au cours d'une réaction chimique est le critère décisif pour savoir si une conversion des substances impliquées a réellement lieu volontairement.
La réaction principale est la réaction hétérogène endothermique eau-gaz :
Ceci est couplé à la combustion exothermique du carbone :
Il y a aussi d'autres réactions impliquées. Les plus importants sont l' équilibre de Boudouard
et la réaction homogène du gaz à l'eau ( réaction de déplacement du gaz à l'eau )
Production de gaz de générateur
Le gaz de générateur est produit par la combustion incomplète du coke. Pour ce faire, l'air traverse une couche de carbone et est initialement brûlé en dioxyde de carbone dans l'air en excès. Le dioxyde de carbone réagit ensuite avec le carbone pour former du monoxyde de carbone à haute température. Le gaz générateur a une composition d'environ 70 % d'azote, 25 % de monoxyde de carbone et 4 % de dioxyde de carbone. Le gaz contient également de l'hydrogène, du méthane et de l'oxygène.
Reformage à la vapeur
Le monoxyde de carbone peut être préparé par traitement du gaz naturel ou du pétrole léger sont produits avec des fractions de vapeur d'eau, par exemple à partir de méthane par
ou généralement après
Le principal produit du reformage à la vapeur est l'hydrogène. La réaction endothermique a lieu en présence de catalyseurs au nickel à des températures de 700 à 1100°C. La réaction est réversible .
Oxydation partielle des hydrocarbures
Avec l'oxydation partielle , le matériau de départ, par exemple le fioul lourd, est oxydé avec une quantité limitée d'oxygène pour former de l'hydrogène et du monoxyde de carbone. Une distinction est faite entre l'oxydation partielle thermique et catalytique. Dans le cas d'une oxydation thermique partielle, la température de réaction est d'environ 1200°C, dans les procédés catalytiques, selon le catalyseur, d' environ 800 à 900°C :
Balance de laboratoire

En laboratoire, un flux constant de monoxyde de carbone peut être produit en faisant couler de l'acide formique dans de l'acide sulfurique ou phosphorique chaud et concentré :
Le monoxyde de carbone étant très toxique, les quantités excédentaires doivent être collectées avec des absorbeurs spéciaux ou flambées avec un dispositif à flamme . Une prudence particulière est requise avec les mélanges de monoxyde de carbone et d'air, car ceux - ci peuvent réagir de manière explosive . Il est également possible de convertir catalytiquement le monoxyde de carbone avec de l'oxyde de cuivre (II) ou de l' hopcalite en dioxyde de carbone.
Séparation du monoxyde de carbone
Si des gaz purs sont souhaités comme produit, le mélange gazeux tel que décrit ci-dessus doit être séparé. Pour de nombreuses applications, d'autre part, le gaz de synthèse est requis directement; ici, seul le rapport entre le monoxyde de carbone et l'hydrogène doit être ajusté en fonction des besoins. Le monoxyde de carbone peut être séparé des manières suivantes :
- Complexation réversible aux sels de cuivre-aluminium à pression augmentée ; à pression réduite, le monoxyde de carbone est à nouveau libéré.
- Condensation à basse température
- Adsorption modulée en pression
- Membranes semi-perméables
Propriétés
Propriétés physiques
Le monoxyde de carbone est un gaz incolore et inodore avec une masse molaire de 28,01 g/mol. À 1,25 kg/m³, il a presque la même densité que l'air. Le point d'ébullition de -191 °C et le point de fusion de -205 °C sont proches des valeurs de l'azote isoélectronique (voir ci-dessous), qui a un point d'ébullition de -196 °C et un point de fusion de -210 °C C.
Le point triple auquel les trois phases solide, liquide et gazeuse sont en équilibre est à une température de -205,0 °C et une pression de 0,154 bar . La température critique est de -140,2°C, la pression critique est de 35,0 bars, la densité critique est de 0,301 g/cm³.
Lors du refroidissement, le monoxyde de carbone forme initialement une phase hexagonale solide, désordonnée, qui, lorsqu'elle est refroidie davantage en dessous de 61,6 K, se transforme en une phase ordonnée, qui dans le système cristallin cubique a le groupe d'espace P 2 1 3 (espace groupe n°198) cristallisé. A des pressions élevées supérieures à 52 000 bars, il se forme des phases polycarbonyliques solides, blanchâtres, jaunâtres ou rouges, métastables, dont la structure exacte est encore inconnue.
Le carbone et l'oxygène sont très étroitement liés l'un à l'autre dans la molécule de monoxyde de carbone. L' énergie de dissociation est légèrement supérieure à celle de la molécule de diazote très inerte , qui est isoélectronique au monoxyde de carbone , et est de 1070,3 kJ / mol . Seuls 946 kJ / mol sont nécessaires pour séparer la molécule d'azote N 2 .
Le pouvoir calorifique massique est de 10,1 MJ/kg, soit environ 5 fois moins que celui du méthane. Le pouvoir calorifique et le pouvoir calorifique brut lié au volume est de 12 636 kJ / m³ et se situe donc dans la gamme de l'hydrogène. La température d'inflammation est de 605°C. La plage d' inflammation est de 12,5 à 75 % en volume de monoxyde de carbone dans l'air.
Propriétés moléculaires
La longueur de liaison entre les atomes de carbone et d'oxygène est de 106 pm dans la phase solide et de 112,8 pm dans la phase gazeuse. La distance entre deux atomes donnés est d'environ 20 pm plus petite s'ils sont connectés par une double liaison au lieu d'une simple liaison .
Pour une triple liaison , la distance est encore 10 pm plus petite que celle d'une double liaison. La liaison carbone-oxygène , qui est environ 10 µm plus courte qu'une double liaison carbone-oxygène d'un composé organique carbonylé , par exemple dans le cas du formaldéhyde , indique donc une triple liaison.
La structure moléculaire est mieux décrite en utilisant la théorie des orbitales moléculaires . Selon leurs règles, le nombre d'orbitales moléculaires résultantes est égal au nombre d' orbitales atomiques impliquées . Les huit orbitales moléculaires du monoxyde de carbone sont formées à partir des quatre orbitales atomiques du carbone et de l'oxygène. L' orbitale moléculaire occupée de la plus haute énergie (HOMO) forme l'orbitale antiliante s * . Dans les orbitales antiliantes, la probabilité la plus élevée que les électrons soient localisés n'est pas entre les noyaux atomiques impliqués. En conséquence, la répulsion des noyaux atomiques chargés positivement n'est pas protégée. Les orbitales moléculaires sont donc appelées antiliaison. Les orbitales moléculaires de plus basse énergie inoccupées (LUMO) sont les orbitales antiliantes x, y * .
Dans l'état fondamental, la molécule est dans un état singulet , ce qui signifie qu'il n'y a pas d'électrons non appariés dans la molécule. Dans la formule structurelle de Lewis, une charge formelle positive se produit sur l'atome d'oxygène et une charge formelle négative sur l'atome de carbone :
En raison de la différence d' électronégativité élevée de 1 entre les partenaires de liaison, cette charge formelle est à nouveau équilibrée et le monoxyde de carbone est donc presque non polaire. Son moment dipolaire n'est que de μ = 0,10980 D , le moment dipolaire étant dirigé de telle manière que l'atome d'oxygène porte la charge positive.
Propriétés chimiques
La formation de monoxyde de carbone à partir des éléments est exothermique et est en équilibre de dismutation avec le carbone et le dioxyde de carbone. Parce que cet équilibre est presque infiniment lent à température ambiante , le monoxyde de carbone peut être isolé malgré la position d'équilibre défavorable - le monoxyde de carbone est métastable . A des températures plus élevées, l'équilibre se déplace en faveur du monoxyde de carbone ( principe de LeChatelier ). Ceci est utilisé, par exemple, dans la production de fer dans le processus de haut fourneau , où le monoxyde de carbone gazeux est un agent réducteur beaucoup plus efficace que le coke solide . Dans les procédés industriels, le monoxyde de carbone peut empoisonner les catalyseurs car il se lie fortement aux centres métalliques actifs tels que les atomes de nickel ou de fer et les bloque pour d'autres réactifs.
Le monoxyde de carbone est un bon agent réducteur peu coûteux et est utilisé dans cette fonction de diverses manières. Le pouvoir oxydant n'est cependant que faible. En chimie organométallique , le monoxyde de carbone est un ligand monodenté fréquemment utilisé , et la chimie des carbonyles métalliques a fait l'objet de nombreuses recherches. C'est l'un des ligands de champ fort et il est isoélectronique à l'azote (N 2 ) ainsi qu'aux ions cyanure (CN - ) et nitrosyle (NO + ). Une forte liaison métal-ligand est créée par le développement de liaisons aller- retour qui renforcent de manière synergique . Le monoxyde de carbone est un puissant donneur et accepteur . Il migre dans les liaisons alkyl-métal des complexes pour former des groupes acyle .
Avec des aromatiques tels que le benzène , le monoxyde de carbone réagit avec le chlore avec une catalyse de chlorure d' aluminium ou de chlorure de cuivre (I) dans la réaction de Gattermann-Koch pour former du benzaldéhyde . Le monoxyde de carbone réagit avec des agents réducteurs puissants tels que le potassium métallique pour former le sel de potassium de l' hexahydroxybenzène ou le sel de potassium du dihydroxyacétylène .
utilisation
Le monoxyde de carbone est souvent utilisé dans l'industrie chimique avec l' hydrogène comme gaz de synthèse . Pour certaines applications, cependant, du monoxyde de carbone pur est également requis, par exemple pour la production de carbonyles métalliques tels que le nickel tétracarbonyle ou le fer pentacarbonyle , pour les carbonylations ou la production d' acides de cuisson . La production de phosgène , d'acide acétique et d'anhydride acétique et la production de formiate de méthyle et d'acide formique nécessitent également du monoxyde de carbone pur.
Le monoxyde de carbone pur est principalement obtenu à partir de gaz de synthèse par des procédés de séparation physique ou chimique. La séparation physique a lieu par condensation partielle et distillation ultérieure selon le procédé Linde ou par perméation membranaire . Par adsorption avec formation de complexes , le monoxyde de carbone peut être séparé des autres composants du gaz de synthèse au moyen de solutions de sel de cuivre (I).
Le monoxyde de carbone utilisé dans l'industrie chimique est principalement produit sur place et transformé en interne. Il existe également l'option de livraison par camion - citerne ou en bouteilles de gaz . Pour la mise en réseau des sites chimiques, la distribution par canalisations est possible. Les projets de construction de tels pipelines, tels que le pipeline de CO de Bayer AG , sont souvent critiqués et peuvent entraîner de longs litiges administratifs .
Réactions de gaz de synthèse
Production de méthanol
Le méthanol est un produit chimique organique de base et un alcool à grande échelle et à grande échelle . La production à partir de monoxyde de carbone et d'hydrogène se déroule selon l'équation brute suivante :
En 2008, la consommation mondiale de méthanol était de 45 millions de tonnes. Aujourd'hui, le méthanol est produit à l'échelle industrielle à partir de gaz de synthèse dans le procédé basse ou moyenne pression. Le méthanol brut résultant est partiellement contaminé par des sous-produits. Si le méthanol brut est utilisé pour la combustion dans le secteur de l'énergie, la pureté du méthanol brut est suffisante. Pour un traitement ultérieur dans l'industrie chimique, le méthanol doit être traité par distillation. Les composants à bas point d'ébullition tels que l'éther diméthylique sont séparés dans une colonne à bas point d'ébullition. Les fractions à haut point d'ébullition sont séparées en queue dans une autre étape de distillation dans une colonne à haut point d'ébullition, le méthanol étant soutiré en tête.
Synthèse Fischer-Tropsch
Dans la synthèse Fischer-Tropsch, un mélange monoxyde de carbone-hydrogène est converti au moyen d' une catalyse hétérogène . Les catalyseurs sont basés sur les métaux de transition cobalt , fer , nickel et ruthénium , des oxydes métalliques poreux avec de grandes surfaces spécifiques tels que la terre de diatomées , l' oxyde d' aluminium , les zéolites et le dioxyde de titane sont utilisés comme supports .
Le mélange gazeux est converti en hydrocarbures tels que les paraffines , les oléfines et les alcools dans une réaction d'accumulation . Les produits finaux sont l' essence ( essence synthétique ), le diesel , le mazout et les matières premières pour l'industrie chimique. La réaction a lieu même à pression atmosphérique et à une température de 160 à 200°C ; des pressions et des températures techniquement plus élevées sont utilisées en fonction du processus. La synthèse se déroule selon le schéma réactionnel suivant :
- ( Alcanes )
- (n 2, alcènes )
- ( Alcools )
Chaque kilogramme de carburant produit environ 1,25 kilogramme d'eau, pour la production de laquelle environ la moitié de l'hydrogène est utilisé. Le produit typique de Fischer-Tropsch contient environ 10 à 15 % de gaz liquides ( propane et butane ), 50 % d'essence, 28 % de kérosène (diesel), 6 % de paraffine molle (slack paraffine) et 2 % de paraffines dures. Le procédé est important pour la production à grande échelle d' essence et de pétrole à partir du charbon , du gaz naturel ou de la biomasse .
Hydroformylation
Avec l'hydrogène, le monoxyde de carbone est utilisé pour l' hydroformylation des oléfines. Les produits résultants sont principalement des aldéhydes , principalement des hydrures de métal carbonyle utilisés comme catalyseurs dans des réactions homogènes ou hétérogènes.
Un produit techniquement important de l'hydroformylation avec hydrogénation ultérieure est le 2-éthylhexanol . Le plastifiant phtalate de di- n- octyle peut être produit à partir de 2-éthylhexanol et d'anhydride phtalique .
Réagit avec les molécules organiques et l'eau
Acide formique et dérivés
Le monoxyde de carbone pur est utilisé pour la production d'acide formique à partir d'eau et de méthanol via une étape de formiate de méthyle . Le méthoxyde de sodium est utilisé comme catalyseur . Le méthanol consommé dans la première étape est à nouveau libéré par hydrolyse dans la deuxième étape . La première usine de ce type a été mise en service en 1981 et produisait 100 000 tonnes par an. En 2012, la capacité de production mondiale de BASF utilisant ce procédé était de 255 000 tonnes par an.
Avec l'hydroxyde de sodium , on obtient du formiate de sodium , qui est utilisé comme matière première pour la production d' acide oxalique .
Procès Monsanto et Tennessee Eastman
En faisant réagir du monoxyde de carbone avec du méthanol à l' aide de rhodium carbonyles mixtes , l'acide acétique est obtenu dans le procédé Monsanto . Celui-ci est ensuite transformé en acétate de vinyle et de cellulose ainsi qu'en produits intermédiaires pour l'industrie chimique.
L'anhydride acétique est formé par carbonylation de l'acétate de méthyle dans le procédé Tennessee-Eastman .
Chimie de Reppe
Le monoxyde de carbone est utilisé pour les réactions de carbonylation en synthèse organique. On entend par chimie de Reppe travailler l' acétylène sous pression augmentée, les métal carbonyles et les hydrogénocarbonyles étant utilisés comme catalyseurs. Une réaction importante est l' hydrocarboxylation , dans laquelle l'acétylène est utilisé avec du monoxyde de carbone et de l'eau ou un alcool pour produire de l'acide acrylique et des esters d'acide acrylique :
Acides de cuisson
Les acides carboxyliques tertiaires , appelés acides de Koch, sont formés par la réaction de Koch du monoxyde de carbone avec des alcools ou des alcènes et de l'eau sous catalyse acide à des pressions élevées et des températures élevées.
L'industrie chimique produit environ 150 000 tonnes d'acides de cuisson par an. Certains acides de Koch qui sont fréquemment produits industriellement sont l'acide pivalique , l'acide 2,2-diméthylbutyrique et l' acide 2,2-diméthylpentanoïque .
Carbonyles métalliques
Le monoxyde de carbone réagit avec les métaux de transition pour former des carbonyles métalliques . Ce sont des composés complexes dans lesquels le monoxyde de carbone fonctionne comme un ligand . Les métaux se trouvent dans ces composés avec un nombre d'oxydation de zéro. Ludwig Mond a réussi à synthétiser le premier complexe métalcarbonyle homoleptique, le nickel tétracarbonyle , dès 1890. Dans les années qui ont suivi, il a réussi à synthétiser un certain nombre d'autres carbonyles métalliques tels que le fer pentacarbonyle , le dicobalt octacarbonyle et le molybdène hexacarbonyle . Dans de nombreux domaines de la chimie organométallique , les chimistes utilisent des carbonyles métalliques comme composants clés, par exemple pour étudier les liaisons chimiques et la synthèse ciblée de complexes organométalliques.
Les carbonyles métalliques sont également utilisés en synthèse organique et comme catalyseurs ou précurseurs de catalyseurs dans l' industrie chimique . Le ligand monoxyde de carbone peut être remplacé par d'autres ligands sur mesure, comme le tris ( métasulfonatophényle sodique ) phosphane hydrosoluble , et ainsi spécifiquement adaptés aux exigences des procédés techniques comme le procédé Ruhrchemie / Rhône-Poulenc .
Production de phosgène
Le phosgène est produit à partir de monoxyde de carbone et de chlore sous l' influence catalytique du charbon actif :
Le phosgène est une matière première importante pour la production de diisocyanates de méthylène et de toluène-2,4-diisocyanate . Il réagit avec les diols par polycondensation pour former des polycarbonates .
Agent réducteur
Dans le haut fourneau, il sert d' agent réducteur pour le minerai de fer selon la formule brute :
Le monoxyde de carbone n'est pas ajouté sous forme de gaz, mais provient dans le haut fourneau de la combustion du coke et de la réaction de Boudouard qui s'ensuit, ainsi que de la réaction du coke chaud avec de l'eau, libérant du monoxyde de carbone et de l'hydrogène. En réduisant les minerais de fer et les oxydes du fer compagnons manganèse , silicium et phosphore , le monoxyde de carbone est oxydé en dioxyde.
Le fer réduit absorbe le carbone du monoxyde de carbone et devient Fe 3 C, ce qu'on appelle la cémentite , ce qui fait chuter le point de fusion de 1538°C à environ 1300 à 1400°C.
En amont du haut fourneau les fourneaux à vent chaud qui vont dans les gaz de cheminée le monoxyde de carbone contenu brûlé :
Processus lunaire et fer carbonyle
Le processus de la lune utilise du monoxyde de carbone pour purifier le nickel métallique avec la formation et la décomposition de nickel tétracarbonyle dans une réaction de transport chimique . Le procédé a été développé par Ludwig Mond en 1890 . Le procédé convient à la production de nickel métallique pur à partir d'oxydes de nickel. Dans la première étape, les oxydes sont réduits en métal avec de l'hydrogène puis transformés en métal volatil carbonyle nickel tétracarbonyle à 40 à 60°C avec du monoxyde de carbone . Celui-ci peut être distillé à partir des autres constituants du minerai. A des températures de 150 à 300°C, le métal carbonyle se décompose à nouveau en métal pur et en monoxyde de carbone. Un procédé apparenté peut être utilisé pour fabriquer du fer carbonyle à partir du fer pentacarbonyle .
Technologie alimentaire
Lors du traitement de la viande et du poisson, une couleur de viande rouge intense peut être obtenue grâce à un traitement avec de faibles concentrations de monoxyde de carbone. La liaison du monoxyde de carbone et de la myoglobine crée un complexe de carboxymyoglobine rouge cerise . Cela simule visuellement une fraîcheur qui n'est plus présente . Le laboratoire du canton de Bâle a déjà prouvé l'utilisation du nitrite dans le thon comme substitut . Le monoxyde de carbone en tant que composant des emballages de gaz protecteur n'est pas autorisé dans l'Union européenne.
Autres utilisations
Le monoxyde de carbone adsorbé est utilisé de plusieurs manières dans la caractérisation de contacts hétérogènes et d'autres surfaces. En plus de déterminer la dispersion des centres métalliques actifs par chimisorption , les études sur le monoxyde de carbone adsorbé à l'aide de méthodes sensibles à la surface sont utilisées dans la recherche industrielle et fondamentale en technologie des semi-conducteurs , en recherche sur les piles à combustible et les matériaux . En chimie organométallique , l'étude des ligands du monoxyde de carbone au moyen de la spectroscopie infrarouge fournit un large éventail d'informations, par exemple sur les modes de liaison du monoxyde de carbone, la géométrie complexe et la charge du complexe. Dans le cas des carbonyles métalliques hétéroleptiques , la spectroscopie infrarouge renseigne également sur les propriétés et les conditions de liaison du ligand trans au monoxyde de carbone .
Dans les fermes à fourrure , le monoxyde et le dioxyde de carbone sont utilisés pour étouffer le vison afin que la fourrure soit endommagée le moins possible.
Le gaz de ville , qui était produit lors de la cokéfaction de la houille , était composé d'environ 9 à 10 % de monoxyde de carbone. Environ 350 m³ de gaz brut ont été obtenus par tonne de charbon par cokéfaction. Après lavage du gaz, celui-ci était stocké dans des gazomètres et odorisé au diphosphane avant d'être rejeté dans le réseau de gaz. Le gaz de ville était initialement utilisé pour l'éclairage des rues au moyen de lanternes à gaz , d'où le nom de gaz lumineux . À partir de 1910 environ, il était utilisé pour la cuisson et le chauffage dans les maisons privées. Dans les années 1970, le gaz de ville a été largement remplacé par le gaz naturel non toxique .
À l'époque nazie, le monoxyde de carbone a été utilisé pour la première fois dans le massacre de l' Action T4 dans le cadre de l'euthanasie et du « meurtre de personnes indignes », au cours desquelles des personnes principalement atteintes de troubles mentaux ont été assassinées. Dans certains camps d'extermination nazis, par exemple dans le camp de concentration de Majdanek , le monoxyde de carbone a ensuite été utilisé pour tuer en masse dans des chambres à gaz ou des camionnettes à gaz (soit en tant que composant des gaz d'échappement des moteurs à combustion, soit en tant que CO pur provenant de bouteilles de gaz sous pression).
toxicité
Général

Le monoxyde de carbone est une toxine respiratoire dangereuse car il est facilement absorbé par les poumons. Le gaz étant incolore, inodore, insipide et non irritant , il est à peine perceptible. Le niveau de tolérance individuel varie. Au fil des années, des accidents spectaculaires impliquant du monoxyde de carbone se sont répétés, comme l' accident ferroviaire de Balvano (1944) ou l' accident de la mine Kellogg (1972), dont certains ont fait des centaines de morts.
Lorsqu'il est entré dans la circulation sanguine via les poumons, il se lie à l'atome de fer central de l' hémoglobine , empêchant ainsi le transport de l'oxygène dans le sang, ce qui peut entraîner la mort par asphyxie . Les symptômes d'une intoxication légère comprennent des maux de tête , des étourdissements et des symptômes pseudo-grippaux. Des doses plus élevées sont significativement toxiques pour le système nerveux central et le cœur. Le monoxyde de carbone est la cause de plus de la moitié des intoxications mortelles dans le monde. Aux États-Unis , entre 1979 et 1988, plus de 56 000 personnes sont mortes d'intoxication au monoxyde de carbone, avec plus de 25 000 cas d'intoxication suicidaire , selon une étude . Plus de 15 000 cas étaient liés aux incendies et plus de 11 000 cas étaient des décès accidentels non liés aux incendies. Le nombre d'intoxications involontaires par les gaz d'échappement des automobiles est en forte baisse en raison de l'utilisation généralisée des pots catalytiques à trois voies . Néanmoins, l'intoxication au monoxyde de carbone sans incendie aux États-Unis a entraîné environ 15 000 traitements dans les salles d'urgence des hôpitaux et 500 décès en 2011. En Allemagne, il existe une obligation de déclarer les intoxications au monoxyde de carbone depuis le 1er août 1990. De cette date au 31 décembre 2008, l' Institut fédéral d'évaluation des risques a reçu plus de 57 000 rapports médicaux d'intoxications ou de cas suspects, soit environ 3 000 par an.
effet
Le pourcentage d'hémoglobine recouverte de monoxyde de carbone dans le sang est également abrégé en COHb (monoxyde de carbone hémoglobine) . Selon des études plus anciennes, il n'y a aucun danger pour les adultes en bonne santé même avec une exposition continue de huit heures par jour à des concentrations allant jusqu'à 115 ppm ; il n'y a que des concentrations de 4 % de COHb chez les non-fumeurs et de 7,6 % chez les fumeurs . Cependant, des études récentes montrent que dans les groupes à risque atteints de maladies cardiovasculaires , des niveaux de stress de 2,7% ou plus peuvent augmenter les symptômes de la maladie. Avec une exposition chronique supérieure à 150 à 300 ppm, des étourdissements, de la somnolence, des nausées et des vomissements surviennent. Pour les quantités létales aiguës du gaz ( LC 50 ), voir l'encadré d'information (ci-dessus). La surdité est augmentée jusqu'à 50 % en cas d'exposition au CO. D'autres sources, qui se réfèrent à des études plus récentes, supposent cependant que des valeurs de 2 à 5 % de COHb conduisent déjà aux premiers symptômes. Par exemple, 2% de COHb perturbe la perception du temps , à peine perceptible . Avec des valeurs de COHb inférieures à 20% de fatigue, des maux de tête , des palpitations et des troubles visuels surviennent. Des symptômes tels que somnolence , vertiges et faiblesse musculaire sont connus dans la fourchette de 20 à 30 % . Dans la plage de 30 à 50 % de COHb, des nausées , des vomissements , des troubles de la concentration , des bourdonnements d'oreilles , une perte de conscience et un collapsus circulatoire surviennent. La peau devient rose. A partir d'une valeur COHb de 50%, une perte de conscience profonde survient, accompagnée de crampes et de troubles respiratoires. Il y a alors un grave danger de mort. La mort survient avec des taux de COHb de 60 à 70 %. Environ 85 % du monoxyde de carbone inhalé est lié dans le sang, les 15 % restants sont liés à la myoglobine sous forme de carboxymyoglobine rouge cerise .
La tolérance individuelle au monoxyde de carbone est influencée par divers facteurs, tels que l'activité exercée, la fréquence respiratoire , des dommages antérieurs ou des maladies ( circulation sanguine , anémie ou drépanocytose ). D'autres facteurs sont la pression atmosphérique ou le taux métabolique basal .
Le monoxyde de carbone se lie environ 250 à 325 fois plus à l'hémoglobine du pigment du sang rouge que l' oxygène , à un Kohlenstoffmonoxidanteil de 0,1% dans l' air respirable, de sorte qu'environ la moitié des globules rouges sont désactivés. L'effet toxique du monoxyde de carbone est réduit par l'environnement protéique de l' hème dans l'hémoglobine, de sorte que le monoxyde de carbone se lie à un hème non obstrué environ 26 000 fois plus fortement que l'oxygène. La cause est supposée être qu'il n'y a pas assez d'espace dans la poche d'enzyme pour permettre la géométrie linéaire Fe-CO préférée par le monoxyde de carbone, mais la coordination angulaire préférée par le dioxygène n'est pas entravée. Avec une teneur en air d'environ 0,5 % en volume, la mort survient en quelques minutes. La demi-vie d'élimination du monoxyde de carbone du sang est de 2 à 6,5 heures, selon la quantité de monoxyde de carbone absorbée et le taux de ventilation de la personne.
Dommages consécutifs
En plus de l'intoxication aiguë, il y a des dommages indirects. Le monoxyde de carbone a de graves effets négatifs sur le développement du fœtus. L' exposition chronique à de faibles niveaux de monoxyde de carbone peut conduire à la dépression . En moyenne, les expositions de plus de 100 ppm sont considérées comme dangereuses pour la santé. La limite d' exposition professionnelle (VLEP - auparavant : valeur MAK) est de 30 ppm. Le monoxyde de carbone peut réduire l'espérance de vie en endommageant le cœur. L' intoxication professionnelle au monoxyde de carbone est reconnue comme une maladie professionnelle . Entre 2005 et 2008, selon les rapports du ministère fédéral du Travail et des Affaires sociales, environ 126 maladies causées par le monoxyde de carbone ont été signalées chaque année.
Diagnostic
En liant le monoxyde de carbone à l'hémoglobine, les oxymètres de pouls conventionnels sont trompés et indiquent à tort des taux élevés de saturation en oxygène. Cependant, avec les nouveaux oxymètres de pouls à 7 longueurs d'onde, la fraction saturée en CO de l'hémoglobine peut également être détectée. Les signes extérieurs d' une intoxication au monoxyde de carbone sont des muqueuses rouge cerise . Selon des études plus récentes avec un nombre élevé de cas (231 patients), ce signe clinique est rarement rencontré, surtout dans les formes d'intoxication plus légères. La couleur est le résultat des complexes de transfert de charge de monoxyde de carbone de l'hémoglobine rouge foncé . De plus, les points morts (livores) qui apparaissent sur le cadavre après la mort peuvent également être colorés en rouge vif par ce mécanisme et donner ainsi une indication d'une intoxication au monoxyde de carbone.
thérapie
Les patients gravement intoxiqués au monoxyde de carbone sont généralement intubés et ventilés avec une pression expiratoire positive ( PEP ) et 100 % d' oxygène . En raison de l'apport d'oxygène considérablement accru, le monoxyde de carbone est déplacé par l'hémoglobine. Une oxygénation hyperbare peut être envisagée.
La demi-vie avec laquelle l'augmentation de la concentration de CO dans le sang ( valeur CO- Hb ) diminue par expiration à l'air frais est d'environ 3 à 8 heures. La demi-vie peut être réduite par une oxygénothérapie forcée (hyperventilation avec de l'oxygène pur au moyen d'une intubation orotrachéale) jusqu'à 45 minutes.
Importance biologique
personne
Chez l'homme, la proportion d'hémoglobine COHb dans le sang, qui est enrobée de monoxyde de carbone, est comprise entre 0,7 et 1,1 % dans le sang veineux, dont environ 0,5 % est produite de manière endogène . Un niveau accru de monoxyde de carbone dans les cellules entraîne une libération jusqu'à 1000 fois plus élevée de la glycoprotéine érythropoïétine (EPO) .
Substance messagère
L' enzyme hème oxygénase construit des composés hémiques constitués principalement d' hémoglobine dérivée, avec libération de monoxyde de carbone. Cette enzyme et une guanylate cyclase , qui est régulée par le monoxyde de carbone, pourraient être détectées dans le centre olfactif du cerveau humain et dans le bulbe olfactif . Selon cela, le monoxyde de carbone pourrait servir de substance messagère gazeuse (voir gazotransmetteur ) pour le sens de l'odorat. La guanylate cyclase activée libère la substance messagère secondaire cGMP . En plus du monoxyde de carbone, du cGMP et du cAMP , l'oxyde nitrique est également considéré comme un second messager . L'azote et le monoxyde de carbone, en tant que gaz hydrosolubles à poids moléculaire extrêmement faible, peuvent pénétrer les biomembranes très rapidement et relativement sans entrave et servent donc de neurotransmetteurs dans la transmission d'informations de la mémoire primaire ou sensorielle à la mémoire secondaire ou à long terme à travers le système limbique .
Propriétés anti-inflammatoires
Le monoxyde de carbone a un effet anti-inflammatoire dans l' inflammation intestinale chronique , ce qui explique le fait auparavant déroutant que les fumeurs sont beaucoup moins susceptibles de développer une colite ulcéreuse que les non-fumeurs. Même après une transplantation pulmonaire, l'inhalation de faibles doses de monoxyde de carbone prévient les dommages causés par l' ischémie ou la reperfusion . Si les reins destinés à la transplantation sont conservés dans une solution contenant du monoxyde de carbone à de faibles concentrations, l'augmentation de l' hème libre et la diminution du cytochrome P450 autrement observées sont inhibées et la peroxydation lipidique endommageant les cellules est ainsi réduite. Des effets favorables du monoxyde de carbone ont également été décrits dans des modèles animaux de choc septique , d' occlusion intestinale (iléus) et d' artériosclérose . Chez les femmes souffrant d' hypertension gestationnelle et d' intoxication gravidique (prééclampsie) , la concentration de monoxyde de carbone dans l'air expiré est réduite. Les femmes qui fument ont un risque réduit de développer une prééclampsie. Des médicaments capables de transporter et de libérer des quantités contrôlées de monoxyde de carbone sont en cours de développement.
Respiration anaérobie chez les archées
Dans la formation du méthane ( méthanogénèse ), le monoxyde de carbone est utilisé par quelques archées comme substrat pour la respiration anaérobie . Methanothermobacter thermoautotrophicus et Methanosarcina barkeri forment trois molécules de CO 2 et une molécule de méthane à partir de quatre molécules de CO , selon :
Aussi acetivorans Methanosarcina peuvent utiliser le CO en tant que substrat, dans lequel parallèle l' acétate et le formiate sont formés. Ce type d' acétogenèse chez les méthanogènes est appelé acétogenèse carboxidotrophique .
Source d'énergie et de carbone de monoxyde de carbone utilisant des bactéries
| Groupe physiologique (tous ne peuvent pas croître avec le CO, vert : aérobie, rouge : anaérobie) | représentant examiné | Équation de réaction |
|---|---|---|
| Bactéries carboxidotrophes | Oligotropha carboxidovorans | 2 CO + O 2 → 2 CO 2 |
| Bactéries hydrogénogènes | Carboxydothermus hydrogénoformans | CO + H 2 O → CO 2 + H 2 |
| Bactéries acétogènes |
Moorella thermoacetica (anciennement Clostridium thermoaceticum ) |
4 CO + 2 H 2 O → CH 3 COOH + 2 CO 2 |
| Bactéries phototrophes |
Rhodospirillum rubrum (comparer la colonne Winogradsky ) |
CO + H 2 O → CO 2 + H 2 |
| Bactéries sulfurogènes | Desulfovibrio vulgaris | 4 CO + H 2 SO 4 → 4 CO 2 + H 2 S |
Peu de bactéries sont capables d'utiliser le monoxyde de carbone comme substrat. Ils l'utilisent pour accumuler des composés organiques ( assimilation du dioxyde de carbone ) et pour générer de l'énergie. Les conditions aérobies vivant carboxidobacteria sont parmi les bactéries qui utilisent le carbone monoxyde . Ils sont facultativement chimiolithoautotrophes , ce qui signifie qu'ils vivent de l'oxydation de substances inorganiques. Les carboxidobactéries oxydent le monoxyde de carbone en présence d'oxygène en dioxyde de carbone, selon :
Alternativement, certaines espèces peuvent également utiliser du nitrate (NO 3 - ) à la place de l'oxygène ( dénitrification ), cela se fait à l'exclusion de l'oxygène ( anaérobie ). Un oxydant de CO aérobie bien étudié est Oligotropha carboxidovorans . Les carboxidobactéries neutralisent ainsi probablement la pollution atmosphérique de l'atmosphère par le CO.
Il existe également un certain nombre de chimiototrophes strictement anaérobies qui oxydent le CO en l'absence d'oxygène. C'est ainsi que cela se passe avec Carboxydothermushydrogénoformans selon :
L'enzyme clé dans les deux types est la monoxyde de carbone déshydrogénase (CODH). Le CODH aérobie contient du cuivre et du molybdène , tandis que le CODH des bactéries strictement anaérobies utilise du fer et du nickel .
preuve
Plusieurs types de capteurs de monoxyde de carbone sont connus. Ils sont basés sur la détection optochimique, les mesures de conductivité infrarouge ou thermique , les mesures d'effets thermiques , les procédés électrochimiques ou à base de semi-conducteurs . La conception la plus simple comporte des capteurs optochimiques qui indiquent le changement de couleur d'un produit chimique lorsqu'il entre en contact avec le monoxyde de carbone. Les capteurs sont simples et peu coûteux, mais l'affichage du monoxyde de carbone est plus qualitatif. La formation de carbonyles métalliques sert d'affichage optochimique. Une mesure plus précise de la concentration en monoxyde de carbone est possible avec des capteurs électrochimiques ou des capteurs à base de semi-conducteurs. Les capteurs infrarouges non dispersifs sont très répandus . Il existe aujourd'hui sur le marché des capteurs électroniques portables et fixes ( dispositifs d'avertissement de gaz ) qui permettent la détection de monoxyde de carbone dans la plage de 20 à 2000 ppm dans l'air ambiant. Une alarme se produit généralement sur la base d'une fonction concentration-temps de sorte que les fausses alarmes, par exemple dues à la fumée de cigarette, soient évitées autant que possible.
Le diiodopentoxyde I 2 O 5 est également utilisé comme réactif de détection précis , qui est réduit quantitativement en iode élémentaire I 2 dans un tube en U à des températures plus élevées (environ 80-160 ° C) en présence de monoxyde de carbone , avec formation simultanée de dioxyde de carbone CO 2 :
Le changement de couleur convient également à la détection à l'aide de tubes à essai . La teneur en CO du gaz peut être déterminée en contre- titrant l'iode avec du thiosulfate S 2 O 3 2− ( iodométrie ). Alfred Ditte a étudié ce procédé avec le pentoxyde de diiode dès 1870. L'hydrogène - même à des concentrations plus élevées - n'a qu'un effet très minime sur la précision de détection de cette méthode. La détermination quantitative simultanée du dioxyde de carbone converti (détermination par conductivité ou par précipitation d'une solution d'hydroxyde de baryum ) rend la mesure très précise.
Le monoxyde de carbone réagit avec les solutions aqueuses de sel de palladium même à température ambiante . Dans ce processus, les sels de Pd 2+ sont réduits en palladium métallique, le monoxyde de carbone étant oxydé en dioxyde de carbone. La précipitation du palladium métallique finement divisé colore la solution échantillon en noir et indique ainsi le monoxyde de carbone.
Littérature
- AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , p. 896-900.
- La directive S1 travaille sous l'influence du monoxyde de carbone (monoxyde de carbone) de la Société allemande de médecine du travail et de médecine environnementale. Dans : AWMF en ligne (à partir de 2011)
- Louis Lewin : L'histoire de l'empoisonnement à l'oxyde de carbone. Dans : Sudhoffs Archiv 3, 1910, p. 1-35.
liens web
Preuve individuelle
- ↑ a b c d e f g h i j k l m n o p q r Entrée sur le monoxyde de carbone dans la base de données des substances GESTIS de l' IFA , consultée le 8 janvier 2021. (JavaScript requis)
- ↑ a b David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Dipole Moments, pp. 9-53.
- ↑ Entrée sur le monoxyde de carbone dans l' inventaire des classifications et étiquetages de l' Agence européenne des produits chimiques (ECHA), consulté le 1er février 2016. Les fabricants ou les distributeurs peuvent étendre la classification et l'étiquetage harmonisés .
- ↑ Caisse suisse d'assurance contre les accidents (Suva): Valeurs limites - valeurs MAK et BAT actuelles (recherche 630-08-0 ou monoxyde de carbone ), consulté le 2 novembre 2015.
- ↑ thermodynamiques données de CO. National Institute for Standards and Technology, mars 2013, archivé à partir de l' original le 2 février 2015 ; consulté le 16 août 2014 .
- ^ IUPAC : Nomenclature de la chimie inorganique. Édition allemande des recommandations 1990. VCH, Weinheim 1994, ISBN 3-527-25713-6 , p.76 .
- ↑ Ivan Blumenthal: intoxication au monoxyde de carbone. Dans : Journal de la Société royale de médecine. Volume 94, n° 6, juin 2001, pp. 270-272, PMC 1281520 (texte intégral gratuit).
- ↑ John Hrastar : Le gaz naturel liquide aux États-Unis : une histoire. Mcfarland & Co Inc., 2014, ISBN 978-0-7864-7859-0 , page 32.
- ^ RE Schofield : Le Joseph Priestley éclairé. Une étude de sa vie et de son travail de 1773 à 1804. Pennsylvania State University Press, 2004, ISBN 978-0-271-03625-0 , page 103.
- ^ Guy H. Neild : William Cruickshank (FRS - 1802) : chimiste clinique. (PDF; 1,7 Mo) Consulté le 26 juillet 2014 .
- ^ Henry Friedlander : Les origines du génocide nazi : De l'euthanasie à la solution finale . The University of North Carolina Press, 1997, ISBN 978-0-8078-4675-9 , pp. 123 .
- ↑ a b c M. AK Khalil, RA Rasmussen : Le cycle global du monoxyde de carbone : tendances et bilan de masse . Dans : Chemosphère . ruban 20 , 1990, p. 227-242 (anglais).
- ↑ a b c d M. AK Khalil, JP Pinto, MJ Shearer: monoxyde de carbone atmosphérique . Dans: Chemosphere: Global Change Science . ruban 1 , p. xi – xiii (anglais).
- ↑ a b Terra fête ses cinq ans : comment Terra suit la pollution. Dans : earthobservatory.nasa.gov. 11 mars 2011, consulté le 8 janvier 2015 .
- ↑ a b c d e Évaluation scientifique intégrée du monoxyde de carbone. EPO, 2010, consulté le 29 août 2014 .
- ↑ Sachin D. Ghude, G. Beig : Distribution régionale observée par satellite du dioxyde d'azote troposphérique (NO2) et du monoxyde de carbone (CO) sur le sous-continent indien. (PDF) Récupéré le 21 septembre 2014 (Anglais).
- ^ O. Badr, SD Probert : Éviers et impacts environnementaux pour le monoxyde de carbone atmosphérique. Dans : Énergie appliquée. Tome 50, 1995, p. 339-372.
- ↑ W. Seiler, C. Junge : Monoxyde de carbone dans l'atmosphère. Dans : Journal de recherche géophysique. Volume 75, 1970, pp. 2217-2226, doi: 10.1029 / JC075i012p02217 .
- ↑ JW Swinnerton, VJ Linnenbom, RA Lamontagne : L'océan : une source naturelle de monoxyde de carbone. Dans : Sciences. Volume 167, 1970, pp. 984-986, doi: 10.1126 / science.167.3920.984 .
- ↑ Detlev Möller : Air : chimie, physique, biologie, propreté, droit. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , p.18 .
- ↑ JC McConnell, MB McElroy, SC Wofsy : Sources naturelles de CO atmosphérique. Dans : Nature. Volume 233, 1971, pp. 187-188, doi: 10.1038 / 233187a0 .
- ↑ Évaluation scientifique intégrée du monoxyde de carbone. Agence de protection de l'environnement des États-Unis, janvier 2010, consulté le 16 août 2014 .
- ^ Robert C. MacDonald, Ray Fall: Détection d'émissions substantielles de méthanol des plantes dans l'atmosphère. Dans : Environnement atmosphérique. Partie A. Sujets généraux. Volume 27, n° 11, 1993, pp. 1709-1713, doi : 10.1016 / 0960-1686 (93) 90233-O .
- ^ Siegfried Fred Singer : L'environnement mondial changeant . D. Reidel Publishing Company , Dordrecht 1975, ISBN 90-277-0385-X , pp. 90 ( aperçu limité dans la recherche Google Book).
- ↑ a b Tom Gosink : Que signifient les niveaux de monoxyde de carbone ? Dans : Forum scientifique de l'Alaska. Geophysical Institute, University of Alaska Fairbanks, 28 janvier 1983, archivé à partir de l' original le 25 décembre 2008 ; Récupéré le 1er décembre 2007 .
- ↑ Dusan Gruden : Protection de l'environnement dans l'industrie automobile : moteur, carburants, recyclage Couverture rigide. Vieweg + Teubner Verlag, 2008, ISBN 978-3-8348-0404-4 , page 127.
- ↑ Réduire les émissions polluantes des véhicules légers. Dans : Règlement (CE) n° 715/2007 du Parlement européen et du Conseil du 20 juin 2007 relatif à la réception par type des véhicules à moteur en ce qui concerne les émissions des véhicules particuliers et utilitaires légers (Euro 5 et Euro 6) et sur accès aux informations sur la réparation et l'entretien des véhicules. Union européenne, 29 mars 2013, consulté le 11 août 2014 .
- ↑ Katja Petzold : Sur la climatologie des oxydes d'azote, de l'ozone et du monoxyde de carbone dans la troposphère : une analyse du jeu de données MOZAIC. Rapports du Forschungszentrum Jülich, 4327, ISSN 0944-2952 , p. 6.
- ↑ Horst Fischer, Heiko Bozem, Jos Lelieveld : La production photochimique d'ozone dans la troposphère. Max Planck Institute for Chemistry, 2011, consulté le 29 août 2014 .
- ^ B. Weinstock, H. Niki : Équilibre du monoxyde de carbone dans la nature. Dans : Sciences. Volume 176, 1972, pp. 290-292, doi: 10.1126 / science.176.4032.290 .
- ↑ Méthodes et normes pour la mesure de l'environnement : Actes du 8e Symposium sur la recherche sur les matériaux qui s'est tenu au National Bureau of Standards. Gaithersburg, Maryland, 20-24 septembre 1976, numéro 464, page 440.
- ↑ Claus Bliefert: chimie de l' environnement . 3. Édition. Wiley-VCH, Weinheim 2002, ISBN 3-527-30374-X , p. 9 ( aperçu limité dans la recherche Google Book).
- ↑ Danger dû à la cheminée. Dans : Berliner Kurier. 15 novembre 2006, consulté le 17 août 2014 .
- ↑ a b Vert W : Introduction à la qualité de l'air intérieur : Monoxyde de carbone (CO). Agence de protection de l'environnement des États-Unis, consulté le 16 décembre 2008 .
- ^ A. Hahn, K. Begemann, R. Burger, M. Friedemann, J. Hillebrand, H. Meyer, R. Kolbusa, M. Gessner : Ärztliche Mitteilungen bei Vergiftungen 2008 . Ed. : Service de presse de l'Institut fédéral d'évaluation des risques. Berlin 2010, ISBN 3-938163-54-2 , p. 58 .
- ↑ Évitez les gaz toxiques de la soute à pellets. Institut fédéral d'évaluation des risques, 17 juillet 2014, consulté le 12 août 2014 .
- ↑ Sabine Sickinger, Stefan Sellmeier, Oliver Meisenberg, Sebastian Schöttner : Intoxication au monoxyde de carbone par les appareils de ventilation ? Dans : protection incendie . Non. 7 , 2011, p. 538-540 .
- ^ Politique de gestion du tabagisme de Queensland Health. (N'est plus disponible en ligne.) QH, archivé à partir de l' original le 15 novembre 2014 ; Consulté le 1er mars 2010 .
- ↑ Toni Fischer et al. : Pollution de l'air par la fumée de tabac dans les restaurants . In: ETH Zurich (Ed.): Archives internationales de la santé au travail et de l'environnement . ruban 41 , 1978, p. 267–280 ( ucsf.edu - ethz.ch (PDF) résumé [consulté le 26 août 2015]).
- ↑ D. Talbi, E. Herbst : La destruction en phase gazeuse du dioxyde de carbone interstellaire : Calculs sur les réactions entre CO 2 et H 2 et entre CO 2 et H . Dans : Astronomie et astrophysique . ruban 386 , non. 3 , 2002, p. 1139-1142 , doi : 10.1051 / 0004-6361 : 20020312 .
- ↑ a b M. Oppenheimer, A. Dalgarno : La formation de monoxyde de carbone et l'équilibre thermique dans les nuages interstellaires. Dans : Le Journal d'Astrophysique. Volume 200, 1975, pp. 419-425, code bibliographique : 1975ApJ ... 200..419O . doi : 10.1086 / 153805 .
- ^ TR Ayers : Bifurcation thermique de la photosphère externe. Dans : Photosphère solaire : structure, convection et champs magnétiques. Dans : Actes du 138e Symposium de l'Union astronomique internationale. Springer, 1989, ISBN 0-7923-0529-9 , p. 23-28.
- ^ Gordon Newkirk Jr. : Monoxyde de carbone dans l'atmosphère solaire. Dans : Le Journal d'Astrophysique. Volume 125, 1957, page 571, code bibliographique : 2005A & A ... 438.1043W . doi: 10.1051 / 0004-6361: 20042550 .
- ↑ Pierre Connes et al. : Monoxyde de carbone dans l'atmosphère de Vénus. Dans : Le Journal d'Astrophysique. Volume 152, 1968, pp. 731-743, code bibliographique : 1968ApJ ... 152..731C . doi : 10.1086 / 149590 .
- ^ Lewis D. Kaplan, Janine Connes, Pierre Connes : Monoxyde de carbone dans l'atmosphère martienne. Dans : Le Journal d'Astrophysique. Volume 157, 1969, page L187, code bibliographique : 1969ApJ ... 157L.187K ; doi : 10.1086 / 180416 .
- ^ R. Beer : Détection de monoxyde de carbone dans Jupiter. Dans : Le Journal d'Astrophysique. Volume 200, 1975, pp. L167-L169, code bibliographique : 1975ApJ ... 200L.167B . doi : 10.1086 / 181923 .
- ↑ Keith S. Noll et al. : Détection de monoxyde de carbone dans Saturne. Dans : Le Journal d'Astrophysique. Volume 309, 1986, pp. L91-L94, code bibliographique : 1986ApJ ... 309L..91N . doi: 10.1086/184768 .
- ↑ MA Lopez-Valverde, E. Lellouch, A. Coustenis : Fluorescence du monoxyde de carbone de l'atmosphère de Titan. Dans : Icare. Volume 175, 2005, pp. 503-521, doi : 10.1016 / j.icarus.2004.12.015 .
- ↑ A. Marten et al. : Premières observations de CO et HCN sur Neptune et Uranus aux longueurs d'onde millimétriques et implications pour la chimie atmosphérique. Dans : Le Journal d'Astrophysique. Volume 406, 1993, pp. 285-297, code bibliographique : 1993ApJ ... 406..285M . doi : 10.1086 / 172440 .
- ^ K. Lodders : L'origine du monoxyde de carbone dans l'atmosphère de Neptune. Dans : Icare. Volume 112, 1994, pp. 368-375, doi: 10.1006/icar.1994.1190 .
- ↑ Detlev Möller : Air : chimie, physique, biologie, propreté, droit. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , page 17.
- ↑ Ken Croswell : Azote dans l'atmosphère de Pluton. Dans : KenCroswell.com. 20 juin 1992. Consulté le 28 juin 2013 .
- ↑ QM Konopacky, TS Barman, BA Macintosh, C. Marois : Détection de lignes d'absorption de monoxyde de carbone et d'eau dans une atmosphère d'exoplanète. Dans : Sciences. Volume 339, 2013, pp. 1398-1401, doi : 10.1126 / science.1232003 .
- ↑ Halley : Flyby 13 mars 1986. Dans : ESA.int. ESA, consulté le 28 juin 2013 .
- ↑ Michael A. DiSanti : Preuve d'une source native dominante de monoxyde de carbone dans la comète C / 1996 B2 (Hyakutake). Dans : Journal de recherche géophysique. Volume 108, 2003, page 5061, doi : 10.1029 / 2002JE001961 .
- ↑ Michael A. DiSanti, Michael J. Mumma, Neil Dello Russo, Karen Magee-Sauer, Robert Novak, Terrence W. Rettig : Identification de deux sources de monoxyde de carbone dans la comète Hale – Bopp. Dans : Nature. Volume 399, 1999, pp. 662-665, doi : 10.1038 / 21378 .
- ^ Matthew C. Senay, David Jewitt : Formation de coma entraînée par la libération de monoxyde de carbone de la comète Schwassmann-Wachmann 1. Dans : Nature. Volume 371, pp. 229-230, doi : 10.1038/371229a0 .
- ↑ Damon P. Simonelli, James B. Pollack, Christopher P. Mckay, Ray T. Reynolds, Audrey L. Summers : Le bilan du carbone dans la nébuleuse solaire externe. Dans : Icare. Volume 82, 1989, pp. 1-35, doi : 10.1016 / 0019-1035 (89) 90020-1 .
- ↑ Muriel Gargaud, Ricardo Amils : Encyclopédie d'astrobiologie. Volume 1, Springer, 2011, ISBN 978-3-642-11271-3 , pp. 245-246 ( aperçu limité dans la recherche de livres Google).
- ^ Craig Kulesa : Vue d'ensemble : Astrophysique moléculaire et formation d'étoiles. 17 octobre 1999, consulté le 27 juillet 2014 .
- ^ Gerrit L. Verschuur : Interstellar Matters : Essais sur la curiosité et la découverte astronomique. Springer, 2013, ISBN 978-3-7643-6696-4 , page 247.
- ^ WB Burton, MA Gordon : Monoxyde de carbone dans la galaxie. III. La nature globale de sa distribution dans le plan équatorial. In : Astronomie et astrophysique. Volume 63, 1978, pp. 7-27, bibcode : 1978A & A .... 63 .... 7B .
- ^ Klaus Weissermel , Hans-Jürgen Arpe : Chimie organique industrielle . 3. Édition. VCH, Weinheim 1997, ISBN 3-527-28838-4 , p. 15 .
- ^ Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner : Chimie inorganique industrielle . 2e édition. Wiley-VCH, Weinheim 2000, ISBN 978-3-527-29849-5 , p. 15 .
- ↑ a b Jürgen Bierhals: Monoxyde de carbone . Dans : Encyclopédie d'Ullmann de chimie industrielle . 6e édition. Wiley-VCH, Weinheim 2002, ISBN 978-3-527-30385-4 .
- ^ Un b Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch : Charbon, pétrole, gaz naturel : chimie et technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , p. 56-64.
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: charbon, pétrole, gaz naturel: Chemistry and Technology. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , page 65.
- ↑ a b c d e A. F. Holleman , E. Wiberg , N. Wiberg : Textbook of Inorganic Chemistry . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , page 898.
- ↑ R. Conrad : Nouveaux procédés chimiques. In : Technologie de l'ingénieur chimiste - CIT. Volume 42, 1970, pp. 1555-1568, doi : 10.1002 / cite.330422410 .
- ^ Gaurav Nahar, Valerie Dupont : Production d'hydrogène à partir d'alcanes simples et d'hydrocarbures oxygénés sur des catalyseurs supportés par la cérine-zircone : Revue. Dans : Revues sur les énergies renouvelables et durables . Volume 32, 2014, pp. 777-796, doi : 10.1016 / j.rser.2013.12.040 .
- ↑ Ekkehard Fluck, Carl Mahr : Stage de base inorganique . 6e édition. VCH, Weinheim 1985, ISBN 3-527-26032-3 , p. 234 .
- ↑ Georg Brauer (Ed.), Avec la collaboration de Marianne Baudler et autres : Handbook of Preparative Inorganic Chemistry. 3e édition revue et corrigée. Volume II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , pp. 621-622.
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: charbon, pétrole, gaz naturel: Chemistry and Technology. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , pages 175-176.
- ^ Allen I. Katz, David Schiferl, Robert L. Mills : Nouvelles phases et réactions chimiques dans le monoxyde de carbone solide sous pression. Dans : Le Journal de Chimie Physique. Volume 88, 1984, pp. 3176-3179, doi: 10.1021/j150659a007 .
- ↑ M. Lipp, WJ Evans, V. Garcia-Baonza, HE Lorenzana : Monoxyde de carbone : Caractérisation spectroscopique de la phase polymérisée à haute pression. Dans : Journal of Low Temperature Physics. Volume 111, 1998, pp. 247-256, doi : 10.1023 / A : 1022267115640 .
- ↑ N. Rademacher, L. Bayarjargal, W. Morgenroth, B. Winkler, J. Ciezak-Jenkins : Préparation et caractérisation du monoxyde de carbone solide à haute pression dans la cellule à enclume de diamant. (PDF) DESY, 2011, consulté le 9 août 2014 .
- ↑ http://www.uni-magdeburg.de/isut/TV/Download/Kapitel3_VerbrnungSS2003.pdf
- ↑ Linus Pauling: Principes fondamentaux de la chimie. Verlag Chemie, 1969, ISBN 3-527-25392-0 , page 149.
- ^ JE Huheey, EA Keiter, RL Keiter : Chimie inorganique : Principes de structure et de réactivité. de Gruyter, 2003, ISBN 3-11-017903-2 , page 173.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , page 1789.
- ^ B. Rosenblum, A. Nethercot, C. Townes : Rapports de masse isotopiques, moments magnétiques et signe du moment dipolaire électrique dans le monoxyde de carbone. Dans : Examen physique. Volume 109, 1958, pp. 400-412, doi : 10.1103 / PhysRev.109.400 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , p.900 .
- ↑ L. Gattermann, JA Koch : Une synthèse d'aldéhydes aromatiques. Dans : Rapports de la Société chimique allemande. Volume 30, 1897, pp. 1622-1624, doi : 10.1002 / cber.18970300288 .
- ↑ WA Herrmann : 100 ans de carbonyles métalliques. Une découverte fortuite fait l'histoire. Dans : La chimie à notre époque . Volume 22, n° 4, 1988, pp. 113-122, doi : 10.1002 / ciuz.19880220402 .
- ^ Un b Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , page 104.
- ↑ La mise en service du gazoduc Bayer de monoxyde de carbone Dormagen-Krefeld / Uerdingen est provisoirement arrêtée. (N'est plus disponible en ligne.) Tribunal administratif supérieur de Rhénanie du Nord-Westphalie, 18 décembre 2007, archivé à partir de l' original le 14 juillet 2014 ; Consulté le 13 juillet 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , p. 179-182 .
- ↑ Andrei Y. Khodakov, Wei Chu, Pascal Fongarland : Avancées dans le développement de nouveaux catalyseurs au cobalt pour la synthèse Fischer-Tropsch d'hydrocarbures à longue chaîne et de carburants propres. Dans : ChemInform. Volume 38, 2007, pp. 1692-1744, doi : 10.1002 / chin.200733255 .
- ↑ PL Spath, DC Dayton : Examen préliminaire - Évaluation technique et économique du gaz de synthèse pour les carburants et les produits chimiques en mettant l'accent sur le potentiel du gaz de synthèse dérivé de la biomasse. (PDF) Dans : NREL / TP510-34929. National Renewable Energy Laboratory, décembre 2003, consulté le 16 août 2014 .
- ^ Un b Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , pp. 185-187.
- ^ Un b Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , pp. 239-240.
- ↑ a b Tradition des idées : Acide formique. décembre 2012, consulté le 11 juillet 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , p. 241-243.
- ^ Joseph R. Zoeller, Victor H. Agreda, Steven L. Cook, Norma L. Lafferty, Stanley W. Polichnowski, David M. Pond : processus d'anhydride acétique de la société chimique Eastman. Dans : Catalyse aujourd'hui . Volume 13, 1992, pp. 73-91, doi: 10.1016 / 0920-5861 (92) 80188-S .
- ↑ A. Gossauer : Structure et réactivité des biomolécules. Helvetica Chimica Acta, Zurich 2006, ISBN 3-906390-29-2 , page 155.
- ↑ Jürgen Falbe, Helmut Bahrmann : Catalyse homogène en technologie. In : La chimie à notre époque. Volume 15, 1981, pp. 37-45, doi : 10.1002 / ciuz.19810150203 .
- ↑ L. Mond, C. Langer, F. Quincke : Action du monoxyde de carbone sur le nickel. Dans : J. Chem.Soc. 1890, 57, pp. 749-753 ( doi : 10.1039 / CT8905700749 ).
- ↑ Ludwig Mond, Heinrich Hirtz, Matthewman Dalton Cowap : Note sur un composé volatil de cobalt avec du monoxyde de carbone. Dans : Chem. News. Volume 98, 1908, page 165 ; Chem. Abs. Vol. 2, 1908, page 3315.
- ↑ Dirk Steinborn : Fondamentaux de la catalyse des complexes organométalliques. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6 , page 83.
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt : Fondements de la chimie industrielle. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , page 391.
- ^ Günther Neroth, Dieter Vollenschaar : Fer et acier. In: Wendehorst science des matériaux de construction. Vieweg + Teubner Verlag, 2011, ISBN 978-3-8351-0225-5 , p. 637-702.
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Heat of Combustion, pp. 5-70.
- ↑ L. Mond, C. Langer, F. Quincke : Action du monoxyde de carbone sur le nickel. Dans : J. Chem.Soc. Volume 57, 1890, pp. 749-753, doi : 10.1039 / CT8905700749 .
- ↑ Eckard Amelingmeier et al. Rômpp Lexikon Chemie. Volume 4, 10e édition, 1996-1999, Georg Thieme Verlag, ISBN 978-3-13-200031-5 , p. 2008.
- ↑ Office d'État de Basse-Saxe pour la protection des consommateurs et la sécurité alimentaire : Un poisson voit rouge - traitement, stockage et transport du poisson frais
- ↑ Service de la santé du canton de Bâle-Ville : Coloration illégale de la chair de thon. Dans : gd.bs.ch . 28 mai 2019. Récupéré le 28 mai 2019 .
- ↑ Ludwig Bergmann, Clemens Schaefer : Manuel de physique expérimentale, volume 6. Solide. Gruyter, 2005, ISBN 3-11-017485-5 , p. 335-336.
- ↑ K. Veera Reddy : Symétrie et Spectroscopie des Molécules. New Age Science Ltd., 2005, ISBN 81-224-1142-8 , page 381.
- ^ Ordonnance sur la garde des animaux à fourrure . § 6 Meurtre . (N'est plus disponible en ligne.) 29 septembre 1998, archivé de l' original le 8 juillet 2012 ; Consulté le 29 août 2014 .
- ^ Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch : Charbon, pétrole, gaz naturel : chimie et technologie. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , page 152.
- ^ Matthias Felsch : Aktion T4, La première phase de l'euthanasie dans le national-socialisme , Munich 2003.
- ↑ Barbara Schwindt : Le camp de concentration et d'extermination de Majdanek : changement fonctionnel dans le contexte de la « solution finale » , Verlag Königshausen et Neumann, 2005, p.161 s.
- ↑ JA Raub, M. Mathieu-Nolf, N.-B. Hampson, SR Thom : L' intoxication au monoxyde de carbone - une perspective de santé publique . Dans : Toxicologie . ruban 145 , non. 1 , avril 2000, p. 1–14 , doi : 10.1016 / S0300-483X (99) 00217-6 , PMID 10771127 .
- ^ Maria E. Stefanidou, Constantine P. Maravelias, Artemis A. Dona, Constantine M. Pistos, Chara A. Spiliopoulou, Sotirios A. Athanaselis : Décès liés au monoxyde de carbone en Grèce. Dans : The American Journal of Forensic Medicine and Pathology. Volume 33, 2012, pp. 128-131, doi : 10.1097 / PAF.0b013e318252eca9 .
- ^ A b Nathaniel Cobb : Décès non intentionnels liés au monoxyde de carbone aux États-Unis, de 1979 à 1988. Dans : JAMA : Le Journal de l'Association médicale américaine. Volume 266, 1991, page 659, doi : 10.1001 / jama.1991.03470050059023 .
- ↑ Jorge A. Guzman : Empoisonnement au monoxyde de carbone. Dans : Cliniques de soins intensifs. Volume 28, 2012, pp. 537-548, doi : 10.1016 / j.ccc.2012.07.007 .
- ↑ Les intoxications au monoxyde de carbone à l'intérieur sont en augmentation. Institut fédéral d'évaluation des risques, 3 février 2010, consulté le 9 août 2014 .
- ↑ du monoxyde de carbone. Consulté le 29 août 2014 .
- ↑ Markus Fritz : Coupez et nettoyez. 100 × environnement. Bibliographisches Institut AG, Mannheim 1977, ISBN 3-411-01706-6 , page 18.
- ↑ a b c Ingo Wirth, Hansjörg Strauch : Médecine légale : Connaissances de base pour la pratique de l'investigation. Verlag Kriminalistik, 2012, ISBN 978-3-7832-0021-8 , p. 196-198.
- ^ GS Lipman : Toxicité du monoxyde de carbone à haute altitude . Dans : Wilderness & Environmental Medicine . ruban 17 , non. 2 , 2006, p. 144-145 , PMID 16805152 .
- ↑ Critères de santé environnementale (EHC) pour le monoxyde de carbone , consulté le 29 novembre 2014.
- ↑ JP Collman, JI Brauman, TR Halbert, KS Suslick : Nature de la liaison O 2 et CO aux métalloporphyrines et aux protéines hémiques. Dans : Actes de l'Académie nationale des sciences (PNAS). Volume 73, n° 10, octobre 1976, pp. 3333-3337, PMC 431107 (texte intégral gratuit).
- ↑ Klaus Ellinger, Harald Genzwürker (Ed.): Livre de cours médecine d'urgence. Orienté sur le programme d'études à l'échelle nationale désignation supplémentaire médecine d'urgence. Deutscher Ärzte-Verlag, 2011, ISBN 978-3-7691-0613-8 , page 620.
- ↑ Hu & Speizer : Risques environnementaux et professionnels. Monoxyde de carbone. Dans : Principes de médecine interne de Harrison. 14e édition. McGraw-Hill, New York, page 2533.
- ↑ Liste des limites d'exposition professionnelle et des valeurs à court terme. BG Bau, janvier 2006, consulté le 17 août 2014 .
- ↑ CR Henry, D. Satran, B. Lindgren, C. Adkinson, CI Nicholson, TD Henry : Lésion myocardique et mortalité à long terme suite à une intoxication modérée à sévère au monoxyde de carbone . Dans : JAMA . ruban 295 , non. 4 , janvier 2006, p. 398-402 , doi : 10.1001 / jama.295.4.398 , PMID 16434630 .
- ^ Ligne directrice S1 sous l'influence du monoxyde de carbone (monoxyde de carbone) de la Société allemande de médecine du travail et de médecine environnementale. Dans : AWMF en ligne (à partir de 2011)
- ↑ M. Coulange, A. Barthelemy, F. Hug, AL Thierry, L. De Haro : Fiabilité du nouveau CO-oxymètre de pouls chez les victimes d'intoxication au monoxyde de carbone. Dans : Undersea Hyperb Med. Volume 35, n° 2, mars-avril 2008, pp. 107-111, PMID 18500075 .
- ^ AA Cevik et al.: Interrelation entre le PSS, les niveaux de CO-Hb et l'évolution clinique de l'empoisonnement au CO à l'hôpital. Dans : The International Journal of Clinical Practice. Volume 60, n° 12, 2006, pp. 1558-1564, PMID 16918999 .
- ↑ Weaver et al. : Intoxication au monoxyde de carbone : facteurs de risque de séquelles cognitives et rôle de l'oxygène hyperbare. Dans : American Journal of Respiratory and Critical Care Medicine. Volume 176, n° 5, 2007, pp. 491-497, PMID 17496229 .
- ↑ Weaver et al. Oxygène hyperbare pour les intoxications aiguës au monoxyde de carbone. Dans : The New England Journal of Medicine . Volume 347, n° 14, octobre 2002, pp. 1057-1067, PMID 12362006 .
- ↑ Conseils aux fumeurs en pharmacie - Programme national d'arrêt du tabac Berne, 2008 ... 16 octobre 2014, consulté le 30 mars 2017. - HWZ : 3–6 heures, sommeil 4–8 heures.
- ↑ Daunderer : Toxicologie clinique - Gaz : Monoxyde de carbone HI-4.3 33. Erg-Lfg. 1/88 (1988), consulté le 30 mars 2017.
- ↑ a b Cathérine Simone Gebhard : Investigations sur la régulation de la stimulation liée au monoxyde de carbone de la sécrétion d'érythropoïétine chez le rat . Tübingen 2007, DNB 983723877 , urn : nbn: de: bsz: 21-opus-27538 (thèse).
- ↑ du monoxyde de carbone. Dans : Lexique de neurologie. Consulté le 29 août 2014 .
- ↑ P. Weydt : Signaux calciques médiés par les récepteurs dans des cellules de gliome humain en culture. Tectum Verlag , 2000, ISBN 3-8288-8137-8 , page 14.
- ^ RF Schmidt, F. Lang : Physiologie des humains. Apprentissage et mémoire. Springer-Verlag , ISBN 978-3-540-32908-4 , page 225.
- ^ PA Berg : Syndrome de fatigue chronique et de fibromyalgie. Springer-Verlag, 2003, ISBN 3-540-44194-8 , page 37.
- ↑ Le "bon" du monoxyde de carbone - Immunologie : effet anti-inflammatoire au niveau de l'intestin. 24 décembre 2005, consulté le 29 août 2014 .
- ^ Refaat AF Hegazi, Kavitha N. Rao, Aqila Mayle, Antonia R. Sepulveda, Leo E. Otterbein, Scott E. Plevy : Le monoxyde de carbone améliore la colite murine chronique par une voie dépendante de l'hème oxygénase 1. Dans : Journal de médecine expérimentale. Volume 202, 2005, pp. 1703-1713, doi : 10.1084 / jem.20051047 .
- ↑ Atsunori Nakao, Gaetano Faleo, Hiroko Shimizu, Kiichi Nakahira, Junichi Kohmoto, Ryujiro Sugimoto, Augustine MK Choi, Kenneth R. McCurry, Toru Takahashi, Noriko Murase : le monoxyde de carbone ex vivo empêche la dégradation du cytochrome P450 et l'ischémie // lésion de reperfusion du rein greffes . Dans : Kidney International . ruban 74 , 2008, p. 1009-1016 , PMID 11035334 .
- ↑ Atsunori Nakao, Augustine MK Choi, Noriko Murase : Effet protecteur du monoxyde de carbone en transplantation . Dans : Journal de médecine cellulaire et moléculaire . ruban 10 , non. 3 , 1 juin 2006, p. 650-671 , doi : 10.1111 / j.1582-4934.2006.tb00426.x , PMID 16989726 .
- ↑ M. Baum : Mesures de monoxyde de carbone en fin d'expiration chez les femmes souffrant d'hypertension induite par la grossesse et de prééclampsie . Dans : American Journal of Obstetrics and Gynecology . ruban 183 , non. 4 , octobre 2000, p. 900-903 , doi : 10.1067 / mob.2000.109047 , PMID 11035334 .
- ^ S. Bainbridge, E. Sidle, G. Smith : Les effets placentaires directs de la fumée de cigarette protègent les femmes de la pré-éclampsie : les rôles spécifiques du monoxyde de carbone et des systèmes antioxydants dans le placenta . Dans : Hypothèses médicales . ruban 64 , non. 1 , 2005, p. 17-27 , doi : 10.1016 / j.mehy.2004.06.019 , PMID 15533604 .
- ↑ Roberta Foresti, Mohamed G. Bani-Hani, Roberto Motterlini : Utilisation du monoxyde de carbone comme agent thérapeutique : promesses et enjeux . Dans : Médecine de soins intensifs . ruban 34 , non. 4 , avril 2008, p. 649-658 , doi : 10.1007/s00134-008-1011-1 , PMID 18286265 .
- ^ Y. Liu, WB Whitman : Diversité métabolique, phylogénétique et écologique des archées méthanogènes. Dans : Annales de l'Académie des sciences de New York. Volume 1125, mars 2008, pp. 171-189, doi : 10.1196 / annals.1419.019 . PMID 18378594 . (Revoir).
- ↑ E. Oelgeschläger, M. Rother : Métabolisme énergétique dépendant du monoxyde de carbone chez les bactéries anaérobies et les archées. Dans : Archives de microbiologie. Volume 190, n° 3, septembre 2008, pp. 257-269, doi : 10.1007 / s00203-008-0382-6 . PMID 18575848 . (Revoir).
- ^ W. Martin, MJ Russell : Sur l'origine de la biochimie à un évent hydrothermal alcalin. In : Transactions philosophiques de la Royal Society of London. Série B, Sciences biologiques. Volume 362, n° 1486, octobre 2007, pp. 1887-1925, doi : 10.1098/rstb.2006.1881 . PMID 17255002 . PMC 2442388 (texte intégral gratuit). (Revoir).
- ↑ a b Lothar Gremer, Vitali Svetlitchnyi, Ortwin Meyer : Vivre avec le monoxyde de carbone : catalyse biologique de centres de métaux mixtes inhabituels. Dans BioSpektrum numéro 5, 2001, 7e année. PDF (texte intégral gratuit).
- ↑ Georg Fuchs (Ed.) : Microbiologie générale. Fondé par Hans Günter Schlegel , 8e édition. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1 , page 344.
- ↑ Carboxidobacteria. Dans : Lexique compact de biologie . Spektrum.de, consulté le 27 septembre 2014 .
- ↑ Steven Heylen, Johan A. Martens : Avancées vers une détection simple du monoxyde de carbone chromogène. Dans : Angewandte Chemie. Volume 122, 2010, pp. 7794-7795, doi : 10.1002 / anie.201002569 .
- ↑ a b c Jürgen Fessmann, Helmut Orth : Chimie appliquée et technologie environnementale pour les ingénieurs : manuel d'étude et de pratique opérationnelle. Verlag ecomed, 2002, ISBN 3-609-68352-X , pp. 177-178.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , page 488.















































