Radical (chimie)
En chimie, les radicaux sont des atomes ou des molécules avec au moins un électron de valence non apparié . La plupart des radicaux sont particulièrement réactifs. Les radicaux sont représentés par un « point », qui symbolise l'électron non apparié, par exemple le monoxyde d'azote (NO • ). Un composé avec deux électrons non appariés s'appelle un diradical (également biradical ), avec trois électrons non appariés on parle de triradical , etc. Les radicaux jouent un rôle important dans certains processus d'oxydation , dans les polymérisations en chaîne et dans certaines réactions de substitution .
nomenclature
Dans la nomenclature, les radicaux sont nommés avec la terminaison -yl, pour les biradicaux -ylidène est utilisé. Les exceptions sont les diradicaux méthylène , silylène et aminylène . Des exemples sont -oxyle pour les composés avec un oxygène radicalaire (par exemple 2,2,6,6-tétraméthylpipéridinyloxyle ) ou des radicaux thiyle avec un atome de soufre radicalaire.
Émergence
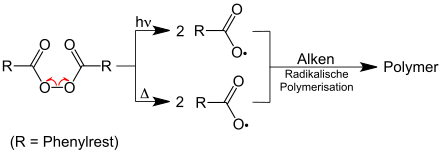
Les radicaux sont formés par :
- Chaleur ( clivage de la liaison thermolytique )
- Rayonnement UV , qui provoque le clivage homolytique d' une liaison covalente ( photolyse )
- Rayons X et autres rayonnements ionisants
- Électrochimiquement par oxydation ou réduction
Pour initier des réactions radicalaires en synthèse chimique , des initiateurs dits radicaux sont souvent ajoutés au mélange réactionnel . Les starters de radicaux libres sont des molécules qui peuvent être divisées en radicaux particulièrement facilement - par exemple par exposition à la lumière ultraviolette. Des exemples d'initiateurs de radicaux libres comprennent azobis (isobutyronitrile) , le peroxyde de dibenzoyle , le peroxyde de dilauroyle , di- tert peroxyde butyle , le peroxydicarbonate de diisopropyle et le peroxodisulfate de potassium .
Réactivité
Radicaux réactifs
Comme la plupart des radicaux réagissent exergoniquement , ils sont très réactifs et donc de courte durée (<1 seconde). L'électron non apparié est généralement situé sur les atomes C , N , O et Hg ou les halogènes .
Radicaux non réactifs
On connaît également des radicaux qui ne réagissent pas immédiatement et existent même parfois sous forme de substances isolables sur une certaine période de temps. Un exemple de ces « radicaux stables » est le radical triphénylméthyle . Comme d'autres radicaux non réactifs, il est en équilibre avec son dimère (le soi-disant dimère de Gomberg) en solution. Le dimère du radical triphénylméthyle est le 3-diphénylméthylène-6-triphénylméthyl-cyclohexa-1,4-diène montré sur la figure (et non l' hexaphényléthane , comme son découvreur Moses Gomberg l'a supposé). Les facteurs qui conduisent à des radicaux stables sont, d'une part, une stabilisation par résonance du radical et, d'autre part, une obstruction de la dimérisation , par exemple par des substituants stériquement exigeants . Des radicaux stables sont également présents dans la nature. Par exemple, l'enzyme ribonucléotide réductase (RNR) contient un radical tyrosyle avec une demi-vie de 4 jours.
Radicaux carbonés
Les radicaux C-centrés montrent une stabilité croissante dans la série : atome C primaire < atome C secondaire < atome C tertiaire, ce qui est dû aux effets inductifs et à l' hyperconjugaison . De plus, les radicaux carbonés hybrides sp³ sont plus stables que les centres radicalaires dans lesquels le carbone présente une hybridation sp² ou sp . Les groupes aryle ou allyle stabilisent également le radical.
Exemples connus
- Oxygène O 2 - cette molécule d'oxygène contient deux électrons non appariés (biradical • OO • ; la formule de Lewis O = O ne reflète pas complètement et correctement la situation de liaison) et est représentée comme un triplet paramagnétique dans le champ magnétique. Cependant, la réactivité de ce biradical est limitée, puisque le principe de la préservation du spin dans les réactions chimiques nécessite dans la plupart des cas d'abord une excitation à l'oxygène singulet.
- Oxyde nitrique • NO - un radical reconnu comme une substance messagère . L'oxyde nitrique est un composant des gaz nitreux .
- Radical hydroxyle • OH - le radical le plus réactif et le plus important dans l' atmosphère (important pour décomposer les polluants atmosphériques )
- Les radicaux chlorés Cl • - résultent du clivage homolytique de la liaison chlore-chlore du chlore moléculaire (Cl 2 ) et sont des intermédiaires réactifs dans la photochloration des alcanes et dans la chloration des chaînes latérales ( règle SSS ) des aromatiques alkyl-substitués. Ils sont également libérés des chlorofluorocarbures sous l'action de la lumière et peuvent être impliqués dans l'endommagement (appauvrissement) de la couche d'ozone .
- Les radicaux brome Br • - proviennent du clivage homolytique de la liaison brome-brome du brome moléculaire (Br 2 ) et sont des intermédiaires réactifs dans la photobromination des alcanes et dans la bromation des chaînes latérales (règle SSS) des aromatiques alkyl-substitués
- TEMPO - un radical organique stable qui est utilisé, entre autres, comme agent oxydant
Détection radicale
Les radicaux peuvent être détectés directement ou indirectement :
- Si une molécule a des électrons non appariés, le spin des électrons dans un champ magnétique peut adopter deux orientations différentes. Ceci peut être démontré par la spectroscopie par résonance de spin électronique (ESR) .
- Comme la plupart des radicaux sont très réactifs, ils peuvent être caractérisés par le produit créé avec un capteur de radicaux :
- Les réactifs spin-trap tels que tert -Bu-N = O peuvent être utilisés pour les radicaux à très courte durée de vie . Après l'ajout du radical, le nitroxyde persistant est formé, qui peut être examiné au moyen de la spectroscopie ESR.
- La dimérisation de deux radicaux crée une molécule stable qui peut être isolée et caractérisée. Exemple : Deux radicaux méthyle (• CH 3 ) se dimérisent en éthane (H 3 C – CH 3 ).
Radicaux en biologie
Les radicaux, tels que les espèces réactives de l'oxygène (ROS), jouent un rôle important dans un grand nombre de processus biologiques, mais peuvent également endommager les cellules, ce qui, entre autres , peut contribuer au développement du cancer . L' oxydation de diverses substances médiée par les radicaux libres se voit également attribuer un rôle important dans le développement de l' artériosclérose , de la maladie d'Alzheimer , des lésions hépatiques dues à l'alcool et de l'emphysème pulmonaire dû à la fumée de tabac . Parmi les voies de signalisation intracellulaires activées par les radicaux libres, la voie de signalisation NF-κB est l'une des plus importantes.
La protection contre les effets des radicaux est essentielle ; le corps dispose donc de mécanismes efficaces de défense et de réparation sous forme d'enzymes, d'hormones ou d'autres classes de substances qui minimisent les effets nocifs. Des antioxydants comme l' épigallocatéchine gallate , la superoxyde dismutase , la glutathion peroxydase , la vitamine A , la vitamine C , la vitamine E , la coenzyme Q10 , des flavonoïdes comme la taxifoline et les anthocyanes sont impliqués dans ces mécanismes de défense . De plus, la bilirubine et l'acide urique devraient être capables de neutraliser certains radicaux libres. L'hormone mélatonine est également considérée comme un capteur de radicaux contre le stress oxydatif . Le plus fort connu antioxydant , l'ion H hydrure - , joue un rôle important dans le cycle de l' acide citrique et dans de nombreuses réactions d'oxydo - réduction du métabolisme .
Les radicaux jouent un rôle dans le cadre des théories dites « d'usure » des processus de vieillissement dans le corps, de sorte que les substances actives contre le stress oxydatif sont discutées comme agents contre le vieillissement (→ théorie des radicaux libres ). On sait que les cellules des oiseaux résistent bien mieux aux radicaux libres. Cependant, comme seule l'influence des antioxydants synthétiques a été étudiée, aucune conclusion ne doit être tirée sur les effets possibles des fruits et légumes. En 2007, un éditorial du JAMA a demandé d'autres études randomisées pour établir les effets de la vitamine C et du sélénium . Une très grande méta-analyse de la Cochrane Collaboration (2007-2012), qui a été mise à jour plusieurs fois depuis lors , n'a finalement trouvé aucun effet positif des compléments alimentaires contenant des vitamines ; au contraire, la mortalité dans le groupe verum a même légèrement augmenté.
Signification historique
Lorsque la théorie prévalait au début du 19ème siècle que toute matière est constituée d'atomes (voir John Dalton ), le terme radical a été utilisé par d'éminents chimistes tels que Lavoisier et Wöhler pour désigner des molécules polyatomiques qui sont impliquées dans des réactions chimiques telles que Les atomes individuels se sont comportés. Auguste Laurent a d'abord utilisé le terme radical pour désigner les atomes et les groupes d'atomes en théorie nucléaire (chimie) . Par exemple, l' ion cyanate , qui est composé de trois atomes, se comporte souvent comme un ion chlorure . De même, un ion ammonium , qui se compose de cinq atomes, se comporte souvent comme l'ion d'un métal alcalin . C'est pourquoi les ions cyanate et ammonium , entre autres, étaient appelés radicaux. Voir aussi : théorie radicale .
Littérature
- Christoph Rüchardt : Radicaux. Une théorie chimique dans une perspective historique. Dans : Rapports de réunion de l'Académie des sciences de Heidelberg, classe de mathématiques et de sciences naturelles. 1992, pp. 319-345 ( texte intégral ).
- Ivo E. Dreosti (éd.) : Oligo-éléments, micronutriments et radicaux libres. Humana Press, Totowa (New Jersey) 1991, ISBN 0-89603-188-8 .
liens web
- Hydrocarbures acycliques (radicaux mono-, di- et trivalents) ( Memento du 12 janvier 2012 dans Internet Archive )
Preuve individuelle
- ↑ Dieter Hellwinkel : La nomenclature systématique de la chimie organique. Un manuel d'instructions . 4e édition. Springer, Berlin 1998, ISBN 978-3-540-63221-4 , p. 92. (1ère édition 1974)
- ^ MD Lechner, K. Gehrke, EH Nordmeier : Makromolekulare Chemie . 4e édition, Birkhäuser Verlag, ISBN 978-3-7643-8890-4 , page 54. 6e édition 2020.
- ^ Siegfried Hauptmann : Chimie organique . 2e édition, VEB Deutscher Verlag für Grundstoffindindustrie , Leipzig 1985, ISBN 3-342-00280-8 , p. 281.
- ↑ Ulrich Lüning : Réactions organiques - Introduction aux voies et mécanismes réactionnels . 2e édition. Spektrum, Munich 2007, ISBN 978-3-8274-1834-0 , p. 21 .
- ↑ Yu. A. Vladimirov, EV Proskurnina, EM Demin, NS Matveeva, OB Lubitskiy, AA Novikov, D. Yu. Izmailov, AN Osipov, VP Tikhonov, VE Kagan : Dihydroquercétine (taxifolin) et autres flavonoïdes en tant qu'inhibiteurs de la formation de radicaux libres aux étapes clés de l'apoptose . Dans : Biochimie (Moscou) . ruban 74 , non. 3 , 2009, p. 301-307 , doi : 10.1134 / S0006297909030092 , PMID 19364325 .
- ↑ Goran Bjelakovic, Dimitrinka Nikolova, Lise Lotte Gluud, Rosa G. Simonetti, Christian Gluud : Mortalité dans les essais randomisés de suppléments antioxydants pour la prévention primaire et secondaire . Dans : JAMA : Le Journal de l'Association Médicale Américaine . ruban 297 , non. 8 , 28 janvier 2007, p. 842-857 , doi : 10.1001 / jama.297.8.842 .
- ↑ G. Bjelakovic, D. Nikolova, LL Gluud, RG Simonetti, C. Gluud : Suppléments antioxydants pour la prévention de la mortalité chez les participants en bonne santé et les patients atteints de diverses maladies. Dans : Base de données Cochrane des revues systématiques (en ligne). Volume 3, 2012, S. CD007176, doi: 10.1002 / 14651858.CD007176.pub2 , PMID 22419320 (article de revue).
- ^ John Buckingham : À la poursuite de la molécule . Sutton, Stroud 2004, ISBN 0-7509-3345-3 .