Cinétique (chimie)

La cinétique est une partie de la chimie physique , qui en macrocinétique est divisée et en cinétique moléculaire. La cinétique moléculaire traite du calendrier des réactions chimiques au niveau moléculaire et comprend la microcinétique, qui traite de la cinétique des réactions élémentaires . La macrocinétique considère l'influence des processus macroscopiques de transport de chaleur et de matière sur la cinétique des réactions chimiques et représente ainsi le lien entre cinétique de réaction et génie des réactions chimiques.Cet article traite de la cinétique moléculaire des réactions chimiques. La cinétique des processus électrochimiques est traitée dans l'article cinétique électrochimique .
Vitesse de réaction
définition

La taille de base de la cinétique de la vitesse de réaction (en anglais rate of reaction ) avec la dimension mole par temps et volume . L' unité de la vitesse de réaction dérivé à partir des quantités de base de la système international d'unités est en moles par mètre cube et seconde . La vitesse de réaction indique la variation de la variable de conversion (quantité de réaction événements, qui sont définis par la réaction équation de la réaction considérée, en mole) par unité de temps et de volume dans des conditions isochores. Si le nombre stoechiométrique et la quantité du nombre stoechiométrique d'une substance impliquée dans la réaction considérée sont i , alors pour une réaction
la vitesse de réaction r est égale à :
Ici, t est le temps de réaction, V est le volume de réaction et [A], [B], [K] et [L] sont les concentrations de substances liées au volume des substances A, B, K et L impliquées dans la réaction. Le quotient différentiel est égal à la pente du profil concentration-temps sous-jacent [A] ( t ), qui représente [A] en fonction de t . Puisque A est consommé comme matière première, le changement différentiel de concentration d [A] et donc le quotient différentiel sont négatifs. Etant donné que le nombre stoechiométrique d'un matériau de départ a également un signe négatif selon la convention, l'expression et donc la vitesse de réaction sont positives.
Lois de la vitesse et lois du temps
Lois de la vitesse
La dépendance de la vitesse de réaction sur les concentrations réelles des réactifs dans une réaction est décrite empiriquement par les lois de vitesse. Les lois de vitesse contiennent généralement une constante de vitesse k ou une demi-vie t 1/2 , qui représentent la cinétique du processus chimique considéré d'une manière caractéristique. La demi-vie indique la période pendant laquelle la concentration initiale [A] 0 d' un réactif A tombe à la moitié de la valeur.
Les réactions brutes phénoménologiquement observables peuvent avoir des mécanismes réactionnels complexes qui comprennent des séquences de plusieurs réactions élémentaires réversibles. Des exemples en sont les réactions qui suivent le mécanisme de Lindemann , les réactions en chaîne ou les réactions catalysées par des enzymes qui peuvent être décrites par la théorie de Michaelis-Menten . De plus, la vitesse de réaction observable peut être influencée par des réactions compétitives. Étant donné que les lois de vitesse décrivent donc principalement des événements de réaction complexes, on ne peut pas en tirer directement de conclusions sur le mécanisme de réaction. Souvent, les lois de vitesse sont formulées sur la base de modèles de réaction simplifiés. Par exemple, la cinétique de réactions composites comprenant plusieurs réactions élémentaires consécutives peut être dominée par une réaction élémentaire particulièrement lente en tant qu'étape déterminante de la vitesse. Dans ce cas, la cinétique de la réaction composite est souvent représentée de manière satisfaisante par la cinétique plus simple de la réaction élémentaire particulièrement lente. Si des intermédiaires réactifs se produisent au cours des réactions, le principe quasi-stationnaire de Bodenstein peut être appliqué.
Lois du temps
Les lois du temps ou les équations de vitesse indiquent la variable de conversion d'une réaction ou la concentration d'une substance impliquée dans une réaction en fonction du temps de réaction. Dans certains cas, les lois temporelles des réactions chimiques peuvent être déterminées à partir des lois de vitesse respectives en séparant et en intégrant des variables. Inversement, les lois de la vitesse sont les premières dérivées des lois correspondantes du temps. Les demi-vies peuvent être déterminées directement à partir des lois du temps.
Dépendance de la température de la vitesse de réaction
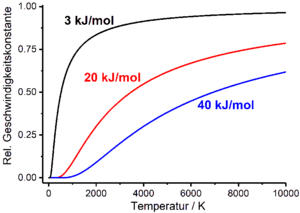
Les vitesses de réaction dépendent essentiellement des variables d'état qui caractérisent le système réactif, telles que la température T , la pression et le volume. Cette dépendance se retrouve dans les lois de vitesse des processus chimiques via la constante de vitesse ou la demi-vie, qui à son tour sont fonction de la température, de la pression et du volume. En pratique, la dépendance à la température de la vitesse de réaction est particulièrement importante. Ceci est décrit empiriquement par l' équation d'Arrhenius , qui relie la constante de vitesse à la température. L'équation d'Arrhenius est une fonction exponentielle qui contient un facteur pré-exponentiel A avec la dimension de la constante de vitesse et l' énergie d'activation molaire E A dans l'exposant comme paramètres empiriques ( R est la constante générale des gaz ):
Si l'on suppose approximativement que le facteur pré-exponentiel de l'équation d'Arrhenius et l'énergie d'activation sont indépendants de la température, la constante de vitesse tend vers zéro lorsque la température tend vers zéro, et vers le facteur pré-exponentiel lorsque la température tend vers l'infini . Le facteur pré-exponentiel représente donc la valeur maximale que peut prendre la constante de vitesse.
De même, l'équation d'Arrhenius peut également être utilisée pour montrer comment les demi-vies dépendent de la température. L'équation d'Arrhenius a alors un exposant de signe positif :
Le facteur pré-exponentiel A', comme la demi-vie, a la dimension du temps. La demi-vie approche l'infini lorsque la température approche de zéro, et contre le facteur pré-exponentiel lorsque la température approche l'infini. Le facteur pré-exponentiel représente donc la valeur minimale que peut prendre la demi-vie.
États de transition et énergies d'activation
États de transition
Au cours d'un événement réactionnel élémentaire, le système réactif parcourt une trajectoire sur une hypersurface potentielle, qui se caractérise par des changements structurels successifs tels que des changements d'angles de liaison et de longueurs de liaison. Selon la théorie de l'état de transition , une paroi de potentiel séparant les matériaux de départ et les produits (barrière d'activation) est surmontée, ce qui représente un point-selle sur l'hypersurface potentielle. Les états que traverse le système réactif au cours de la réaction élémentaire considérée sont décrits de la manière la plus appropriée par le potentiel thermodynamique applicable respectif , qui décrit les changements d' entropie dans l'univers causés par les changements dans le système réactif . Si la pression et la température sont maintenues constantes, il s'agit de l' enthalpie libre . Le point de selle est l'emplacement de l'enthalpie libre la plus élevée que le système réactif traverse au cours d'un événement de réaction élémentaire. L'état que prend le système réactif lorsqu'il passe par le point de selle est appelé état de transition . L'enthalpie libre molaire d'activation représente le niveau de la barrière potentielle à surmonter pour la conversion des matières premières en produits, c'est-à-dire la différence entre les enthalpies libres de l'état de transition et l'état initial avant le début de l'événement réactionnel élémentaire . La taille de la constante de vitesse , qui représente la cinétique de transformation des matières premières en produits, dépend de (voir section « Formulation thermodynamique » dans l'article « Théorie de l'état de transition ») :
En conséquence, ce qui suit s'applique à la dépendance de la constante de vitesse de la réaction inverse sur son enthalpie d'activation libre :
Enthalpies libres d'activation et équilibre thermodynamique

De nombreuses réactions sont des réactions d' équilibre dans lesquelles, en plus de la formation de produits de réaction par la réaction directe, la réaction inverse crée également de nouveaux produits de départ à partir des produits de réaction :
A condition que la réaction directe avec l'enthalpie molaire libre d'activation et l'enthalpie molaire libre de réaction
et la réaction inverse avec l'enthalpie libre d'activation
courir exactement le long de la même trajectoire de réaction dans des directions opposées, ce qui suit s'applique à l'enthalpie d'activation libre molaire de la réaction directe :
La constante de vitesse de la réaction directe est alors :
Pour le rapport de k vers et k rueck suit :
La simplification se traduit par :
Ainsi:
Ici, K est la constante d'équilibre thermodynamique de la réaction considérée. Les constantes de vitesse k pour la réaction directe et k retour pour la réaction inverse sont ainsi couplées l'une à l'autre - le rapport est déterminé par la constante d'équilibre thermodynamique. Cette relation est souvent mal interprétée à l'effet que la constante d'équilibre d'une réaction d'équilibre dépend des constantes de vitesse des réactions de va-et-vient. Cependant, cette idée est basée sur un pré-concept incorrect . Les grandeurs thermodynamiques, qui, comme l'enthalpie libre de réaction et la constante d'équilibre, décrivent les changements d'état, dépendent exclusivement de l'état initial et final, mais pas du chemin parcouru par le système de l'état initial à l'état final.
Énergies d'activation
L'existence de barrières potentielles, qui doivent être surmontées au cours d'une réaction brute phénoménologiquement observable lors de la conversion des matières premières en produits, est représentée empiriquement par l'équation d'Arrhenius. Contrairement à l'équation d'Eyring issue de la théorie de l'état de transition, l'équation d'Arrhenius ne prend en compte ni le nombre ni la nature des états de transition à traverser par le système réactif, mais représente les barrières potentielles à surmonter par le énergie d'activation des paramètres phénoménologiques. Si l'énergie d'activation approche l'infini à température constante, la constante de vitesse converge vers zéro selon l'équation d'Arrhenius. L'énergie d'activation est égale à zéro, la constante de vitesse égale au facteur pré-exponentiel A . De même, l'équation d'Arrhenius peut également être utilisée pour montrer comment les demi-vies dépendent de l'énergie d'activation. Si l'énergie d'activation tend vers l'infini à température constante, la demi-vie tend également vers l'infini. Si l'énergie d'activation est nulle, la demi-vie devient égale au facteur pré-exponentiel A ' .
En général, à température constante, la vitesse de réaction augmente si l'énergie d'activation est réduite. Dans la catalyse des réactions chimiques, des trajectoires de réaction alternatives sont proposées qui conduisent à une réduction de l'énergie d'activation. Cela permet d'atteindre des vitesses de réaction plus élevées sans avoir à augmenter la température de réaction à cet effet.
Si des profils concentration-temps sont déterminés pour une réaction à plusieurs températures et que les constantes de vitesse respectives k ( T ) sont déterminées expérimentalement à partir de celles - ci , l'énergie d'activation peut également être déterminée. Prendre le logarithme convertit l'équation d'Arrhenius en une équation en ligne droite :
Le graphique du logarithme népérien ln k ( T ) de la constante de vitesse k ( T ) déterminée expérimentalement donne une droite dont la pente correspond à l'énergie d'activation négative. L'intersection de la droite avec l'axe des y est le logarithme ln A du facteur pré-exponentiel de l'équation d'Arrhenius.
Réactions de zéro à troisième ordre
Dans de nombreux cas, la vitesse des réactions chimiques impliquant les matières premières est proportionnelle aux produits des fonctions puissances des concentrations des matières premières :
Où est la constante de vitesse. Les exposants sont les ordres partiels de réaction par rapport aux matières premières . La somme est l'ordre global de la réaction en question. Les ordres de réaction partiels peuvent, mais ne doivent pas nécessairement, avoir les mêmes quantités que les nombres stoechiométriques des matériaux de départ en question dans une réaction. Les nombres stoechiométriques des matières premières apparaissant dans les équations de réaction brutes représentent souvent la stoechiométrie totale des réactions composites qui comprennent plusieurs réactions élémentaires. Les ordres de réaction partiels et donc les ordres de réaction globaux résultent souvent, comme dans le cas des substitutions nucléophiles et des éliminations du premier ordre, de réactions élémentaires cinétiques dont la stoechiométrie diffère de la stoechiométrie de la réaction globale considérée. Si une réaction grossière , telle que les réactions radicalaires en chaîne , comprend des réactions élémentaires superposées ou couplées sans réaction élémentaire lente et donc limitante, les ordres partiels de réaction peuvent également différer des nombres stoechiométriques des composants concernés. Des ordres de réaction interrompus se produisent également dans de tels cas.
Les lois du temps résultant des réactions avec un premier ordre de réaction global ou plus peuvent être converties en équations linéaires par transformations (voir tableau ci-dessous ; pour les réactions d'ordre zéro, les profils concentration-temps sont toujours linéaires). Les lois du temps présentées sous cette forme peuvent être comparées aux concentrations [A] ( t ) d'un réactif A mesurées après différents temps de réaction pour la détermination expérimentale de l'ordre global de la réaction . La valeur de la pente de la droite ainsi obtenue correspond au produit du nombre stoechiométrique du matériau de départ et de la constante de vitesse .
Aperçu
Les lois du temps, les tracés linéarisés des lois du temps pour déterminer la constante de vitesse et les expressions des signes de demi-valeur sont résumés pour des réactions avec des lois de vitesse du type du tableau suivant, en tenant compte du nombre stoechiométrique du matériau de départ . Il convient de noter qu'il a un signe négatif. Les unités des constantes de vitesse sont valables pour toutes les réactions avec l'ordre de réaction global n .
| 0e ordre | 1ère commande | 2ème commande | n . ordre | |
|---|---|---|---|---|
| Loi sur la vitesse | ||||
| Loi du temps |
[ ] |
|||
| Unité k | ||||
| Diagramme linéaire de la loi du temps | [A] contre t | contre t | contre t |
contre t
[ ] |
| Demi-vie |
[ ] |
Réactions d'ordre zéro
La vitesse des réactions d'ordre zéro est indépendante des concentrations des réactifs. Cela signifie que la vitesse de réaction est constante. Les lois du temps prennent donc la forme d'une droite à pente négative (pour les variables de conversion et les réactifs) ou à pente positive (pour les produits). La pente de la droite correspond à la valeur de la constante de vitesse k . Des exemples de réactions d'ordre zéro sont certaines réactions photochimiques et catalytiques . Par exemple, l'oxydation biologique de l' éthanol en acétaldéhyde par certaines alcools déshydrogénases est d' ordre zéro par rapport à l'éthanol. Un autre exemple est la polymérisation en émulsion , dans laquelle, après la phase d'initiation, la réaction est nulle
Réactions de premier ordre
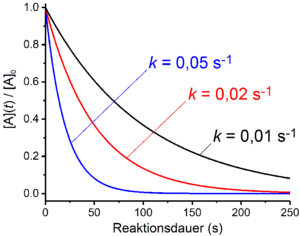
Dans le cas des réactions du premier ordre, la vitesse de la réaction dépend linéairement de la concentration d'un réactif A. C'est le cas lorsque le procédé global ne comprend qu'une seule réaction de délitement unimoléculaire. Un exemple de ceci est la désintégration radioactive . De plus, les réactions qui comprennent plusieurs réactions élémentaires sont du premier ordre si l'étape déterminante est un processus de désintégration ou de dissociation . Des exemples en sont le mécanisme S N 1 de substitution nucléophile ou le mécanisme E1 dans les réactions d' élimination . La loi de vitesse prend la forme suivante pour une réaction du premier ordre :
La loi du temps du premier ordre est obtenue en séparant d'abord les variables :
L'étape suivante consiste à calculer les intégrales définies :
Vous obtenez d'abord :
La formation donne :
La délogarithmisation donne la loi du temps pour les réactions du premier ordre :
Ou alors:
Si, comme c'est souvent le cas avec les réactions de premier ordre, ce qui suit s'applique
- ,
devient la loi du temps pour les réactions du premier ordre :
Réactions de second ordre
Le second ordre sont des réactions élémentaires basées sur des collisions bimoléculaires. Des exemples en sont les substitutions nucléophiles selon le mécanisme S N 2 et les éliminations selon le mécanisme E2. Si des processus de désintégration ou de dissociation de premier ordre se déroulent également au cours d'une réaction à plusieurs étapes, ce sont généralement les étapes déterminant la vitesse, de sorte que, comme dans le cas des réactions S N 1 et E 1, la réaction globale est Premier ordre.
Si la collision bimoléculaire a lieu avec la participation de deux particules similaires de l'espèce A, la quantité du nombre stoechiométrique du matériau de départ A est égale à deux, et l'équation de réaction a la forme :
Les lois de vitesse et de temps résultantes ainsi que l'expression de la demi-vie de [A] ( t ) sont répertoriées dans le tableau ci-dessus .
Si des particules de deux espèces différentes A et B sont impliquées dans la collision bimoléculaire et que les valeurs absolues des nombres stoechiométriques et des réactifs A et B sont tous deux égaux à un, l'équation de réaction devient :
La loi de la vitesse devient ainsi :
Comme loi du temps, on obtient avec [B] 0 comme concentration initiale de réactif B avant le début de la réaction :
Réactions de troisième ordre
Pour qu'une réaction soit de troisième ordre, elle doit impliquer une collision trimoléculaire en tant que réaction élémentaire. Comme les collisions trimoléculaires ont une faible probabilité, les réactions de troisième ordre sont rares. L'apparition de réactions du troisième ordre était grossièrement liée à des réactions de recombinaison d'atomes et de radicaux du type
- ,
où M agit comme un partenaire de collision, ainsi que pour les réactions du monoxyde d'azote avec les halogènes X et l' oxygène selon
et
postulé.
Lois de vitesse des réactions d'équilibre
Une réaction d'équilibre est considérée
- .
Si les réactions de va-et-vient sont du premier ordre, les changements dans les concentrations et sont déterminés par les équations différentielles
avec les constantes de vitesse de la réaction et de la réaction inverse , ainsi que la condition
Les conditions aux limites suivantes sont nécessaires pour résoudre ce système d'équations différentielles :
- : ,
- : ,
Les deux équations différentielles pour et sont simplifiées par cette condition aux limites en :
Il en résulte la loi du temps intégrale suivante pour les réactions d'équilibre du 1er ordre :
Avec
- et
comme
il en résulte les lois de vitesse suivantes :
Mesure des profils concentration-temps
La cinétique des réactions chimiques est étudiée expérimentalement en déterminant des profils concentration-temps à l'aide de méthodes analytiques quantitatives. À cette fin, la chimie analytique offre une large gamme de méthodes qui évolue continuellement en raison des progrès de l' analyse instrumentale et de la technologie de microréaction . La variable mesurée sélectionnée pour déterminer le profil concentration-temps doit être quantitativement proportionnelle à la concentration des composants observés. Les méthodes fréquemment utilisées pour déterminer les profils concentration-temps comprennent la mesure de la constante diélectrique , l' indice de réfraction , l' activité optique , la fluorescence ou la conductivité de la solution réactionnelle, la mesure des changements de volume ou de pression, la calorimétrie ainsi que l' absorption et l'émission spectroscopie et diffusion de la lumière .
La grandeur mesurée peut être observée sur le mélange réactionnel lui-même sans contact et sans prélèvement d'échantillons du mélange réactionnel. Cette procédure est avantageuse car elle minimise les perturbations au cours de la réaction. Une autre procédure est basée sur le fait que des aliquotes sont prélevées régulièrement et généralement automatiquement à partir du mélange réactionnel . Celles-ci peuvent être soumises à des méthodes d'analyse non destructives puis combinées à nouveau avec le mélange réactionnel. Des méthodes d'analyse peuvent également être utilisées qui sont associées à la consommation des aliquotes prélevées. Si des aliquotes sont prélevées dans le mélange réactionnel, on intervient plus fortement dans le processus de réaction qu'avec les méthodes sans contact. Cependant, il est avantageux qu'un éventail beaucoup plus large de méthodes analytiques puisse être utilisé et des méthodes analytiques qui soient soit plus sensibles, soit fournissent plus d'informations d'une autre manière que les méthodes analytiques qui peuvent être utilisées pour l'observation sans contact de la mélange réactionnel. Les aliquotes extraites peuvent également être soumises à une analyse qualitative plus complexe, par exemple en séparant leurs composants par chromatographie en phase gazeuse ou chromatographie liquide haute performance avant l'examen analytique proprement dit . Dans certaines circonstances, la réaction dans les aliquotes prélevées doit être ralentie ou arrêtée afin d'éviter la falsification des résultats d'analyse en raison de la poursuite de la réaction après le prélèvement de l'échantillon. Ceci peut être réalisé en refroidissant fortement le mélange réactionnel éliminé ou en éliminant un composant réactif du mélange réactionnel, par exemple par précipitation .
Pour mesurer les profils concentration-temps, les réactifs doivent être mélangés suffisamment rapidement pour qu'un temps de démarrage défini pour la réaction à étudier puisse être identifié. Ceci peut être réalisé en miniaturisant les montages expérimentaux utilisés en utilisant la technologie de microréaction, puisque les voies de transport des réactifs sont alors raccourcies. Dans le cas de réactions lentes, des quantités définies de substance peuvent être mélangées à l'aide de simples agitateurs, de tubes d'écoulement ou de chambres de mélange de haute précision. Dans le cas de réactions plus rapides, caractérisées par des échelles de temps de l'ordre de la minute à la seconde, des dispositifs d'écoulement spéciaux sont souvent utilisés. Dans le cas de réactions extrêmement rapides, caractérisées par des échelles de temps de l'ordre de la milliseconde, des processus optimisés, tels que la méthode à flux arrêté , sont utilisés pour un mélange rapide et efficace des matières premières .
Un deuxième groupe de méthodes pour étudier des réactions extrêmement rapides avec des échelles de temps caractéristiques allant jusqu'à la picoseconde sont les méthodes de relaxation . Celles-ci reposent sur le principe du mélange des matières premières bien avant la période d'observation proprement dite. Le mélange réactionnel commence à réagir. Une fois qu'un état d'équilibre a été établi dans le mélange réactionnel, celui-ci est perturbé par un choc appliqué rapidement et la relaxation du mélange réactionnel dans un nouvel état d'équilibre est surveillée en utilisant des méthodes analytiques appropriées. Des exemples de processus de relaxation sont la photolyse flash ainsi que les processus de saut de température, de pression et de champ.
Histoire de la cinétique
Les premières recherches qualitatives sur la cinétique ont été rapportées par Carl Friedrich Wenzel dès 1777 dans son ouvrage Theory of the Relationship of Bodies , publié à Dresde . Plus tard, Claude-Louis Berthollet et William Higgins se sont également penchés sur les questions cinétiques. Le premier travail vraiment fondamental sur la cinétique, le clivage du sucre de canne sous l'influence de l'acide, a été présenté par Ludwig Ferdinand Wilhelmy en 1850. Jacobus Henricus van't Hoff a étudié la saponification de l'acétate d'éthyle et l'hydrolyse de l'acide chloroacétique en 1896 . Mathématiquement, il a formulé les équations de vitesse des réactions. Il a également développé les lois fondamentales sur la dépendance à la température de la vitesse de réaction. Svante Arrhenius a amélioré la dérivation et a donné comme règle empirique pour le changement de la vitesse de réaction lorsque la température augmentait de 1 K une augmentation de la vitesse de réaction d'environ 12 % (voir la règle RGT ). FEC Scheffer et WF Brandsma ont introduit l'énergie d'activation de Gibbs standard pour la constante de vitesse en 1926. Manfred Eigen , Ronald Norrish et George Porter ont reçu le prix Nobel de chimie en 1967 pour le développement de méthodes de relaxation permettant d'étudier la cinétique des réactions rapides .
Littérature
Manuels généraux
cinétique
- Margaret Robson Wright : Introduction à la cinétique chimique . John Wiley & Sons, Ltd, Chichester, Royaume-Uni 2004, ISBN 978-0-470-09060-2 , doi : 10.1002 / 047009060x.ch1 .
- Bernd Ralle, Ingo Eilks, Alfred Flint, Hartwig Möllencamp, Helmut Wenck : Manuel de chimie expérimentale : Secondaire supérieur II.8 , cinétique, catalyse, équilibre . Ed. : Bernd Ralle, Ingo Eilks, Wolfgang Glöckner, Walter Jansen, Rudolf G. Weissenhorn. Aulis-Verlag Deubner, Cologne 2004, ISBN 3-7614-2384-5 .
- Carl Heinz Hamann, Dirk Hoogestraat, Rainer Koch : Principes de base de la cinétique : des processus de transport à la cinétique de réaction . Springer-Verlag, Berlin 2017, ISBN 978-3-662-49393-9 , doi : 10.1007 / 978-3-662-49393-9 .
- M. Dieter Lechner : Introduction à la cinétique : cinétique des réactions chimiques et propriétés de transport . Springer-Verlag, Berlin / Heidelberg 2018, ISBN 978-3-662-57454-6 , doi : 10.1007 / 978-3-662-57455-3_1 .
liens web
- GJ Lauth : Introduction à la cinétique réactionnelle . Série de conférences, enregistrements vidéo, 2013.
Preuve individuelle
- ^ KJ Laidler : Un glossaire de termes utilisés dans la cinétique chimique, y compris la dynamique de réaction (IUPAC Recommendations 1996) . Dans : Chimie pure et appliquée . enregistrer 68 , non. 1 , 1er janvier 1996, ISSN 1365-3075 , p. 149-192 , doi : 10.1351 / pac199668010149 .
- ↑ Entrée sur la vitesse de réaction . Dans : IUPAC Compendium of Chemical Terminology (le « Livre d'or ») . doi : 10.1351 / goldbook.R05156 Version : 2.3.3.
- ↑ DIN 13345-1978-08 Thermodynamique et cinétique des réactions chimiques : symboles, unités.
- ↑ Carl Heinz Hamann, Dirk Hoogestraat, Rainer Koch : Fondements de la cinétique : des processus de transport à la cinétique de réaction . Springer-Verlkag, Berlin / Heidelberg 2017, ISBN 978-3-662-49392-2 , p. 116 , doi : 10.1007/978-3-662-49393-9 .
- ↑ M. Dieter Lechner : Introduction à la cinétique - cinétique des réactions chimiques et propriétés de transport . Springer-Verlag, Berlin / Heidelberg 2018, ISBN 978-3-662-57454-6 , p. 13 , doi : 10.1007/978-3-662-57455-3_1 .
- ↑ Christos Capellos, Benon HJ Bielski : Systèmes cinétiques : description mathématique de la cinétique chimique en solution . Wiley-Interscience, 1972, ISBN 0-471-13450-3 , 9780471134503.
- ^ Robert G. Mortimer : Chimie physique . Academic Press, 2000, 2e édition, chapitre 12, Les taux de réactions chimiques , page 408.
- ↑ Ignacio Tinoco Jr., James C. Wang : Chimie physique : principes et applications en sciences biologiques . Prentice Hall, 1995, 3e édition, page 331, ISBN 978-0-13-186545-7 .
- ↑ Alisa Gapchenko émulsion d'acrylate de styrène-butyle : Aspects de la copolymérisation à haute température et nouveaux domaines d'application Thèse du Département de chimie de la Faculté de mathématiques, d'informatique et des sciences naturelles de l'Université de Hambourg 2018, consulté le 29 août 2020
- ↑ Lothar Papula: Exercices et application aux mathématiques pour les chimistes. Enke Verlag, 1977, p. 382-385.
- ↑ Klaus H. Homann: 13. réactions trimoléculaire . P. 100-107, dans Reaction kinetics, Steinkopff-Verlag, Heidelberg 1975, DOI 10.1007/978-3-642-72314-8_13, https://doi.org/10.1007/978-3-642-72314-8_13 .
- ↑ VA Kritsman : Ludwig Wilhelmy, Jacobus Henricus van't Hoff, Svante Arrhenius et l'histoire de la cinétique chimique. In : La chimie à notre époque. Vol. 6, 1997, p. 291 et suiv.
- ↑ L. Wilhelmy: A propos de la loi selon laquelle l'action des acides sur le sucre de canne a lieu. Dans : Pogg. Anne. 81, 1850, pages 413-433, 499-526.
- ↑ JH van't Hoff : Études sur la dynamique chimique. W. Engelmann, Leipzig 1896.
- ^ FEC Scheffer, WF Brandsma : Sur les vitesses de réaction . Dans : Recueil des Travaux Chimiques des Pays-Bas 1926, 45, 522-534, DOI : 10.1002 / recl.19260450710 .


![{\ displaystyle \ mathrm {d ([A] / [A]} _ {0}) / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bffa3007e4f2b8f970aaa310799672465021225b)
![{\ displaystyle 1 / \ nu _ {A} \ cdot \ mathrm {d ([A] / [A]} _ {0}) / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e3ca75e45481f55ca495e47bbe4b3be7bc7732e)
![{\ style d'affichage [A] _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32488af10ddcce5bf90dbc659e6472d1279bd2f0)

![{\ displaystyle \ mathrm {[A]} (t) / \ mathrm {[A]} _ {0}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca8e698d211a4ba286dc5cee735fa102b7a7bd55)





![{\ displaystyle r = {\ frac {\ mathrm {d} \ xi} {V \ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {A}}}} {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {B}}}} {\ frac {\ mathrm { d} [\ mathrm {B}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {K}}}} {\ frac {\ mathrm {d} [\ mathrm {K}]} {\ mathrm {d} t}} = {\ frac {1} {\ nu _ {\ mathrm {L}}}} {\ frac {\ mathrm {d} [\ mathrm {L} ]} {\ mathrm {d} t}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bad051803386419a21f7dea06cdb06da403dd71b)
![{\ displaystyle \ mathrm {d [A]} / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9c0c0ea6e036d66d87e63ce6eb602371b86bfe5)
![{\ displaystyle 1 / \ nu _ {\ mathrm {A}} \ cdot \ mathrm {d} [\ mathrm {A}] / \ mathrm {d} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf7715affb2ac61f59c17ce855a4a55881e1c44f)




![{\ displaystyle k _ {\ mathrm {hin}} = \ mathrm {constant} \ cdot \ exp {\ bigg [} - {\ frac {\ Delta G _ {\ mathrm {hin}} ^ {\ ddagger}} { RT} } {\ Gros]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5c9f480d805db3e9bbb726e9cd6521c8248b45c)


![{\ displaystyle k _ {\ mathrm {back}} = \ mathrm {constant} \ cdot \ exp {\ bigg [} - {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} { RT} } {\ Gros]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/996f2f2265eaf4f43a856ff25e62b754618d01d2)







![{\ displaystyle k _ {\ mathrm {hin}} = \ mathrm {constant} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta G _ {\ mathrm {hin}} ^ {\ ddagger}} { RT} } {\ Bigg]} = {\ rm {Constant}} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R}} G + \ Delta G _ {\ mathrm { retour}} ^ {\ ddagger}} {RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46deb04cc6c2e21d23d1750099acd9d4655f653f)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} \ cdot \ exp {\ Bigg [} - {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} ^ {- 1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d0c937190983564e5f3238b3653b11c21aba01f)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} \ cdot \ exp {\ Bigg [} {\ frac {\ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]} = \ exp {\ Bigg [} {\ frac {- \ Delta _ {\ mathrm {R}} G- \ Delta G _ {\ mathrm {back}} ^ {\ ddagger} + \ Delta G _ {\ mathrm {back}} ^ {\ ddagger}} {RT}} {\ Bigg]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19aee0e077431b30b517a0760d126364d510da1c)
![{\ displaystyle {\ frac {k _ {\ mathrm {hin}}} {k _ {\ mathrm {back}}}} = \ exp {\ Bigg [} - {\ frac {\ Delta _ {\ mathrm {R }} G} {RT}} {\ Gros]} = K}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4c6dd0c1a99fdc736c3396a036e5aed97386036f)





![{\ displaystyle 1- [A] / (| \ nu _ {A} | \ cdot [A] _ {0})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/337110c425d9c31781976d98d5121f691087562b)


![{\ style d'affichage [Z_ {j}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8371401c82dcc3aba0f55a69dea98fb83f508dd)
![{\ displaystyle r = k \ prod _ {j = 1} ^ {N} [Z_ {j}] ^ {z_ {j}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4d33d1a831b5329307dcc16ef3df66aab63d11df)






![{\ style de texte r = k [A] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ee72b44104719c87638869353382dde6b7f8cc0)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39e8cc74543ef3ac1f13274623329b23eb33baf7)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9878fd8b07099ed2ad2df3657fa82599cab62ff)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}] ^ {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cae8322c5652dc81065bb686e5e94bf4ff9e497c)
![{\ displaystyle 1 / \ nu _ {A} \ cdot {\ rm {d [{\ ce {A}}]}} / {\ rm {d}} t = k [{\ ce {A}}] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c770fe40a51f2382df8b5a0c6cb44ec5e06938d9)
![{\ displaystyle {[A] = [A] _ {0}} + \ nu _ {A} kt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1cfec393e27b6c633c59222dd414410324037ec)
![{\ displaystyle {[A] = [A] _ {0}} \ mathrm {e} ^ {\ nu _ {A} kt}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/268290509ca296b465849ac2cd010a76e1bd892b)
![{\ displaystyle {[A] = 1 / {\ bigg (} {\ frac {1} {[A] _ {0}}} - \ nu _ {A} kt} {\ bigg)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58905a0ab28598add085990bdd15e9dab39d69cb)
![{\ displaystyle {\ frac {1} {[A] ^ {n-1}}} = {\ frac {1} {{[A] _ {0}} ^ {n-1}}} - (n- 1) \ nu _ {A} kt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b4b7805bb5edb6cda3e713e63edc1d2b2e84769)





![{\ displaystyle \ ln ([A] / [A] _ {0})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9501c936cb1f4ae7bd4d9d5475c56e7c8eaf6ae)
![{\ displaystyle {\ ce {{\ frac {1} {[A]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/104bf3c6ecace101c498f948eaf16bf55240619f)
![{\ displaystyle {\ ce {\ frac {1} {[A] ^ {{\ mathit {n}} - 1}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9cca86ad925386e3c962305fa7ad13100633146e)
![{\ displaystyle t_ {1/2} = - {\ frac {[A] _ {0}} {2 \ nu _ {A} k}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02f64ec9dd157d200ae582077ad93ce84a9d68df)

![{\ displaystyle t_ {1/2} = - {\ frac {1} {\ nu _ {A} k {\ ce {[A] 0}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aff34862949fc5d8ea01bd0d3a2ff2901d655a7)
![{\ displaystyle t_ {1/2} = - {\ frac {2 ^ {n-1} -1} {(n-1) \ nu _ {A} k {\ ce {[A] 0}} ^ { n-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c7217aefb2c55f85e584e77ecd1b0fef32f132f)
![{\ displaystyle r = {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t }} = k \ cdot [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e908ce8bb4236d61fcd34cc8fc0d5173cf379577)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot {\ frac {1} {[\ mathrm {A}]}} \ cdot \ mathrm {d} [\ mathrm {A}] = k \ cdot {\ mathrm {d} t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/991edf9e54347c2c08d1830272a2e92ba08fce32)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot \ int _ {[A] _ {0}} ^ {[A] (t)} {\ frac {1 } {[\ mathrm {A}]}} \ cdot \ mathrm {d} [\ mathrm {A}] = \ int _ {0} ^ {t} k \ cdot {\ mathrm {d} t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/701a42c632484c2e2d79bd52e380e9b359c96042)
![{\ displaystyle {\ frac {1} {\ nu _ {\ mathrm {A}}}} \ cdot \ mathrm {ln} {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A }] _ {0}}} = k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d551323f3783a9fc6574a26d4484d027f386576)
![{\ displaystyle \ mathrm {ln} {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A}] _ {0}}} = \ nu _ {\ mathrm {A}} \ cdot k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f796056d29939a185616b3a4f05d2adcb658b98)
![{\ displaystyle {\ frac {[\ mathrm {A}] (t)} {[\ mathrm {A}] _ {0}}} = \ mathrm {e} ^ {\ nu _ {\ mathrm {A}} \ cdot k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae2e4fa3cf7302b1d134600b6b2117bfa4fab090)
![{\ displaystyle [\ mathrm {A}] (t) = {[\ mathrm {A}] _ {0}} \ cdot \ mathrm {e} ^ {\ nu _ {\ mathrm {A}} \ cdot k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9737a380ff3c23262245168d953f8a1e9e9f77f8)

![{\ displaystyle [\ mathrm {A}] (t) = {[\ mathrm {A}] _ {0}} \ cdot \ mathrm {e} ^ {- k \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55eda391a671d77366d42c755b6a3ff960dbb78c)




![{\ displaystyle r = - {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = - {\ frac {\ mathrm {d} [\ mathrm {B}] } {\ mathrm {d} t}} = k \ cdot [\ mathrm {A}] \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30dca39ceaa144485ade998b5f8baaadd31e7a26)
![{\ displaystyle [\ mathrm {A}] = {\ frac {[\ mathrm {A}] _ {0} \ cdot \ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} \ cdot \ mathrm {e} ^ {\ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} kt}} {[\ mathrm {A }] _ {0} \ cdot \ mathrm {e} ^ {\ {[\ mathrm {A}] _ {0} - [\ mathrm {B}] _ {0} \} kt} - [\ mathrm {B }] _ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5c4b0ef1a53185d102c1dd94f7ab74a718632)






![{\ displaystyle r_ {a} = {\ frac {\ mathrm {d} \ mathrm {[A]}} {\ mathrm {d} t}} = - k_ {ab} \ cdot [\ mathrm {A}] + k_ {ba} \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b33c3d681d36a8ba401f51c998eda7a47e8b4349)
![{\ displaystyle r_ {b} = {\ frac {\ mathrm {d} \ mathrm {[B]}} {\ mathrm {d} t}} = + k_ {ab} \ cdot [\ mathrm {A}] - k_ {ba} \ cdot [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6c3288025ca1f9080fdc09fa45410c96f6c56d2)




![{\ displaystyle {\ mathrm {d} \ mathrm {[A]}} + {\ mathrm {d} \ mathrm {[B]}} = 0.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7bc2ea0582440f79e7d87f16a5936342d62b3454)

![{\ displaystyle \ mathrm {[A]} = \ mathrm {[A]} _ {0} -x}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4401e232423ffc963599d5f2f5e70a8f344e245e)
![{\ displaystyle \ mathrm {[B]} = \ mathrm {[B]} _ {0} + x}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72ee410f2ae3fa77a5531f88e17c2dc9182b43e7)

![{\ displaystyle \ mathrm {[A]} _ {\ mathrm {eq}} = \ mathrm {[A]} _ {0} -x _ {\ mathrm {eq}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/465f2367618c8aaec6346b3c118fceb4c8610c87)
![{\ displaystyle \ mathrm {[B]} _ {\ mathrm {eq}} = \ mathrm {[B]} _ {0} + x _ {\ mathrm {eq}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2022abf2e4415f0af6e3627153bc01c4800a1a61)




![{\ displaystyle \ mathrm {[A]} _ {\ mathrm {eq}} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac { k_ {ba}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af23095b20fd67ae2c6b2d4b87a2c446eb9c0c5f)
![{\ displaystyle \ mathrm {[B]} _ {\ mathrm {eq}} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac { k_ {ab}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/be959c8d2dee36c1f7132ef55c4154506d842439)
![{\ displaystyle \ mathrm {[A]} _ {0} - \ mathrm {[A]} _ {\ mathrm {eq}} = \ mathrm {[B]} _ {\ mathrm {eq}} - \ mathrm { [B]} _ {0} = {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd30bc67f5774cc5e891cfbbec70c50dad55c4a5)
![{\ displaystyle \ mathrm {[A]} _ {t} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac {k_ {ba} } {k_ {ab} + k_ {ba}}} + {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}} \ cdot \ mathrm {e} ^ {- (k_ {ab} + k_ {ba}) \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2570fdf8f24e64e349f50eff143bc69ed7babd5d)
![{\ displaystyle \ mathrm {[B]} _ {t} = (\ mathrm {[A]} _ {0} + \ mathrm {[B]} _ {0}) \ cdot {\ frac {k_ {ab} } {k_ {ab} + k_ {ba}}} - {\ frac {k_ {ab} \ mathrm {[A]} _ {0} -k_ {ba} \ mathrm {[B]} _ {0}} {k_ {ab} + k_ {ba}}} \ cdot \ mathrm {e} ^ {- (k_ {ab} + k_ {ba}) \ cdot t}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b2684fecf6a507155c88200a52b3b563fe1af39)