Configuration électronique
La configuration électronique indique la distribution des électrons à différents états d'énergie et donc des salons ( orbitales atomiques ) dans le cadre du modèle de coque de la coquille atomique .
Nombres et coquilles quantiques
L' état de chaque électron dans la coquille est déterminé par quatre nombres quantiques selon le modèle atomique de Bohr-Sommerfeld et le modèle orbital :

| Nombre quantique | personnage | Gamme de valeurs | la description | Exemples |
|---|---|---|---|---|
| Nombre quantique principal | 1, 2, 3, ... | K, L, M, ... | 3 | |
| Nombre quantique mineur | 0,…, n - 1 | s, p, d, f, ... | 0, 1, 2 | |
|
nombre quantique de moment angulaire magnétique |
, ..., | s, p x, y, z , d yz, xz, xy, z², x²-y² , ... |
−2, −1, ± 0, +1, +2 | |
|
nombre quantique de spin magnétique |
−½, + ½ | ↓, ↑ | −½, + ½ |
Selon le principe de Pauli , deux électrons d'un atome ne doivent pas avoir le même état dans les quatre nombres quantiques. Avec ce principe, on peut montrer que les électrons sont distribués aux différents états autorisés et donc aux coques et sous- coques .
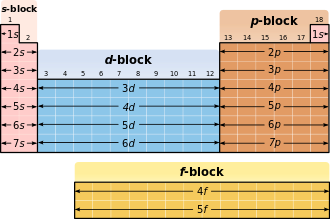
Les nombres quantiques principaux déterminent les coquilles, le quantique secondaire numérote les sous-coquilles. Chaque coquille, selon les limites de , et être remplie d'un maximum de 2n² électrons. Les coquilles sont désignées par ordre croissant, en commençant par la coquille du noyau, avec des lettres majuscules: K, L, M, N, O, P, Q ... Les orbitales sont nommées selon la série de raies spectrales émises par un électron excité quand il est dans l'orbite d'origine retombe; Pour des raisons historiques, les quatre premières séries sont appelées s («pointu»), p («principal»), d («diffus») et f («fondamental»).
La coquille occupée la plus externe (coquille de valence ) détermine le comportement chimique et est donc décisive pour la classification dans le tableau périodique .
Remplissage des bols selon le principe de montage

Avec un nombre croissant d'électrons dans les éléments , les états possibles - à commencer par les énergies les plus basses - sont occupés. Selon la règle de Hund , les orbitales avec la même énergie sont d'abord attribuées une fois, puis deux fois.
Les sous-coquilles sont remplies dans l' ordre suivant (en lignes, c'est-à-dire en périodes):
- 1ère période : 1s
- 2ème période : 2s 2p
- 3ème période : 3s 3p
- 4e période : 4s 3d 4p
- 5e période : 5s 4j 5p
- 6e période : 6s 4f 5d 6p
- 7e période : 7s 5f 6j ...
Relation avec le tableau périodique
Dans le tableau périodique, l'occupation de l'orbitale s d'une nouvelle coquille correspond au saut dans une nouvelle période .
| Orbitale / bloc |
Nombre d' électrons |
comprend des éléments de ... |
|---|---|---|
| s | 2 | Eléments du 1er et 2ème groupe principal ainsi que l' hélium |
| p | 6e | éléments de groupe principaux restants |
| ré | dix | tous les éléments du sous-groupe |
| F | 14e | tous les lanthanides et actinides |
notation
| 2p |
|
||||
|---|---|---|---|---|---|
| L. | 2 s |
|
|||
| K | 1s |
|
|||
| 1s 2 2s 2 2p 4 [He] 2s 2 2p 4 | |||||
La configuration électronique d'un atome est décrite par les sous-couches occupées:
- Le numéro de la coquille est suivi de la lettre de la coquille inférieure et en exposant le nombre d'électrons dans la coquille inférieure. Alors z. B. pour la 2ème coque inférieure (l = 1 ou p) de la 3ème coque (n = 3 ou M) occupée par 5 électrons la notation 3p 5 .
- S'il y a plusieurs sous-couches, la coquille commune est omise: 2s 2 2p 3 devient 2s 2 p 3 .
- Dans le cas d'une autre notation abrégée, l'abréviation du gaz rare avec le numéro ordinal inférieur suivant est placée entre crochets, indiquant les sous-couches manquantes de l'élément à afficher.
Exemple de chlore : 1s 2 2s 2 2p 6 3s 2 3p 5 → [Ne] 3s 2 3p 5 .
Les sous-couches ne doivent pas être spécifiées selon le principe de construction, mais dans l'ordre du nombre quantique principal; donc z. B. pour l' europium : [Xe] 4f 7 6s 2 .
De plus, la notation de cellule ou de Pauling est courante en tant que représentation graphique claire.