magnésium
| Propriétés | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Généralement | |||||||||||||||||||||||||||||||||||||||||||
| Nom , symbole , numéro atomique | Magnésium, Mg, 12 | ||||||||||||||||||||||||||||||||||||||||||
| Catégorie d'élément | Métaux alcalino-terreux | ||||||||||||||||||||||||||||||||||||||||||
| Groupe , période , bloc | 2 , 3 , p | ||||||||||||||||||||||||||||||||||||||||||
| Apparence | blanc argenté | ||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||
| Numéro CE | 231-104-6 | ||||||||||||||||||||||||||||||||||||||||||
| Carte d'information de l' ECHA | 100.028.276 | ||||||||||||||||||||||||||||||||||||||||||
| code ATC | |||||||||||||||||||||||||||||||||||||||||||
| Fraction massique de l' enveloppe terrestre | 1,94 % | ||||||||||||||||||||||||||||||||||||||||||
| Atomique | |||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 24,305 (24,304 à 24,307) u | ||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calculé) | 150 (145) heures | ||||||||||||||||||||||||||||||||||||||||||
| Rayon covalent | 141 heures | ||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 173 h | ||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3 s 2 | ||||||||||||||||||||||||||||||||||||||||||
| 1. Énergie d'ionisation | 7e.646 236 (4) eV ≈ 737.75 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| 2. Énergie d'ionisation | 15e.035 271 (6) eV ≈ 1 450.68 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 3. Énergie d'ionisation | 80.1436 (6) eV ≈ 7 732.68 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 4. Énergie d'ionisation | 109.2654 (12) eV ≈ 10 542.51 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 5. Énergie d'ionisation | 141.33 (3) eV ≈ 13 636 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| Physiquement | |||||||||||||||||||||||||||||||||||||||||||
| État physique | fixé | ||||||||||||||||||||||||||||||||||||||||||
| Structure en cristal | hexagonal | ||||||||||||||||||||||||||||||||||||||||||
| densité | 1,738 g / cm 3 (20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||
| Dureté de Mohs | 2.5 | ||||||||||||||||||||||||||||||||||||||||||
| magnétisme | paramagnétique ( Χ m = 1,2 · 10 −5 ) | ||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 923 K (650 ° C) | ||||||||||||||||||||||||||||||||||||||||||
| point d'ébullition | 1383K (1110°C) | ||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 14,00 10 −6 m 3 mol −1 | ||||||||||||||||||||||||||||||||||||||||||
| Chaleur d'évaporation | 132 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| Température de fusion | 8,7 kJmol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 4602 m s -1 à 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||
| La capacité thermique spécifique | 1023 J kg -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Fonction de travail | 3,66 eV | ||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 22,7 · 10 6 A · V -1 · m -1 | ||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 160 W · m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||
| Chimiquement | |||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 1, 2 | ||||||||||||||||||||||||||||||||||||||||||
| Potentiel normal | −2,372 V (Mg 2+ + 2 e - → Mg) | ||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,31 ( échelle de Pauling ) | ||||||||||||||||||||||||||||||||||||||||||
| Isotopes | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Pour les autres isotopes, voir la liste des isotopes | |||||||||||||||||||||||||||||||||||||||||||
| Propriétés RMN | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| consignes de sécurité | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
|
Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | |||||||||||||||||||||||||||||||||||||||||||
Le magnésium est un élément chimique avec le symbole de l' élément Mg ( alchimie : ⚩) et le numéro atomique 12. Dans le tableau périodique des éléments, il appartient au deuxième groupe principal ou au 2e groupe IUPAC et appartient donc aux métaux alcalino-terreux .
Le magnésium est l'un des dix éléments les plus communs de la croûte terrestre . Il est présent dans de nombreux minéraux ainsi que dans le vert des feuilles des plantes.
histoire

L'origine de la désignation de l'élément est présentée différemment dans la littérature :
- du grec ancien μαγνησία λίθος signifiant "pierre magnétique",
- de Magnisie , une région de l'est de la Grèce ,
- de Magnésie , une ville d'Asie Mineure dans l'actuelle Turquie.
Cependant, toutes les dérivations données semblent provenir étymologiquement des aimants ou de leur héros éponyme Magnes .
Les composés du magnésium étaient connus et utilisés des siècles avant la production de magnésium élémentaire. La magnésie alba faisait référence au carbonate de magnésium , tandis que la magnésie était le nom commun de l'oxyde de magnésium .
Le physicien et chimiste écossais Joseph Black a été le premier à étudier systématiquement les composés du magnésium au XVIIIe siècle. En 1755, il reconnaît dans son ouvrage De humore acido a cibis orto et Magnesia alba la différence entre la chaux ( carbonate de calcium ) et la magnésie alba (carbonate de magnésium), souvent confondues à cette époque. Il a compris la magnésie alba comme le carbonate d' un nouvel élément. C'est pourquoi Black est souvent cité comme le découvreur du magnésium, bien qu'il n'ait jamais représenté le magnésium élémentaire.
En 1808, Sir Humphry Davy obtint du magnésium par électrolyse d'hydroxyde de magnésium humidifié à l'aide d'une colonne de cendres voltaïque - non pas sous forme pure, mais sous forme d' amalgame , puisqu'il travaillait avec une cathode en mercure . Il montra que la magnésie est l'oxyde d'un nouveau métal qu'il appela initialement le magnium .
En 1828, le chimiste français Antoine Bussy réussit à produire de petites quantités de magnésium pur en chauffant du chlorure de magnésium sec avec du potassium comme agent réducteur. En 1833, Michael Faraday fut le premier à produire du magnésium par électrolyse de chlorure de magnésium fondu. Sur la base de ces expériences, le chimiste allemand Robert Wilhelm Bunsen a travaillé dans les années 1840 et 1850 sur des procédés de production de magnésium par électrolyse de sels fondus à l'aide de l' élément Bunsen qu'il avait mis au point . En 1852, il développa une cellule d'électrolyse pour la production de grandes quantités de magnésium à partir de chlorure de magnésium anhydre fondu. Ce procédé a été préféré à ce jour pour la production de magnésium.
La production technique du magnésium débute en France en 1857 selon un procédé d' Henri Etienne Sainte-Claire Deville et H. Caron. Dans le procédé dit Deville-Caron, un mélange de chlorure de magnésium anhydre et de fluorure de calcium est réduit avec du sodium . En Angleterre , Johnson Matthey a commencé à produire du magnésium en utilisant un procédé similaire vers 1860. Cependant, en raison de difficultés de fabrication, ces premières entreprises sont restées non rentables.
Occurrence

Le magnésium ne se présente pas sous forme élémentaire dans la nature en raison de sa réactivité. En tant que minéral , il se présente principalement sous forme de carbonates , de silicates , de chlorures et de sulfates . Sous forme de dolomite , un minéral de magnésium forme même des montagnes, par ex. B. dans les Dolomites .
Les minéraux les plus importants sont la dolomite CaMg (CO 3 ) 2 , la magnésite (spath amer) MgCO 3 , l' olivine (Mg, Fe) 2 [SiO 4 ], l' enstatite MgSiO 3 et la kieserite MgSO 4 · H 2 O.
Les autres minéraux sont :
- Serpentine Mg 3 [Si 2 O 5 ] (OH) 4
- Talc Mg 3 [Si 4 O 10 ] (OH) 2
- Sépiolite Mg 4 [Si 6 O 15 ] (OH) 2
- Schönite K 2 Mg (SO 4 ) 2 · 6 H 2 O
- Carnallite KMgCl 3 · 6H 2 O
- Spinelle MgAl 2 O 4
Lorsqu'il est dissous dans l'eau, il provoque, avec le calcium, la dureté de l'eau . En eau de mer , elle est supérieure à 1 kg/m³ inclus.
Extraction et présentation
Le magnésium est principalement extrait de deux manières :
- Par électrolyse au sel fondu du chlorure de magnésium fondu dans les cellules Downs : Les cellules Downs sont constituées de grandes auges en fer qui sont chauffées par le bas. Des tiges de graphite intégrées par le dessus servent d' anodes , qui sont entourées aux extrémités par une cathode en forme d'anneau . Le magnésium métallique s'accumule sur le sel fondu et est écumé. Le chlore gazeux résultant s'accumule dans la partie supérieure de la cellule et est réutilisé pour produire du chlorure de magnésium à partir d'oxyde de magnésium . Du calcium et du chlorure de sodium sont ajoutés au sel fondu pour abaisser le point de fusion du chlorure de magnésium.
- Par réduction thermique de l'oxyde de magnésium (procédé Pidgeon) : De la dolomie brûlée , de la barytine et un agent réducteur tel que le ferrosilicium sont versés dans un récipient en acier au chrome-nickel . Il est ensuite évacué (pompage du gaz ) et chauffé à 1160°C. Le magnésium vaporeux se condense sur la tête refroidie à l' eau à l'extérieur du four . Le magnésium obtenu par lots est ensuite purifié par distillation sous vide .
Le procédé Pidgeon est le procédé de fabrication le plus important aujourd'hui et est principalement utilisé en Chine.
88 % de la production mondiale de magnésium a lieu en Chine, où environ 800 000 tonnes de magnésium métal ont été produites en 2015. Viennent ensuite la Russie , Israël et le Kazakhstan, chacun avec une part de marché de quelques pour cent seulement .
La production de 1 kg de magnésium par le procédé Pidgeon produit des gaz à effet de serre avec un équivalent CO 2 d'environ 31 kg (à titre de comparaison : 1 kg d' acier produit entre 0,5 et 2 kg d' équivalent CO 2 ).
Bien que le magnésium se trouve dans plus de 60 minéraux, seuls la dolomite , la magnésite , la brucite , la carnallite , le talc et l' olivine ont une importance commerciale.
Le cation Mg 2+ - est dans l' eau de mer le deuxième cation le plus abondant, dont l'eau de mer et le sel de mer en font des sources commerciales attrayantes de magnésium. Pour l'extraire, de l'hydroxyde de calcium est ajouté à l'eau de mer pour former un précipité d' hydroxyde de magnésium .
L'hydroxyde de magnésium (brucite) est insoluble dans l'eau et peut être filtré et mis à réagir avec de l'acide chlorhydrique pour former du chlorure de magnésium concentré .
Le magnésium est produit à partir du chlorure de magnésium par électrolyse .
Propriétés
Le magnésium métallique léger solide, argenté et brillant est environ un tiers plus léger que l' aluminium . Le magnésium pur est pauvre en résistance et en dureté. Son module d'élasticité est d'environ 45 GPa. Dans l'air, le magnésium est recouvert d'une couche d'oxyde qui, contrairement à l'aluminium, n'est pas complètement opaque. En effet, l'oxyde de magnésium a un volume molaire inférieur au magnésium lui-même (MgO : 10,96 cm 3 /mol, Mg : 13,96 cm 3 / mol) ; voir le rapport de Pilling-Bedworth .
Les rubans fins ou les feuilles sont faciles à enflammer. Il brûle dans l'air avec une flamme blanche brillante pour former de l'oxyde de magnésium MgO et un peu de nitrure de magnésium Mg 3 N 2 . La poudre de magnésium fraîchement préparée peut chauffer dans l'air jusqu'à ce qu'elle s'enflamme spontanément. Des réactions dangereuses sont à prévoir à des températures plus élevées, c'est-à-dire en particulier avec des liquides en fusion. Le magnésium brûle également dans de nombreux oxydes tels que le monoxyde de carbone , l'oxyde d'azote et le dioxyde de soufre .
Le magnésium réagit avec l' eau pour former de l'hydrogène :
- Réaction du magnésium avec l'eau
Il se forme un enrobage peu soluble d' hydroxyde de magnésium , qui arrête largement la réaction ( passivation ). Même les acides faibles , tels que les sels d'ammonium , suffisent à dissoudre la couche d'hydroxyde, car ils convertissent les ions hydroxyde en eau et des sels solubles se forment. Sans passivation, la réaction exothermique est violente ; plus la poussière de magnésium est fine, plus elle est violente. Avec l'air, l'hydrogène libéré forme facilement un mélange explosif ( oxhydrique ).
Le magnésium réagit de manière exothermique avec le dioxyde de carbone pour former de l'oxyde de magnésium et du carbone :
Réaction du magnésium avec le dioxyde de carbone
Par conséquent, le dioxyde de carbone n'éteint pas les incendies de magnésium, mais les alimente plutôt.
En contraste avec l' aluminium, il est relativement résistant à l' acide fluorhydrique et de bases . La raison en est la faible solubilité du fluorure de magnésium (MgF 2 ) formé en tant que revêtement, qui empêche la formation ultérieure d' ions Mg (OH) 3 - .
Isotopes
Au total, 21 isotopes entre 19 mg et 40 mg de magnésium sont connus. Parmi ces trois, les isotopes 24 mg, 25 mg et 26 mg sont stables et présents dans la nature. L'isotope avec la plus grande proportion de la composition isotopique naturelle est de 24 mg avec 78,99 %, 25 mg a une proportion de 10,0% et 26 mg de 11,01 %. Les isotopes instables ayant la durée de vie la plus longue sont 28 Mg, qui se transforment en 28 Al avec une demi-vie de 20,915 heures avec la désintégration bêta , et 27 Mg, qui se désintègrent également en 27 Al avec une demi-vie de 9,435 minutes avec la désintégration bêta . Tous les autres isotopes n'ont que de courtes demi-vies de secondes ou de millisecondes.
utilisation
Magnésium métallique
La poudre et le fil de magnésium sont utilisés dans les engins incendiaires, les bombes et les munitions éclairantes, et autrefois également utilisés comme poudre de lampe de poche . Les tiges de magnésium servent souvent d' anodes sacrificielles , qui protègent les pièces en métaux nobles de la corrosion .
En métallurgie, le magnésium est utilisé de manière polyvalente,
- z. B. comme agent réducteur dans le procédé Kroll pour l'extraction du titane ,
- comme agent réducteur pour l' extraction de l' uranium , du cuivre , du nickel , du chrome et du zirconium ,
- en tant que composant d' alliages d'aluminium des groupes AlSiMg et AlMg,
- comme granulés de magnésium pour la désulfuration du fer et de l' acier ,
- comme additif pour la fonte nodulaire
Le magnésium est basé sur un groupe d'alliages légers normalisés pour la construction d'avions et de véhicules à moteur (dont la fusion nécessite une couche de revêtement de chlorure de magnésium fondu pour protéger contre l'exposition à l'air et à l'oxydation , voir traitement par fusion ), voir aussi électron (Matériau)
Une autre application est celle des torches qui brûlent sous l'eau.
En chimie organique, il est utilisé pour produire des composés de Grignard .
Parce que le magnésium s'enflamme très facilement, il est également utilisé comme briquet qui fonctionne même dans des conditions défavorables. Les blocs de magnésium vendus comme Fire Starter Kits sont fournis avec un silex dont l'abrasion s'enflamme spontanément dans l'air. La procédure est similaire à la méthode de l' âge de pierre consistant à allumer un feu avec du silex et de l' amadou , le magnésium jouant le rôle d'amadou. Tout d'abord, les copeaux sont grattés du bloc de magnésium avec un couteau et placés sur ou sous le carburant réel. Ensuite, en grattant le silex (par exemple avec le dos du couteau), des étincelles sont générées au plus près des copeaux de magnésium afin de les enflammer.
Alliages de magnésium
La propriété la plus importante des alliages de magnésium, qui les a rendus importants par rapport à l'aluminium et ses alliages, est la construction légère possible avec eux. Avec une densité d'environ 1,75 g/cm³, la différence avec l'aluminium léger d'une densité d'environ 2,75 g/cm³ est nette. De plus, la plage de fusion est comprise entre 430 et 630°C, ce qui est plus faible pour économiser de l'énergie. Cependant, les propriétés mécaniques telles que la résistance à la traction et la dureté sont nettement inférieures à celles des alliages d'aluminium . La faible densité a rendu le magnésium intéressant pour les applications mobiles à un stade précoce. La première grande application a eu lieu avant la Première Guerre mondiale dans la construction d'échafaudages pour les dirigeables rigides Zeppelin . Les alliages de magnésium ont été utilisés dans les véhicules à moteur pour la production de pièces de boîtier et pour la production de jantes pour toutes sortes de mobiles.Après 1930, les alliages de magnésium ont été de plus en plus utilisés dans la construction aéronautique parce que les économies de poids qu'ils ont permises ont permis des vols plus économes en énergie comme ainsi que des charges utiles plus élevées. Tout cela a conduit à une expansion rapide de la production de magnésium en Allemagne ( électron de l' usine chimique de Griesheim ) et, après 1940, également aux États-Unis. Immédiatement après le début de la production, "Elektron" est devenu le nom de marque des premiers alliages de magnésium.
D'autres utilisations possibles des pièces moulées en magnésium se sont présentées au cours des développements techniques, en partie dus à la guerre, en partie prévoyants de manière constructive et en même temps optimisant les alliages. Les alliages Mg-Al, Mg-Mn, Mg-Si, Mg-Zn et enfin les alliages Mg-Al-Zn ont été développés en tant que matériaux à base de magnésium.

Le carter de transmission de la VW Beetle a été coulé par millions à partir d'un alliage Mg-Si. Aujourd'hui, les alliages de magnésium ne sont pas seulement utilisés pour gagner du poids, mais se caractérisent également par un amortissement élevé. Lorsqu'il est exposé à des vibrations, cela entraîne une réduction des émissions de vibrations et de bruit. Pour cette raison également, les alliages de magnésium sont devenus des matériaux intéressants dans la construction de moteurs, comme dans la construction automobile en général. Ainsi, les pièces ne sont pas seulement le moteur en alliage de magnésium, mais de plus en plus aussi pour le moulage des blocs moteurs procédé hybride / fonte hybride appliqué pour la première fois en production en série dans l' Alfa Romeo 156 et plus tard chez BMW (voir aussi BMW N52 ).

Dans le processus de moulage sous pression (voir également sous moulage sous pression ), de nombreux composants à paroi mince, même de grande surface, peuvent être produits à proximité de leurs dimensions finales et sans post-traitement coûteux. B. jantes, profilés, boîtiers, portes, capots, couvercles de coffre, leviers de frein à main et autres. Les pièces en alliages Mg-Al-Zn ne sont pas seulement utilisées dans l'ingénierie automobile, mais aussi dans l'ingénierie mécanique.
Les efforts vers la construction légère ont déjà conduit à des alliages magnésium-lithium à la fin du 20ème siècle , des alliages encore plus légers en magnésium avec l'ajout de lithium .
Matériaux de magnésium en médecine
Les dernières recherches promettent un potentiel de développement élevé des matériaux en magnésium en tant que matériau d' implant résorbable (par exemple en tant que stent ) pour le corps humain. Les matériaux en magnésium doivent être protégés de la corrosion par contact pendant l'utilisation. La résistance à la corrosion aux influences atmosphériques normales est cependant bonne. Le comportement à la corrosion par contact serait un avantage décisif s'il était utilisé comme matériau d'implant à utiliser pendant une période de temps limitée, car il se dissoudrait en toute sécurité après un certain temps. Cela élimine les risques et les coûts d'une opération de retrait d'implants.
physiologie
Le magnésium fait partie des substances essentielles et est donc indispensable à tous les organismes. Les feuilles vertes des plantes, la chlorophylle , contiennent environ 2% de magnésium. Là, il forme l'atome central de la chlorophylle. En cas de carence en magnésium des plantes étiolées ainsi que par manque de lumière. Le corps humain doit également recevoir quotidiennement des quantités suffisantes de magnésium afin de prévenir une carence en magnésium.
Le corps d'un adulte contient environ 20 g de magnésium (à titre de comparaison : 1000 g de calcium ). Dans le plasma sanguin, 40 % du magnésium est lié aux protéines ; le taux sérique normal est de 0,8 à 1,1 mmol / l. Le magnésium est impliqué dans environ 300 réactions enzymatiques en tant que composant enzymatique ou coenzyme. De plus, les ions Mg libres influencent le potentiel sur la membrane cellulaire et agissent comme un second messager dans le système immunitaire . Ils stabilisent le potentiel de repos des cellules musculaires et nerveuses excitables et des cellules du système nerveux autonome . Une carence en magnésium déclenche de l'agitation, de la nervosité, de l'irritabilité, un manque de concentration, de la fatigue, une faiblesse générale, des maux de tête , des arythmies cardiaques et des crampes musculaires . Des crises cardiaques peuvent également survenir. Dans le domaine du métabolisme et du psychisme, on suppose qu'une carence en magnésium exacerbe la dépression et les psychoses schizophréniques . Un excès de magnésium dans le sang peut survenir en raison d'un apport excessif et d'un dysfonctionnement rénal et entraîne des troubles du système nerveux et du cœur.
La résorption du magnésium a d' abord été trouvée dans la partie supérieure de l' intestin grêle au lieu de, mais dans le reste du tube digestif. Il est excrété par les reins et est contenu en différentes quantités dans tous les aliments et dans l'eau potable. La dose quotidienne requise d'environ 300 mg est généralement atteinte grâce à une alimentation équilibrée. Un besoin accru peut être satisfait par des compléments alimentaires ou des médicaments . Une légère carence en magnésium est possible en raison d'une maladie grave, d'une grossesse ou d'un sport de compétition. Des carences sévères surviennent avec un dysfonctionnement rénal, une diarrhée de longue durée, une inflammation intestinale chronique, un diabète sucré mal contrôlé, des corticoïdes , certains diurétiques ou un alcoolisme avec dénutrition.
Les sels de magnésium tels que le citrate , le gluconate , l' aspartate et le chlorhydrate d' aspartate sont approuvés comme médicaments en Allemagne à des doses quotidiennes de 100 à 400 mg contre les carences et les troubles neuromusculaires tels que les crampes musculaires, les migraines ou les complications de la grossesse . Les effets secondaires sont les troubles gastro-intestinaux et la diarrhée, en cas de surdosage également la fatigue et le pouls lent. Les contre - indications sont le dysfonctionnement rénal et certaines arythmies cardiaques.
Lors de la prise de suppléments de magnésium par voie orale (comprimés, à croquer ou pastilles, granulés à dissoudre dans un liquide), le dosage est important. Diverses études sont parvenues à la conclusion qu'environ 35% sont absorbés lors de la prise de 120 mg , mais seulement environ 18% lors de la prise d'une dose quotidienne complète de 360 mg. Pour la résorption dans l'organisme, la forme des composés utilisés aujourd'hui dans les médicaments n'est pas pertinente car ils sont pharmacologiquement, biologiquement et cliniquement équivalents ; Les sels organiques tels que l'aspartate de magnésium ou le citrate de magnésium sont simplement absorbés par le corps plus rapidement que les composés inorganiques. D'autre part, le magnésium supplémentaire ne reste utilement dans le corps que s'il y a suffisamment de molécules de liaison disponibles dans le corps ; Cela se produit par le biais d'ajustements biochimiques uniquement après une augmentation plus longue de l'apport ou de la consommation de magnésium pendant au moins quatre semaines.
Le sulfate de magnésium ("sel d'Epsom") était auparavant utilisé comme laxatif et est utilisé pour traiter les arythmies cardiaques.
Les sels de magnésium sont utilisés en médecine alternative .
Nourriture
Le magnésium sert de cofacteur pour environ 300 différentes protéines , en particulier dans l' ATP et l' acide nucléique de liaison des enzymes . L'apport quotidien recommandé en magnésium pour l'homme se situe entre 24 et 400 mg par jour, selon l'âge et le sexe.
Le magnésium est présent sous forme de composé dans de nombreux aliments, en particulier dans les produits à grains entiers (par exemple le pain à grains entiers, les pâtes à grains entiers, le riz à grains entiers , les flocons d'avoine , les cornflakes ), l'eau minérale , en particulier l' eau médicinale , l'eau du robinet avec une dureté d'eau suffisante , le foie , la volaille , le poisson de table , graines de citrouille , graines de tournesol , chocolat , noix de cajou , cacahuètes , pommes de terre , épinards , chou - rave , fruits tendres , oranges , bananes , graines de sésame , sirop de betterave , le lait et les produits laitiers .
Dangers et mesures de protection
La dangerosité du magnésium élémentaire dépend fortement de la température et de la taille des particules : le magnésium compact est inoffensif à des températures inférieures au point de fusion, tandis que les copeaux et la poudre de magnésium sont hautement inflammables . En raison de la grande surface, ce dernier peut facilement réagir avec l'oxygène de l'air. Avec de la poudre de magnésium très fine, il y a un risque d' auto-inflammation ; Les mélanges air-poudre sont même explosifs . La flegmatisation est un traitement réduisant les risques lors du traitement des poudres de magnésium et de métal en général. Le magnésium fondu s'auto-enflamme également dans l'air. Le magnésium à grains fins ou chauffé réagit également avec de nombreuses autres substances, par exemple l'eau et d'autres composés contenant de l'oxygène. Les fontes de magnésium nécessitent donc une protection permanente contre la pénétration de l'oxygène atmosphérique. En pratique, cela se fait en recouvrant la masse fondue d'agents riches en chlorure de magnésium. L'hexafluorure de soufre convient également comme protection contre l'oxydation. Le revêtement au soufre élémentaire, qui était d'usage dans le passé, n'est plus pratiqué en raison des graves nuisances causées par le dioxyde de soufre produit.
Des températures allant jusqu'à environ 3000 ° C se produisent dans les feux de magnésium. En aucun cas, des agents d'extinction courants tels que l' eau , le dioxyde de carbone , la mousse ou l' azote ne doivent être utilisés, car le magnésium réagit violemment avec ceux-ci. Si de l'eau entre en contact avec un feu de magnésium, il existe un risque aigu de réaction oxhydrique .
Pour l'incendie (feu de métal ) d'un bain de fusion, le principe d'extinction d'asphyxie s'applique, c'est-à-dire le déplacement rapide de l'oxygène. Dans le cas le plus simple en recouvrant de sable sec, sinon en appliquant un sel de recouvrement pour les fontes de magnésium. Des poudres d'extinction de classe de feu D, de la poudre d'oxyde de magnésium ( Magnesia usta / magnésie brûlée ) et, si nécessaire, des copeaux de fonte grise secs et sans rouille conviennent également .
Lors de l'utilisation de magnésium, toutes les instructions de sécurité données doivent être suivies à la lettre. En aucun cas une atmosphère explosive (poussière de magnésium, hydrogène, aérosols et vapeurs de lubrifiants réfrigérants inflammables) ne doit se former. Les mesures normales de sécurité au travail , telles que l'évitement des sources d'inflammation , doivent également être respectées.
preuve
La meilleure façon de détecter le magnésium est au moyen de Magneson II , de jaune de titane ou de quinalizarine .
Pour la détection avec Magneson II (4-(4-nitrophénylazo) -1-naphtol), la substance d'origine est dissoute dans l'eau et rendue alcaline. Ensuite, quelques gouttes d'une solution du colorant azoïque Magneson II sont ajoutées. Si des ions magnésium sont présents, un vernis de couleur bleu foncé est créé. Les autres métaux alcalino-terreux doivent d'abord être éliminés sous forme de carbonates par précipitation.
Pour la détection avec le jaune de titane ( jaune de thiazole G), la substance d'origine est dissoute dans l'eau et acidifiée. Ensuite, il est mélangé avec une goutte de solution de jaune de titane et alcalinisé avec une solution d'hydroxyde de sodium diluée. Si du magnésium est présent, un précipité rouge clair se forme. Les ions nickel, zinc, manganèse et cobalt interfèrent avec cette détection et doivent être précipités au préalable sous forme de sulfures.
Pour la détection avec la quinalizarine, deux gouttes de la solution de colorant sont ajoutées à la solution d'échantillon acide. Ensuite, une solution d'hydroxyde de sodium diluée est ajoutée jusqu'à ce que la réaction soit basique. Une couleur bleue ou une précipitation indique le magnésium.
La formation de précipités avec des solutions de sels de phosphate peut également être utilisée comme réaction de détection des sels de magnésium. La solution d'échantillon sans métaux lourds, tamponnée à un pH de 8 à 9 avec de l'ammoniac et du chlorure d'ammonium, est mélangée avec une solution d' hydrogénophosphate disodique . Un trouble blanc soluble dans l'acide causé par le phosphate d'ammonium et de magnésium MgNH 4 PO 4 indique des ions magnésium :
A partir d'une solution ammoniacale, le Mg 2+ peut également être détecté avec l' oxine en tant que composé jaune-verdâtre peu soluble. Cette preuve convient au processus de séparation des cations .
liens
Dans les composés , le magnésium se présente presque exclusivement sous forme de cation divalent avec l' état d'oxydation 2.
Oxydes et hydroxydes
L' oxyde de magnésium (magnésie) forme incolores cristaux de chlorure de sodium - la structure . Dans la nature, il se présente sous forme de périclase minérale volcanique . Ils sont blancs à gris, en raison d' inclusions également de cristaux réguliers vert foncé brillant comme du verre.
La poudre de magnésie est ajoutée aux aliments en tant que régulateur d'acidité ou agent de séparation . Divers objets résistants à la chaleur pour les laboratoires et l' industrie sont fabriqués à partir de céramique d' oxyde de magnésium .
L'hydroxyde de magnésium est un sel incolore, fortement basique et se présente naturellement sous forme de brucite minérale . Il a une structure cristalline trigonale dans le groupe d'espace P 3 m 1 (groupe d'espace n° 164) et est utilisé comme additif d'huile de cuisson (pour lier le dioxyde de soufre ), comme floculant pour le traitement des eaux usées , comme retardateur de flamme dans les plastiques thermoplastiques ( polyoléfines , polychlorure de vinyle ) et élastomères , ainsi qu'additif utilisé dans les détergents . En médecine, il est utilisé comme antiacide pour neutraliser l' acide gastrique et comme laxatif doux .
Le peroxyde de magnésium est un composé incolore en poudre fine qui a une structure cristalline de pyrite dans le groupe spatial Pa 3 (groupe spatial n° 205) . Il est similaire au peroxyde de calcium et libère de l' oxygène par une réaction contrôlée avec des solutions aqueuses . Il a diverses utilisations dans l' agriculture , les produits pharmaceutiques et les cosmétiques .
engrais
Lors du chaulage des terres arables et des prairies, le magnésium est utilisé sous forme d' oxyde de magnésium ou de carbonate de magnésium pour compenser l'appauvrissement du sol en magnésium par les plantes . De plus, la valeur du pH du sol est augmentée et la disponibilité d'autres nutriments est améliorée. Le composé de magnésium est généralement utilisé avec la chaux comme engrais complexe contenant du magnésium et du calcium . Le phosphate de magnésium Mg 3 (PO 4 ) 2 ( phosphate de trimagnésium ), présent naturellement sous forme de Bobierrite, et le nitrate de magnésium sont également utilisés comme engrais complexes.
Halogénures

Le chlorure de magnésium est hautement hygroscopique et se trouve naturellement dans l' évêchéite minérale (MgCl 2 · 6 H 2 O), sous forme de carnallite à double sel (KMgCl 3 · 6 H 2 O), dans l'eau de mer et dans les lacs salés . Il cristallise dans le système cristallin trigonal du groupe d'espace R 3 m (groupe d'espace n° 166) . En technologie alimentaire, il est utilisé comme régulateur d'acide , agent raffermissant , exhausteur de goût , support ou agent de séparation . En tant que batterie thermique , le chlorure de magnésium hexahydraté peut stocker et libérer de l'énergie thermique .
Le fluorure de magnésium forme des cristaux incolores qui cristallisent de manière tétragonale dans la structure rutile dans le groupe d'espace P 4 2 / mnm (groupe d'espace n°136) groupe d'espace . Ses propriétés optiques , ainsi que sa stabilité chimique, en font un matériau important pour les applications optiques.
Le bromure de magnésium et l'iodure de magnésium sont également des sels hygroscopiques qui ont une structure cristalline trigonale dans le groupe spatial P 3 m 1 (groupe spatial n°164) .
Autres composés inorganiques
Le carbonate de magnésium est naturellement présent en grande quantité sous forme de magnésite (spath amer). Il cristallise trigonalement dans le groupe d'espace R 3 c (groupe d'espace n° 167) . Dans l' industrie alimentaire , il est ajouté comme un régulateur acide , support ou libération annonceur. Il est utilisé en escalade et en gymnastique et est également connu sous les noms de magnésie et de craie . Les athlètes y sèchent alors avant le début de l'exercice les paumes de leurs mains afin que leur peau en recouvrant les barres de lingots ou les barres de fer d' étirement ou d' haltères longs ne soit pas trop sujette. Il a également des usages médicaux et industriels.
Le nitrate de magnésium est un sel incolore et hygroscopique qui est facilement soluble dans l' eau . L' hexahydrate (Mg (NO 3 ) 2 · 6 H 2 O) a une structure cristalline monoclinique avec le groupe d'espace P 2 1 / c (groupe d'espace n° 14) . Il est utilisé comme engrais , stockage de chaleur latente (sous forme d'hexahydrate) ou dans l' industrie céramique .
Le sulfate de magnésium heptahydraté (Mg (SO 4 ) 7H 2 O) est connu sous le nom d' epsomite minérale (sel d'Epsom). Il forme des cristaux incolores qui forment un réseau cristallin pseudotétragonal rhombique . Les cristaux fleurissent souvent en agrégats fibreux et forment des stalactites . Il est utilisé pour les engrais , comme déshydratant et pour des applications médicinales.
Les phosphates de magnésium ( dihydrogénophosphate de magnésium (Mg (H 2 PO 4 ) 2 ), l'hydrogénophosphate de magnésium (MgHPO 4 ) et le phosphate de magnésium (Mg 3 (PO 4 ) 2 )) sont utilisés dans l' industrie comme matières premières céramiques et comme retardateurs de flamme . Dans l'industrie alimentaire, ils sont utilisés comme additif alimentaire , laxatif et additif alimentaire . Ils sont ajoutés aux aliments en tant que régulateurs d'acidité ou agents de démoulage.
Le spinelle est un minéral fréquent de la classe minérale des oxydes et hydroxydes avec la composition chimique idéalisée MgAl 2 O 4 et est donc un aluminate de magnésium d'un point de vue chimique . Il cristallise de manière isotypique avec la magnétite dans le système cristallin cubique du groupe d'espace Fd 3 m (groupe d'espace n° 227) .
La dolomite est un minéral très courant de la classe minérale des carbonates et des nitrates avec la composition chimique CaMg [CO 3 ] 2 et est donc chimiquement un carbonate de calcium- magnésium. Il cristallise dans le système cristallin trigonal dans le groupe d'espace R 3 (groupe d'espace n°148) .
L'hydrure de magnésium peut être utilisé pour stocker de l' hydrogène et de l' énergie . Par l' hydrogène , qui est libéré de l'hydrure de magnésium, une mousse métallique aux propriétés intéressantes, plus légère que l' eau , est générée.
D'autres composés de magnésium cristallins intéressants sont, par exemple, le diborure de magnésium , le carbure de magnésium , le nitrure de magnésium , le sulfure de magnésium , le siliciure de magnésium , le germanure de magnésium , le métasilicate de magnésium , l'oxyde de magnésium et de titane et le polonide de magnésium .
Organyles de magnésium
Les organyles de magnésium sont des composés organométalliques dans lesquels il existe une liaison entre le magnésium et le carbone . Parmi les organyles de magnésium, les composés de Grignard ( R -Mg- X ) sont de loin les plus importants. Les organyles binaires des halogénures de magnésium et d'alcénylmagnésium jouent un rôle clairement subordonné.
Halogénures organylmagnésiens
Les halogénures d'organyl magnésium (généralement appelés composés de Grignard ) sont obtenus dans un processus direct par réaction d'halogénures d'organyl avec des copeaux de magnésium. Les réactifs de Grignard sont en solution à l' équilibre de Schlenk . Ils réagissent avec halogène - organyle - substitution aux éléments organyles :
Généralement:
z. B. :
ou avec l' ajout d'organyles avec des systèmes de liaisons multiples :
Généralement:
z. B. :
Organyles binaires de magnésium
Les organyles binaires de magnésium (R 2 Mg, également appelés diorganyles de magnésium) peuvent être produits de différentes manières :
- par transmétallation , par exemple de diorganyles de mercure :
- due à la dismutation lorsque l' équilibre de Schlenk est déplacé à l'aide du 1,4-dioxane :
- Les magnésacycles ( alcanes cycliques avec un magnésium dans le cycle) peuvent également être préparés à l'aide de 1,4-dioxane .
- par métathèse de composés de Grignard avec des organyles lithium
- par hydromagnésation (ajout de MgH 2 aux 1-alcènes) :
- en raison de l' ajout de magnésium élémentaire aux doubles liaisons C = C dans certains hydrocarbures insaturés tels que le 1,3-butadiène ou l' anthracène (ajout de métal). Par exemple, la réaction du 1,3-butadiène dans le tétrahydrofurane à température ambiante est possible :
- Le magnésium butadiène produit, également appelé (2-butène-1,4-diyl) magnésium, peut être utilisé comme source d' anions butadiène dans d'autres synthèses . L' anthracène de magnésium jaune orangé est affiché de manière analogue . Le magnésium anthracène peut alors être utilisé comme catalyseur pour l' hydrogénation du magnésium.
Halogénures d'alcénylmagnésium
Dans ce que l'on appelle la carbomagnésation, les alcynes réagissent avec les alcynes pour former des halogénures d'alcénylmagnésium :
Autres composés organiques
Le citrate acide de magnésium et le dicitrate de trimagnésium sont des sels de magnésium de l'acide citrique . Le citrate de magnésium est utilisé comme médicament .
Le monoperoxyphtalate de magnésium est un désinfectant pour la désinfection des surfaces .
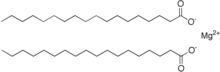
Le stéarate de magnésium est le sel de magnésium de l'acide stéarique et fait partie des savons de chaux . Il se compose d'un ion magnésium et de deux ions stéarate à longue chaîne .
liens web
Preuve individuelle
- ↑ a b Harry H. Binder: Lexique des éléments chimiques. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Les valeurs des propriétés (boîte d'informations) sont tirées de www.webelements.com (magnésium) , sauf indication contraire .
- ↑ IUPAC, la valeur standard recommandée par IUPAC est donnée, étant donné que la composition isotopique de cet élément peut varier localement, la plage de masse donnée dans les résultats des supports pour le poids atomique moyen. Poids atomiques standard révisé 2013 .
- ↑ a b c d e entrée sur le magnésium dans Kramida, A., Ralchenko, Yu., Reader, J. et NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed. : NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Consulté le 11 juin 2020.
- ↑ a b c d e l' entrée de magnésium à WebElements, https://www.webelements.com , consulté le 11 Juin, à 2020.
- ^ NN Greenwood, A. Earnshaw : Chimie des éléments. 1ère édition. VCH, Weinheim 1988, ISBN 3-527-26169-9 , page 136.
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Susceptibilité magnétique des éléments et des composés inorganiques, pp. 4-144. Les valeurs y sont basées sur g / mol et sont données en unités cgs. La valeur spécifiée ici est la valeur SI calculée à partir de celle-ci, sans unité de mesure.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang : valeurs corrigées pour les points d'ébullition et les enthalpies de vaporisation des éléments dans les manuels. Dans : Journal of Chemical & Engineering Data. Tome 56, 2011, pp. 328-337, doi : 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing : Manuel de physique expérimentale. Tome 6 : Solides. 2e édition. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , p.361 .
- ^ A. Stasch, C. Jones : Composés dimères stables de magnésium (I) : des repères chimiques aux réactifs polyvalents. Dans : Transactions Dalton . Volume 40, 2011, pp. 5659-5672, doi : 10.1039 / C0DT01831G .
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Electrochemical Series, pp. 8-22.
- ↑ a b Entrée sur le magnésium, poudre, non stabilisé dans la base de données substances GESTIS de l' IFA , consultée le 9 août 2016. (JavaScript requis)
- ↑ Entrée sur le magnésium dans l' inventaire des classifications et étiquetages de l' Agence européenne des produits chimiques (ECHA), consulté le 1er août 2016. Les fabricants ou les distributeurs peuvent étendre la classification et l'étiquetage harmonisés .
- ↑ Définition des caractères 26A9 (Hex) comme magnésium dans la norme Unicode, version 5.2 (PDF; 291 Ko).
- ^ US Geological Survey, Mineral Commodity Summaries, janvier 2016
- ↑ Volker Hasenberg : Analyse du cycle de vie et évaluation écologique de la production de magnésium. PE INTERNATIONAL, Forum des matériaux pour les arbres légers intelligents 24 avril 2012, Foire de Hanovre.
- ↑ La réaction entre le magnésium et le CO 2 . Université Purdue, consulté le 15 juin 2016 .
- ↑ G. Audi, FG Kondev, Meng Wang, WJ Huang, S. Naimi : L'évaluation NUBASE2016 des propriétés nucléaires. Dans : Chinese Physics C. 41, 2017, S. 030001, doi : 10.1088 / 1674-1137 / 41/3/030001 (texte intégral)
- ↑ FY Li, B. Chaigne-Delalande et al. : Second rôle messager du Mg 2+ révélé par l'immunodéficience T humaine. Dans : Nature. Volume 475, numéro 7357, juillet 2011, pp. 471-476 ; doi: 10.1038 / nature10246 . PMID 21796205 ; PMC 3159560 (texte intégral gratuit).
- ↑ a b c Sighart Golf : Biodisponibilité des composés organiques et inorganiques. Dans : Journal pharmaceutique . juillet 2009, consulté le 4 mars 2015 .
- ^ R. Swaminathan : Métabolisme du magnésium et ses troubles. Dans : Clin Biochem Rev. 24 (2), mai 2003, pp. 47-66. PMID 18568054 .
- ↑ z. B. Kenneth D Fine, Carol A Santa Ana, Jack L Porter, John S Fordtran : absorption intestinale du magnésium provenant des aliments et des suppléments. Dans : J Clin Invest . Volume 88 (2), août 1991, pp. 396-402, PMC 295344 (texte intégral gratuit, PDF), doi : 10.1172 / JCI115317 .
- ↑ Voir par exemple K. Knudsen, J. Abrahamson : Effets antiarythmiques du sulfate de magnésium. Rapport de trois cas. Dans : Acta Anesthesiologica Scandinavica. Volume 39, n° 6, (Copenhague) 1995, p. 850.
- ↑ Société Allemande de Nutrition : Les valeurs de référence pour les apports nutritionnels : Magnésium . Consulté le 20 octobre 2013.
- ↑ Entrée de magnésium hydroxyde. Dans : Römpp Online . Georg Thieme Verlag, consulté le 13 juin 2014.
- ↑ Georg Brauer (Ed.), Avec la collaboration de Marianne Baudler et autres : Handbook of Preparative Inorganic Chemistry. 3e édition revue et corrigée. Tome II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , page 907.
- ↑ Chaulage des terres arables et des prairies. (PDF; 43 ko) (N'est plus disponible en ligne.) DLR Rheinhessen-Nahe-Hunsrück, archivé à partir de l' original le 14 février 2016 ; consulté le 14 février 2016 .
- ↑ Science-Online-Lexica : Phosphate de magnésium. Dans : Lexique de chimie. Consulté le 26 mai 2011.
- ↑ entrée sur le nitrate de magnésium. Dans : Römpp Online . Georg Thieme Verlag, consulté le 26 mai 2011.
- Accumulateur de chaleur à base de sel . Article de 2012.
- Inscription pour le n° CAS. 7783-40-6 dans la base de données des substances GESTIS de l' IFA , consulté le 17 octobre 2012. (JavaScript requis)
- ^ MA Brogan, AJ Blake, C. Wilson, DH Gregory : diiodure de magnésium, MgI 2 . Dans : Acta Crystallographica , C59, 2003, pp. I136-i138, doi : 10.1107 / S0108270103025769 .
- ^ Hans Lohninger : Magnésie pour les athlètes. Récupéré le 6 juillet 2019 .
- ↑ Entrée sur le nitrate de magnésium dans la base de données des substances GESTIS de l' IFA , consultée le 23 juillet 2016. (JavaScript requis)
- ↑ spinelle. Dans : mindat.org. Hudson Institute of Mineralogy, consulté le 15 mai 2019 .
- ^ Hugo Strunz , Ernest H. Nickel : Tables minéralogiques de Strunz. Système de classification des minéraux chimiques et structurels . 9e édition. E. Schweizerbart'sche Verlagbuchhandlung (Nägele et Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , p. 188 .
- ^ Hugo Strunz, Ernest H. Nickel : Tables minéralogiques de Strunz. Système de classification des minéraux chimiques et structurels . 9e édition. E. Schweizerbart'sche Verlagbuchhandlung (Nägele et Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , p. 287 .
- ↑ Reuben D. Rieke : Préparation de poudres métalliques hautement réactives et leur utilisation en synthèse organique et organométallique. Dans : Comptes de la recherche chimique. Volume 10, numéro 8, août 1977, pp. 301-306, doi: 10.1021 / ar50116a005 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , page 1233.
- ↑ Christoph Elschenbroich : Organométallchimie . 6e édition revue et corrigée. Vieweg + Teubner, 2008, ISBN 978-3-519-53501-0 ( aperçu du livre dans la recherche de livres Google).
- ↑ Yukitami Saheki, Katsuhiko Sasada, Nobumasa Satoh, Noriyuki Kawaichi, Kenji Negoro : une préparation pratique de dialkylmagnésium pur à partir d'un réactif de Grignard. Dans : Lettres de chimie. Tome 16, 1987, pp. 2299-2300, doi: 10.1246 / cl.1987.2299
- ↑ Borislav Bogdanovic : Systèmes de magnésium anthracène et leur application en synthèse et catalyse. Dans : Comptes de la recherche chimique. Volume 21, numéro 7, juillet 1988, pp. 261-267, doi: 10.1021 / ar00151a002 .
- ↑ K. Fujita, Y. Ohnuma, H. Yasuda, H. Tani : Composés d'addition magnésium-butadiène : Isolement, analyse structurale et réactivité chimique. Dans : Journal de chimie organométallique. Volume 113, numéro 3, juin 1976, pp. 201-213, doi : 10.1016 / S0022-328X (00) 87329-5 .
- ↑ Ramsden, HE 63 : Brevet américain 1967, 3, 354, 190.
- ↑ Entrée sur les composés organiques du magnésium. Dans : Römpp Online . Georg Thieme Verlag, consulté le 26 mai 2014.
- ↑ Franz v. Bruchhausen, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe : Hager's Handbook of Pharmaceutical Practice, Volume 5 : Substances LZ . Springer-Verlag, 2013, ISBN 978-3-642-58388-9 , p. 86 ( aperçu limité dans la recherche Google Book).