Chlorophylles

La chlorophylle (du grec ancien Chloros « vert clair, frais » et φύλλον phyllon « feuille ») ou vert feuille fait référence à une classe de colorants naturels , qui sont formés par les organismes qui opèrent la photosynthèse . Les plantes en particulier tirent leur couleur verte de la chlorophylle.
Les plantes, les algues et les cyanobactéries ont différents types de chlorophylle, les bactéries responsables de la photosynthèse ont différents types de bactériochlorophylle .
Structure et propriétés
Les chlorophylles sont des structures moléculaires appelées complexes chélates , constituées d'un cycle porphyrine dérivé et de Mg 2+ comme ion central. Contrairement à la porphyrine, la structure de base des chlorophylles contient un cinquième anneau supplémentaire sur l'anneau III (numérotation selon Fischer). Selon le type de chlorophylle, différentes chaînes latérales sont attachées au corps de base. Par exemple, la chlorophylle a est estérifiée avec du phytol (voir tableau). Les chlorophyllides sont des chlorophylles sans chaînes latérales.
Structurellement, les chlorophylles sont liées à l' hème , qui se présente en tant que composant du pigment sanguin ( hémoglobine ), de la myoglobine et des cytochromes , mais en tant qu'ion central ne contient pas de magnésium mais de fer . Les chlorophylles sont facilement solubles dans l' éthanol et l' acétone, ainsi que dans des solvants similaires. Si la photosynthèse a lieu dans des organismes qui libèrent de l'oxygène ( phototrophes oxygéniques ), on parle généralement de chlorophylle . Cependant, les phototrophes anoxygéniques ne produisent pas d'oxygène en tant que produit de réaction lors de la photosynthèse. Dans ces organismes, la chlorophylle est appelée bactériochlorophylle .
Hans Fischer a déterminé la structure moléculaire de la chlorophylle en 1940, la configuration absolue a été élucidée par Ian Fleming en 1967 .
Structure chimique des phototrophes oxygénés
| Nom de famille | structure | C 2 reste | C 3 reste | C 7 reste | C 8 reste | C 17 reste | Obligation C 17-18 | Formule moléculaire |
|---|---|---|---|---|---|---|---|---|
| Chlorophylle a |

|
-CH 3 | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO- phytyle | Obligation simple | C 55 H 72 O 5 N 4 mg |
| Chlorophylle b | -CH 3 | -CH = CH 2 | –CHO | -CH 2 CH 3 | -CH 2 CH 2 COO-Phytyle | Obligation simple | C 55 H 70 O 6 N 4 mg | |
| Chlorophylle c 1 | -CH 3 | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH = CHCOOH | Double liaison | C 35 H 30 O 5 N 4 mg | |
| Chlorophylle c 2 | -CH 3 | -CH = CH 2 | -CH 3 | -CH = CH 2 | -CH = CHCOOH | Double liaison | C 35 H 28 O 5 N 4 mg | |
| Chlorophylle d | -CH 3 | –CHO | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO-Phytyle | Obligation simple | C 54 H 70 O 6 N 4 mg | |
| Chlorophylle f | –CHO | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO-Phytyle | Obligation simple | C 55 H 70 O 6 N 4 mg |
Structure chimique des phototrophes anoxygéniques : bactériochlorophylles (Bchl)
a : Pas de double liaison entre C7 et C8 (marqué en couleur sur l'image)
b : Bchl c , d et e sont un mélange d'isomères dans lequel le radical R 3 ou R 4 est différemment substitué.
Propriétés spectrales
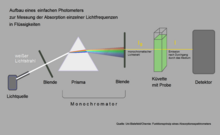
Un simple spectromètre d'absorption peut être utilisé pour mesurer quelle lumière est particulièrement fortement absorbée par la chlorophylle. Dans cet exemple, l'ouverture est placée de telle sorte que la lumière jaune tombe dans la cuvette avec la solution de chlorophylle. La quantité de lumière jaune émergeant de l'autre côté de la cuvette tombe à peine en dessous de la quantité de lumière incidente, car presque rien n'a été absorbé par la chlorophylle dans la gamme de ces longueurs d'onde. Si vous déplacez le diaphragme de manière à ce que la lumière rouge ou bleue pénètre, le détecteur derrière la cuvette mesure des émissions nettement plus faibles.
Les spectres d'absorption des chlorophylles dissoutes dans les solvants possèdent toujours deux maxima d'absorption distincts compris entre 600 et 800 nm, comme on appelle la bande Q y - , et un à 400 nm, la bande de Soret . La figure de droite montre ces maxima d'absorption pour la chlorophylle a et b . De plus, il existe la bande Q x autour de 580 nm, qui est polarisée perpendiculairement à Q y et absorbe généralement très faiblement. Pour la chlorophylle a, elle est encore visible sur la figure, pour la chlorophylle b, elle disparaît sous terre. La zone entre les bandes s'appelle l' espace vert .
Les spectres de la figure permettent de comprendre facilement pourquoi les feuilles - qui contiennent de la chlorophylle a et b - sont vertes. Ensemble, la chlorophylle a et b absorbent principalement dans le domaine spectral bleu (400-500 nm) et dans le domaine spectral rouge (600-700 nm). Dans la zone verte, en revanche, il n'y a pas d'absorption, donc la lumière verte est dispersée, ce qui fait apparaître les feuilles vertes.

L'absorption dépend du solvant et par conséquent la position des maxima d'absorption peut varier de quelques nanomètres selon le type de solvant. Dans le milieu naturel des chlorophylles, c'est-à-dire le milieu protéique, les choses sont différentes. Ici, la position des maxima d'absorption dépend de deux facteurs : (1) Selon la charge partielle des acides aminés environnants et la courbure des groupes latéraux des molécules de chlorophylle, les maxima d'absorption peuvent être à des longueurs d'onde très différentes. (2) Dans les protéines, les chlorophylles sont très proches les unes des autres, de sorte qu'elles interagissent entre elles ( interaction dipôle-dipôle ; à très courte distance également interaction d'échange ). Cette interaction conduit à un abaissement du niveau d'énergie et donc à un redshift des maxima d'absorption. Cela peut être vu de manière particulièrement impressionnante dans l'exemple du complexe d' antennes LH2 de bactéries violettes. Le complexe LH2 est constitué de deux groupes de molécules de bactériochlorophylle disposées en anneau (voir figure à gauche). L'anneau supérieur (B850) contient 18 molécules BChl a , très rapprochées les unes des autres, c'est -à- dire fortement couplées. L'anneau inférieur (B800) est constitué de 9 molécules BChl a , qui sont nettement plus éloignées les unes des autres et sont donc beaucoup plus faiblement couplées.
Le couplage fort décale l'absorption de BChl a dans l'anneau B850 vers le rouge. La bande d'absorption est à 850 nm. Les BChl a faiblement couplés du cycle B800, en revanche, absorbent à 800 nm, c'est-à-dire à peu près dans la même gamme que les molécules BChl a dissoutes dans le solvant . Dans le spectre d'absorption (figure de droite) du complexe LH2, les bandes d'absorption des molécules B800 et B850-BChl- a sont clairement séparées. De plus, les bandes qui proviennent des molécules de caroténoïdes sont représentées ; elles ne sont pas représentées dans la structure.
Les types
Il existe plusieurs types de chlorophylle qui diffèrent par les groupes latéraux de la porphyrine. Ils ont des spectres d'absorption différents et se produisent dans différents organismes phototrophes :
| Type de chlorophylle | Couleur | Maxima d'absorption (en nm) |
Occurrence |
|---|---|---|---|
| Chlorophylle a | bleu vert | 430, 662 (dans l'acétone) | Cyanobactéries et tous les eucaryotes phototrophes |
| Chlorophylle b | vert jaunâtre | 454, 643 (dans l'éther diéthylique) | Algues vertes ( Chlorophyta ), Euglenozoa et toutes les plantes terrestres |
| Chlorophylle c | vert | 444, 576, 626 | au lieu de la chlorophylle b dans les algues brunes ( Phaeophyta ), les diatomées ( Bacillariophyta ), les algues dorées ( Chrysophyta ), les algues jaune-vert ( Xanthophyta ), les Haptophyta , les Dinophyta et les Raphidophyceae |
| Chlorophylle d | 447, 688 | à la place de la chlorophylle b dans les algues rouges ( Rhodophyta ) | |
| Bactériochlorophylle a | vert | 358, 577, 773 (dans l'acétone) | Bactéries violettes ( Rhodospirillacées , Chromatiaceae ) |
| Bactériochlorophylle b | 368, 580, 794 (dans l'acétone) | Bactéries soufrées pourpres ( Chromatiaceae ); Bactéries violettes | |
| Bactériochlorophylle c | vert | 432, 660 (dans l'acétone ?) | Bactéries vertes du soufre ( Chlorobiaceae ) |
| Bactériochlorophylle c p | 740 ( in vivo ) | Bactéries vertes non soufrées ( Chloroflexacées ) | |
| Bactériochlorophylle d | 458, 646 (en quoi ?) 427, 654 (en acétone) | Bactéries vertes du soufre ( Chlorobiaceae ) | |
| Bactériochlorophylle e | 424, 654 (en quoi ?) 462, 649 (en acétone) | Bactéries vertes du soufre ( Chlorobiaceae ) | |
| Bactériochlorophylle g | 408, 418, 470, 575, 763 (en quoi ?) 412, 788 ( in vivo ) | Héliobactéries |
biosynthèse
La chlorophylle se trouve chez les eucaryotes dans les chloroplastes synthétisés chez les procaryotes dans le cytoplasme . Dans le cas de nombreux phototrophes , la formation de chlorophylle est induite par la lumière et ne se produit pas sans exposition. La biosynthèse consiste en une série de nombreuses étapes avec un nombre correspondant d' enzymes spécifiques .
La synthèse de ce tétrapyrrole et d'autres est un processus en plusieurs étapes qui comporte également divers points de ramification. La biosynthèse part du L - glutamate et se termine par un sirohème -, un hème - et une branche chlorophyllienne.
Après plusieurs étapes, l' uroporphyrinogène III est formé à partir du L- glutamate , le premier point de ramification à partir duquel le sirohème peut être formé. L'uroporphyrinogène III est ensuite converti en protoporphyrine IX en trois étapes , qui est le deuxième point de ramification vers l'hème. Dans la protoporphyrine IX, l'ion magnésium est introduit dans une réaction dépendante de l'ATP, qui catalyse une chélatase de magnésium ( EC 6.6.1.1 ). Le Mg de protoporphyrine IX ainsi formé est transformé en vinyl protochlorophyllide a via l'ester monoéthylique de Mg de protoporphyrine IX . Cette étape est catalysée par une cyclase qui introduit le cinquième cycle dans la chlorophylle. Chez les plantes, cette enzyme est dépendante de l' O 2 , tandis que chez les procaryotes, il existe à la fois des cyclases dépendantes et indépendantes de l' O 2 .
Dans l'étape suivante, le cycle D de la protochloropylle est réduit en divinyl chlorophyllide a par une oxydoréductase ( EC 1.3.1.33 ) . Chez les angiospermes, cette réaction est absolument dépendante de la lumière. Par conséquent, les semis ne forment pas de chlorophylle tant qu'ils ne sont pas exposés à la lumière. D'autres plantes (certaines gymnospermes ), des algues, mais aussi des cyanobactéries possèdent à la fois une oxydoréductase dépendante et indépendante de la lumière. En conséquence, ces organismes peuvent synthétiser de la chlorophylle même dans l'obscurité. Le divinyl chlorophylle a est réduit en monovinyl chlorophylle a par une réductase avant d'être estérifié en chlorophylle a dans une étape finale à l'aide de phytol phosphate . Cette étape terminale est catalysée par une chlorophylle synthase, une prényl transférase ( EC 2.5.1.62 ).
La chlorophylle b peut également être formée à partir de la chlorophylle a ou vice versa.
La dégradation de la chlorophylle dans les arbres à feuilles caduques produit une couleur caractéristique des feuilles en automne. La chlorophylle est métabolisée en chlorophyllide par la chlorophyllase . Ceci est suivi d'un échange d'ions par le Mg 2+ - Dechelatase à phéophorbide . Le phéophorbide est oxydé par la phéophorbide A oxygénase avec le cofacteur ferredoxine , la couleur verte disparaît et d'abord divers produits de dégradation fluorescents (FCC, de l'anglais fluorescent chlorophyll catabolites ) et dans la dégradation ultérieure, des substances non fluorescentes (NCC) apparaissent. Dans l' érable, la chlorophylle est une autre voie menant au dioxobilan démantelé.
Importance dans la photosynthèse
Les chlorophylles ont plusieurs tâches au sein de la photosynthèse dans le photosystème I et le photosystème II . De loin la plus grande part est utilisée pour l' absorption de la lumière et la transmission de l'énergie absorbée. Ils agissent donc comme des photosensibilisateurs . À cette fin, les molécules de chlorophylle sont organisées en complexes collecteurs de lumière , qui sont disposés de telle sorte que d'une part la plus grande surface absorbante possible est formée et d'autre part un entonnoir énergétique est créé qui guide l'énergie absorbée vers le soi-disant centre de réaction . Dans le centre réactionnel, deux chlorophylles servent d' accepteurs de cette énergie. Ils sont disposés de manière si particulière que leur excitation conduit à une séparation de charge, qui peut être considérée comme la première étape de la photosynthèse proprement dite. Cette paire de chlorophylle est appelée une paire spéciale en anglais .
Il existe de nombreuses différences dans la structure des complexes de récolte de lumière dans les organismes très différents qui conduisent la photosynthèse, mais le centre de réaction est presque toujours structuré de la même manière. Chez les plantes, les algues et les cyanobactéries, le couple spécial est toujours formé par la chlorophylle a , chez les bactéries par diverses bactériochlorophylles.
Présence dans les aliments
La teneur en chlorophylle est particulièrement élevée dans les légumes verts. La teneur en chlorophylle a et b des légumes et des fruits pour 100 g de matière fraîche est indiquée dans le tableau suivant par ordre décroissant de teneur en chlorophylle a :
| Chlorophylle a | Chlorophylle b | |
|---|---|---|
| chou frisé | 189 mg | 41 mg |
| grosse ortie | 185 mg | 173 mg |
| persil | 157 mg | 55 mg |
| épinard | 95 mg | 20 mg |
| Brocoli | 26 mg | 6 mg |
| haricots verts | 12 mg | 4 mg |
| pois verts | 10 mg | 2 mg |
| concombre | 6 mg | 2 mg |
| Kiwi | 1,7 mg | 0,4 mg |
| chou blanc | 0,3-1 mg | 0,1-0,2 mg |
Avec le label E 140 , les chlorophylles ( CI Natural Green 3 ) sont homologuées comme colorants alimentaires .
De plus en plus d'études montrent que les substances végétales secondaires ont un effet positif sur les processus métaboliques humains. Cela s'applique à la chlorophylle ainsi qu'aux flavonoïdes et aux caroténoïdes , par exemple .
l'histoire
Les premières descriptions d'un « colorant » pouvant être extrait par l'éthanol (« alcool de vin ») et décomposé sous l'influence de la lumière se trouvent dans le livre de Heinrich Friedrich Link « Basic Teachings of Anatomy and Physiology of Plants », Göttingen 1807. Il sont également ambiguës Preuve que Joseph Louis Proust a qualifié la teinture verte de "Fécule". Pierre Joseph Pelletier et Joseph Bienaimé Caventou extraient à nouveau la substance et la nomment chlorophylle . Les premières études sur la structure chimique de la chlorophylle viennent de Richard Willstätter (1913). Le chimiste Hans Fischer reprit les recherches de Willstätter dans les années 1930, et en 1940 il réussit à élucider la structure de la molécule. Les recherches de Fischer ont été confirmées en 1960 par la synthèse de la chlorophylle de Robert B. Woodward . Même avant Woodward, la synthèse totale a réussi d'une manière quelque peu différente par un groupe de chimistes de l'ancien lieu de travail de Fischer, l'Université technique de Munich. Les anciens employés de Fischer Alfred Treibs et Martin Strell y ont poursuivi ses travaux sur la synthèse totale de la chlorophylle. Le but des deux groupes était la synthèse du phéophorbide a , puisque Willstätter avait déjà décrit la synthèse résiduelle sur cette base.
divers
Une propriété importante de la chlorophylle est la fluorescence de la chlorophylle . Il est principalement utilisé pour déterminer la teneur en chlorophylle et son activité ainsi que pour d'autres analyses scientifiques.
En raison de son effet neutralisant les odeurs, la chlorophylle est également disponible sous forme de comprimés en pharmacie comme remède contre la mauvaise haleine et les odeurs corporelles.
Voir également
Littérature
- Hans W. Heldt et Birgit Piechulla : Biochimie végétale . 4e édition. Spectrum Academic Publishing House, 2008, ISBN 978-3-8274-1961-3 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer : Biochimie . 6e édition. Spectrum Academic Publishing House, Heidelberg 2007, ISBN 978-3-8274-1800-5 .
- R. Tanaka, A. Tanaka : Biosynthèse du tétrapyrrole chez les plantes supérieures . Dans : Annu Rev Plant Biol . 58 ; 321-346 ; PMID 17227226 . 2007 ; doi: 10.1146 / annurev.arplant.57.032905.105448
liens web
- Voie métabolique pour la formation de chlorophylle et d'hème dans les enzymes KEGG
- Spectres d'absorption de l'Université de la santé et des sciences de l'Oregon
Preuve individuelle
- ^ Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus et Uwe Sonnewald : Strasburger - Manuel de botanique . 36e édition. Spektrum Akademischer Verlag, Heidelberg 2008, page 315, ISBN 978-3-8274-1455-7 ; P. 277.
- ^ Ian Fleming : Absolute Configuration and the Structure of Chlorophyll , Nature 1967, 216 , 151-152 doi: 10.1038/216151a0 .
- ↑ Hyper Physique: Couleurs spectrales
- ^ Hugo Scheer (éditeur) : Chlorophylles. CRC Press, 1991. ISBN 0-8493-6842-1 .
- ↑ a b c d Gerhard G. Habermehl , Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie. Une introduction . 3. Édition. Springer, Berlin 2008, ISBN 978-3-540-73732-2 , p. 530 .
- ↑ a b c d e f g h Michael T. Madigan, John M. Martinko: Brock - microbiologie . 11e édition. Pearson Studium, Munich / Boston et autres 2009, ISBN 978-3-8273-7358-8 , p. 607 (Anglais : Brock biologie des micro-organismes . Traduit par Thomas Lazar, Freya Thomm-Reitz).
- ↑ Samuel I. Beale : Enzymes de la biosynthèse de la chlorophylle (article de synthèse). Dans : Recherche sur la photosynthèse . Volume 60, 1999. pp. 43-73. Le chemin de la biosynthèse est également montré ici.
- ↑ Hans W. Heldt et Birgit Piechulla : Biochimie végétale. 4e édition. Spektrum Akademischer Verlag, 2008, ISBN 978-3-8274-1961-3 , page 292.
- ^ A b T. Müller, M. Rafelsberger, C. Vergeiner, B. Kräutler: Un dioxobilane en tant que produit d'un chemin divergent de dégradation de la chlorophylle dans l'érable de Norvège. Dans : Angewandte Chemie. Volume 50, numéro 45, novembre 2011, pp. 10724-10727, doi : 10.1002 / anie.201103934 , PMID 21928453 , PMC 3262146 (texte intégral gratuit).
- ↑ a b c P. Matile, S. Hortensteiner, H. Thomas, B. Krautler : Décomposition de la chlorophylle dans les feuilles sénescentes. In : Physiologie végétale. Volume 112, numéro 4, décembre 1996, pp. 1403-1409, PMID 12226455 , PMC 158071 (texte intégral gratuit).
- ↑ Entrée sur E 140: chlorophylles et Chlorophyllines dans la base de données européenne pour les additifs alimentaires, accessibles le 16 Juin à 2020.
- ↑ Spécifications des additifs alimentaires autorisés
- ↑ Les produits phytochimiques et leurs effets sur la santé - Une mise à jour basée sur le Rapport sur la nutrition 2012. Consulté le 15 avril 2021 .
- ↑ Pelletier & Caventou, Sur la Matière verte des Feuilles Annales de Chimie et de Physique , 1818, 9, 194-196 ( aperçu limité dans la recherche de livres Google).
- ↑ M. Strell, A. Kalojanoff, H. Koller, synthèse partielle de la structure de base de la chlorophylle a, du phéophorbide a , Angew. Chem., 72, 169-170 (1960).
- ↑ Eric Fontain, The Munich Chlorophyll Synthesis , TU Munich, 2000