potassium
| Propriétés | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Généralement | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom , symbole , numéro atomique | Potassium, K, 19 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie d'élément | Métaux alcalins | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe , période , bloc | 1 , 4 , p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | blanc argenté | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro CE | 231-119-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Carte d'information de l' ECHA | 100.028.290 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fraction massique de l' enveloppe terrestre | 2,41% | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomique | |||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 39.0983 (1) et al | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calculé) | 220 (243) h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalent | 203 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 275 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 4 s 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Énergie d'ionisation | 4e.340 663 69 (9) eV ≈ 418.81 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Énergie d'ionisation | 31.62500 (19) eV ≈ 3 051.35 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Énergie d'ionisation | 45.8031 (17) eV ≈ 4 419.3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Énergie d'ionisation | 60.917 (19) eV ≈ 5 878 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Énergie d'ionisation | 82.66 (16) eV ≈ 7 975 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physiquement | |||||||||||||||||||||||||||||||||||||||||||||||||
| État physique | fixé | ||||||||||||||||||||||||||||||||||||||||||||||||
| Structure en cristal | cubique centré | ||||||||||||||||||||||||||||||||||||||||||||||||
| densité | 0,856 g / cm 3 (20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté de Mohs | 0,4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnétisme | paramagnétique ( Χ m = 5.7 10 −6 ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 336,53 K (63,38 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| point d'ébullition | 1047K (774°C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 45,94 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur d'évaporation | 79,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Température de fusion | 2,334 kJmol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 2000 m s -1 à 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||
| La capacité thermique spécifique | 757,8 J kg -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fonction de travail | 2,30 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 14,3 · 10 6 A · V -1 · m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 100 W · m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chimiquement | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | -1, +1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Potentiel normal | −2,931 V (K + + e - → K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 0,82 ( échelle de Pauling ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Pour les autres isotopes, voir la liste des isotopes | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés RMN | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| consignes de sécurité | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | |||||||||||||||||||||||||||||||||||||||||||||||||
Potassium ( latin , de l' arabe القلية, DMG al-qalya 'plant ash') est un élément chimique avec le symbole de l' élément K (anciennement aussi Ka) et le numéro atomique 19. Dans le tableau périodique, il est dans le premier groupe principal ou le 1er groupe IUPAC et est l'un des les métaux alcalins .
Le potassium est l'un des dix éléments les plus communs de la coquille terrestre et se trouve dans de nombreux minéraux de la croûte terrestre .
histoire


Le 19 novembre 1807, Humphry Davy rapporta à la Royal Society de Londres qu'il avait réussi à obtenir deux métaux différents par électrolyse d'alcalis caustiques faiblement humidifiés ; L'un des métaux, extrait pour la première fois le 6 octobre 1807, fut appelé potassium (terme anglais et français désignant le potassium qui est encore utilisé aujourd'hui) car il peut être extrait de la potasse , tandis que l'autre, obtenu pour la première fois quelques jours plus tard, est le sodium (qui est encore utilisé aujourd'hui nom anglais et français pour sodium ), car il est contenu dans les diverses modifications du carbonate de sodium (soude). Dans le monde germanophone, le Sodium Davy est depuis 1811, comme suggéré par Berzelius appelé sodium, tandis que pour le Potassium Davy à l'un des Klaproth introduit en 1796 exprime le potassium (de l'arabe.القَلْيَة al-qalya = cendre, obtenu à partir de la cendre végétale) a pris le relais.
Occurrence
Le potassium n'est présent naturellement que sous forme de cation dans les composés de potassium. Cela est dû au fait qu'il n'a qu'un seul électron externe et qu'il est très disposé à l'abandonner afin d'obtenir une couche externe d' électrons stable et de faible énergie . Les composés potassiques covalents ne sont donc pas connus. La concentration moyenne dans l' eau de mer est de 399,1 mg K + /kg = 408,4 mg K + /l.
Les minéraux naturels contenant du potassium sont :
- Sylvin - KCl
- Sylvinite - KCl · NaCl
- Carnallite - KCl · MgCl 2 · 6H 2 O
- Kainite - KCl · MgSO 4 · 3H 2 O
- Schönite - K 2 SO 4 • MgSO 4 • 6 H 2 O
- Polyhalite - K 2 SO 4 · MgSO 4 · MgSO 4 · 2 CaSO 4
- Orthose (feldspath potassique) - K [AlSi 3 O 8 ]
- Moscovite (potasse mica ) - KAl 2 (OH, F) 2 [AlSi 3 O 10 ]
Les sels de potassium forment des dépôts d'évaporation sur les anciens fonds marins , ce qui rend économique l' extraction des sels de potassium dans ces zones. Le sel de potasse est extrait au Canada, en Russie, en Biélorussie, au Kazakhstan, en Allemagne, en Israël, aux États-Unis, en Jordanie et ailleurs dans le monde. Les plus grands gisements jamais découverts se trouvent à 1 000 mètres sous la surface dans la province canadienne de la Saskatchewan. Les gisements sont situés dans le groupe Elk Point, qui s'est formé dans le Dévonien central . En Saskatchewan , où plusieurs grandes mines étaient exploitées depuis les années 1960 , la technique de congélation du sable humide (la formation de Blairmore) a été introduite pour y creuser des puits de mine . La principale société d'extraction de potasse en Saskatchewan est la Potash Corporation . L'eau de la mer Morte est utilisée comme source de potasse par Israël et la Jordanie, alors que la concentration dans les océans normaux est trop faible pour une production commerciale aux prix actuels.
En 2010, du potassium a été détecté dans l'atmosphère des exoplanètes XO-2b et HD 80606 b .
Extraction et présentation
Le potassium métallique peut être extrait en utilisant plusieurs méthodes. Des procédés électrolytiques tels que le procédé Degussa ou un procédé thermique d' IG Farben , usine de Griesheim ont été utilisés. La plupart du potassium, cependant, dans les années 1950 par Mine Safety Appliances, a introduit la méthode MSA dans laquelle à 870 ° C sous une atmosphère de gaz protecteur avec du sodium métallique est effectuée une réduction du chlorure de potassium . Le potassium gazeux résultant est déposé dans un piège froid par condensation.
Les alliages Na-K disponibles dans le commerce sont également accessibles en faisant varier les paramètres de distillation.
Le potassium élémentaire peut être trouvé en laboratoire via la réduction de chromate ou de bichromate à l' aide de zirconium selon :
ou la décomposition thermique de l'azoture de potassium :
ainsi qu'une distillation ultérieure sous vide poussé sont disponibles.
Propriétés
Semblable aux autres métaux alcalins , le potassium réagit souvent très violemment avec de nombreux autres éléments et composés , en particulier avec les non-métaux , et n'est présent que chimiquement lié dans l' environnement naturel . Le potassium a une réactivité plus élevée que le sodium et réagit violemment avec l' eau pour former de l'hydroxyde de potassium et libérer de l' hydrogène . Des enregistrements à grande vitesse de la réaction des métaux alcalins avec l'eau suggèrent une explosion de Coulomb .
- Réaction du potassium avec l'eau
En raison de la réaction fortement exothermique , l' hydrogène s'enflamme lorsque l'air entre. Cela peut entraîner des déflagrations et des explosions . Dans l' oxygène sec , le métal brûle avec une flamme violette intense pour former de l'hyperoxyde de potassium KO 2 et du peroxyde de potassium K 2 O 2 .
- respectivement.
- Réaction du potassium avec l'oxygène
Dans l' air humide, il réagit très rapidement avec l' eau et le dioxyde de carbone pour former du carbonate de potassium avec formation d' hydrogène .
- Réaction du potassium avec l'eau et le dioxyde de carbone
Le potassium réagit avec les alcools pour former des alcoolates avec formation d' hydrogène .
- Réaction du potassium avec l'éthanol
Comme tous les métaux alcalins , le potassium est facilement soluble dans l' ammoniac liquide , formant une solution bleu-violet . Avec les halogènes brome et iode sous forme liquide ou solide , le potassium est transformé par explosion en les halogénures correspondants .
Pour éliminer le potassium, il est généralement recommandé d' introduire avec précaution de petits morceaux de métal dans un large excès d' alcool tert-butylique , avec lequel il réagit pour former l'alcoolate et l' hydrogène . Comme cette réaction se déroule très lentement, il peut arriver que de petits résidus de potassium restent inaperçus, recouverts d'une croûte de tert- butanolate de potassium . Par conséquent, une attention particulière doit être portée à l'exhaustivité de la réaction . Alternativement, le 1-butanol peut également être utilisé pour de petites quantités de potassium , qui réagit plus rapidement avec le potassium mais reste contrôlable. Il ne faut en aucun cas utiliser des alcools " inférieurs " ( propanols , éthanol ou méthanol ) car ils réagissent trop violemment avec le potassium et sont également plus inflammables .
Dans l' air , la surface taillée d'un blanc argenté brillant du métal frais est recouverte d'une couche bleuâtre chatoyante d' oxyde et d' hydroxyde et d'un peu de carbonate en quelques secondes . Laissé à l'air, comme tous les métaux alcalins, il réagit lentement et complètement pour former du carbonate . Le potassium métallique est donc utilisé dans les liquides organiques anhydres , tels que. B. l' huile de paraffine stockée. Contrairement au sodium , le potassium peut encore former des croûtes d' oxydes , de peroxydes et d' hydroxydes après un stockage prolongé , qui enrobent le métal sous forme de couches jaune rougeâtre et qui peuvent exploser au toucher ou à la pression . Une élimination sûre n'est alors plus possible ; la seule option ici est de brûler l'ensemble du conteneur dans des conditions contrôlées. Le potassium soudé dans des emballages en polyéthylène peut également être recouvert d'une croûte explosive, de sorte que ces emballages ne conviennent pas au stockage .
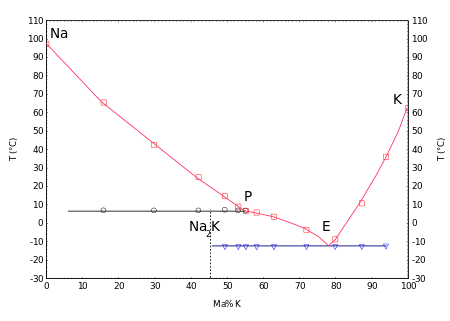
Des mélanges liquides se forment avec le sodium dans une large gamme de concentrations à température ambiante , voir : NaK (alliage) . Le diagramme de phases montre un composé Na 2 K qui fond de manière incongrue à 7°C et un eutectique à -12,6°C avec une teneur en sodium de 23% w .
utilisation
Le potassium a été utilisé comme liquide de refroidissement dans certains réacteurs nucléaires à grande vitesse sous la forme d'un alliage eutectique Na-K . Sinon, le potassium métallique n'a que peu d'importance technique, puisqu'il peut être remplacé par le sodium moins cher .
Dans le laboratoire de recherche, le potassium est occasionnellement utilisé pour le séchage des solvants utilisés, en particulier lorsque le point d'ébullition du solvant est supérieur au point de fusion du potassium, mais inférieur au point de fusion du sodium . Ensuite, le potassium est fondu dans le solvant bouillant et sa surface ne s'incruste pas. Vous avez donc besoin de beaucoup moins de métal alcalin et il peut être presque entièrement utilisé dans le processus de séchage, de sorte que seuls de très petits résidus doivent être éliminés.
Longtemps laissé au repos, le potassium développe des croûtes de composés peroxo (K 2 O 2 et KO 2 ), même sous liquide protecteur ( pétrole ), qui réagissent de manière très explosive . Même avec une faible pression , en particulier lorsque vous soulevez des morceaux de potassium avec des pinces ou essayez de couper avec un couteau , ces composés peroxo peuvent déclencher des explosions . Comme contre-mesures, la fusion dans des ampoules de verre ou le stockage sous liquide protecteur et gaz inerte sont recommandés . De plus, en raison du risque d'explosion , les solvants halogénés ne doivent pas être séchés avec du potassium. Les réactions du potassium dans le jeu des solvants, qui peuvent facilement dégager de l' oxygène , sont également dangereuses .
Autres utilisations:
- Dopage de fils de tungstène pour la fabrication de filaments de lampes à incandescence
- Alliage thermique Na-K (voir sodium )
- Sous forme d' hyperoxyde de potassium KO 2 comme filtre à air de potassium (voir cartouches de potasse ) utilisé sur les sous-marins pour la régénération de l' air respirable , entre autres
Importance biologique
Importance comme engrais
Les sels de potassium solubles dans l' eau sont utilisés comme engrais car les plantes ont du mal à digérer les silicates de potassium présents dans le sol .
L' agriculture industrielle utilise des engrais à la récolte pour remplacer le potassium perdu. La plupart des engrais agricoles contiennent du chlorure de potassium , tandis que le sulfate de potassium est utilisé pour les cultures sensibles au chlorure ou les cultures à plus forte teneur en soufre . Peu d'engrais contiennent du nitrate de potassium . D'autres engrais contenant du potassium sont Kornkali avec de l'oxyde de magnésium , Patentkali, Flory, Nitrophoska et phosphate de potassium .
Le potassium, un macronutriment essentiel, a un large éventail d' effets sur les plantes . Dans le xylème , il sert d' osmotique , ce qui est crucial pour augmenter la pression racinaire. Le potassium dans les cellules des feuilles augmente la turgescence , ce qui conduit à l'allongement des cellules et à la croissance de la surface des feuilles. En augmentant la turgescence, il permet également une ouverture des stomates , ce qui favorise l'absorption du dioxyde de carbone et a ainsi une influence directe sur la photosynthèse . Si le potassium est disponible en quantité suffisante, il favorise la formation de sucres C3 dans un premier temps , qui sont transformés en amidon , cellulose , lignine et protéines dans d'autres processus métaboliques influencés par le potassium . Les plantes qui souffrent d'un manque de potassium présentent des symptômes principalement sur les feuilles les plus âgées . Le potassium en est retransloqué et transporté dans les jeunes feuilles via le phloème . Les symptômes typiques d'une carence en potassium sont une chlorose ponctuelle, intercostale et foliaire et une nécrose foliaire . Il existe également un habitus comprimé et éventuellement un flétrissement . Un fort ensoleillement peut provoquer une photo-oxydation des feuilles. Un excès plus important provoque des brûlures racinaires et une carence en calcium ou en magnésium .
Le potassium est l'antagoniste du calcium - les deux éléments nutritifs doivent donc être présents dans la bonne proportion l'un par rapport à l'autre dans la plante et dans le sol.
Importance pour le corps humain
Le potassium est un minéral essentiel ( élément en vrac ) pour le maintien de la vie . En tant que cation intracellulaire le plus important , le potassium est impliqué dans les processus physiologiques de chaque cellule :
- Bioélectricité des membranes cellulaires , d. H. irritabilité neuromusculaire normale, stimulation et conduction cardiaque
- Régulation de la croissance cellulaire
- Influence des fonctions vasculaires endothéliales protectrices (protectrices)
- Maintenir une pression artérielle normale
- Régulation de l' équilibre acido-basique en influençant l' excrétion acide nette rénale
- Affectant la libération d' hormones (par exemple, l' insuline des cellules bêta )
- Utilisation des glucides et synthèse des protéines
Apports recommandés et réels en potassium
Afin de maintenir tous les processus physiologiques vitaux, il est conseillé de consommer au moins 2 g de potassium par jour. Le Food and Nutrition Board (FNB) des États-Unis et du Canada considère cependant qu'un apport de 4,7 g/jour (120 mmol/jour) est approprié pour tous les adultes d'un point de vue préventif. Sur la base de nouvelles découvertes, cette quantité de potassium (provenant des aliments) est nécessaire pour prévenir, réduire ou retarder les maladies chroniques telles que l' hypertension artérielle , la sensibilité au sel , les calculs rénaux , la perte de masse osseuse ou les accidents vasculaires cérébraux .
Selon l' Enquête nationale sur la nutrition II (NVS II), l'apport en potassium se situe en Allemagne dans la médiane à 3,1 g/jour (femmes) ou 3,6 g/jour (hommes). L'apport de 4,7 g de potassium par jour recommandé par la FNB n'est pas atteint par 75 % des hommes et 90 % des femmes.
Importance du rapport sodium/potassium

Le potassium joue un rôle important dans la régulation du potentiel membranaire de l'organisme . La concentration en potassium intracellulaire est d'environ 150 mmol/l, en extracellulaire elle est de 4 mmol/l. La concentration en sodium intracellulaire est d'environ 10 mmol/l, extracellulaire d'environ 140 mmol/l. Ces différences de concentration sont entretenues par la Na/K-ATPase et sont vitales pour le fonctionnement de la cellule. Un déplacement permanent de ces concentrations cellulaires peut conduire à un arrêt cardiaque en systole avec augmentation de la concentration en K + ( hyperkaliémie ), c'est-à-dire K + >> 4,5 mmol / l, et à une hypokaliémie ( K + < 3,5 mmol / l ) Diminution de la capacité de muscles à se contracter, excitation accrue, perturbation de la conduction de l'excitation, extrasystoles du cœur. K + est (en plus de Na + ) décisif pour la pression osmotique des cellules, c'est-à-dire pour la teneur en eau de la cellule. Une concentration trop faible de K + dans le sang entraîne un arrêt cardiaque en diastole . La plage normale dans le sérum est de 3,6 à 4,5 mmol / l, dans l'urine, elle est de 26 à 123 mmol / l. C'est-à-dire que K + est constamment perdu, ce qui doit être remplacé par de la nourriture.
Ceci est particulièrement problématique de nos jours, car le régime alimentaire occidental se caractérise par la consommation d'aliments d'origine animale. La consommation d'aliments à base de plantes riches en potassium est cependant considérablement réduite par rapport à avant. Avant le développement de l'agriculture, l'apport en potassium était de 10,5 g/jour, contre 3,4 g/jour en moyenne selon NVS II. En revanche, l'apport en sodium, qui était décalé dans l'inverse, n'était auparavant que de 0,8 g/jour. jour et a augmenté à une moyenne de 3,1 g/jour (femmes) et 4,3 g/jour (hommes) en raison de notre alimentation riche en sel. Cela affecte le rapport naturel potassium/sodium dans le corps humain.
Le potassium est l'antagoniste naturel du sodium et un rapport équilibré des deux minéraux est particulièrement important pour la régulation des processus physiologiques. Un apport excessif en sodium peut entraîner une déplétion potassique. A l'inverse, le potassium a un effet natriurétique. À cet égard, le rapport Na / K dans l'aliment est plus décisif que la concentration des cations individuels à eux seuls. L' OMS recommande un rapport molaire des deux minéraux de 1: 1. Les recommandations de l'OMS de moins de 2 g de sodium par jour et d'au moins 3,5 g de potassium par jour respectent ce ratio.
Importance physiologique
En plus du sodium, le potassium est d'une grande importance pour réguler la pression artérielle . Des études épidémiologiques montrent qu'une augmentation de l'apport en potassium est associée à une baisse de la pression artérielle et réduit le risque d'accident vasculaire cérébral. L'effet antihypertenseur du potassium a également été démontré dans des tentatives de supplémentation .
Le soi-disant DASH (Dietary Approaches to Stop Hypertension) alimentation (riche en céréales à grains entiers produits, fruits, légumes, la volaille, le poisson et les noix) pourrait aussi faible pression artérielle . Contrairement au régime habituel, ce régime contient moins de sel de table et de graisses saturées, une quantité relativement importante de potassium, mais aussi plus d'autres nutriments comme le magnésium et le calcium, qui sont également tenus pour responsables de l'abaissement de la tension artérielle. Pour cette raison, une alimentation riche en fruits et légumes (riche en potassium) associée à une réduction modérée de l'apport en sodium doit être recommandée, car un rapport sodium/potassium inférieur ou égal à 1 a un effet bénéfique sur la pression artérielle. Ajuster l'apport en potassium à un apport élevé en sodium n'a pas de sens. L' Autorité européenne de sécurité des aliments (EFSA) confirme également l'effet du sodium sur la tension artérielle.
Le potassium a également une influence positive sur le métabolisme osseux, car un apport élevé en potassium empêche l'excrétion accrue de calcium, qui est causée par un apport élevé en sel. Le potassium favorise ainsi la rétention rénale du calcium dans les reins et empêche la dégradation du calcium des os . Dans ce contexte, l'influence de l'anion d'accompagnement, la composition de l'aliment et l'âge sur le statut acido-basique doivent également être pris en compte. Des études cliniques ont montré que le citrate de potassium contrecarre la perte de calcium par les reins et la dégradation du calcium des os. Une étude d'intervention prospective contrôlée menée auprès de 161 femmes ménopausées atteintes d' ostéopénie a montré qu'une neutralisation partielle de l'exposition à l'acide induite par l'alimentation (en utilisant 30 mmol de citrate de potassium par jour, équivalent à 1,173 g de potassium) sur une période de douze mois augmente considérablement la densité osseuse et améliore considérablement l'os structure. Le citrate de potassium était tout aussi efficace que le raloxifène , un modulateur des récepteurs aux œstrogènes utilisé dans le traitement et la prévention de l' ostéoporose chez les femmes ménopausées.
Le potassium est un électrolyte important . Les ions potassium se trouvent principalement à l'intérieur de la cellule ( espace intracellulaire ) où ils participent au maintien du potentiel de repos . Par conséquent, des pertes élevées de potassium, telles que la transpiration abondante , peuvent entraîner des crampes et des états d'épuisement.
Les aliments riches en potassium ont un effet diurétique/déshydratant . Chez les patients dialysés présentant une insuffisance rénale , il est important qu'ils évitent les aliments riches en potassium, car cela peut provoquer une hyperkaliémie dans des conditions potentiellement mortelles.
L' injection létale utilisée pour les exécutions aux États-Unis contient, entre autres, du chlorure de potassium , qui paralyse les muscles cardiaques et entraîne ainsi la mort.
Pour plus d'informations sur les effets physiques du potassium
Niveaux de potassium dans les aliments
Les aliments riches en potassium comprennent les champignons, les bananes, les dattes, les raisins secs, les haricots, le piment, le fromage, les épinards et les pommes de terre, qui contiennent entre 0,2 et 1,0 g de potassium pour 100 g de nourriture.
Taux de potassium dans les aliments riches en potassium en mg pour 100 g ; de la base de données nationale sur les éléments nutritifs de l' USDA (2011)
| Nourriture 100 g | potassium |
|---|---|
| Soja (séché) | 1 800 mg |
| Abricots (séchés) | 1 370 mg |
| Son de blé | 1 350 mg |
| pistache | 1 020 mg |
| Pâte de tomate | 1 014 mg |
| Betteraves- feuilles (cuites) | 909 mg |
| lentilles | 840 mg |
| Raisins secs | 749 mg |
| Amandes | 705 mg |
| Jus d'orange concentré | 674 mg |
| cacahuète | 658 mg |
| Datte (Deglet Nour) | 656 mg |
| lait de soja | 638 mg |
| Châtaignes (grillées) | 592 mg |
| Farine de sarrasin (grain entier) | 577 mg |
| Anacardier | 565 mg |
| frites (huile végétale) | 550 mg |
| Pommes de terre (non pelées, cuites) | 535 mg |
| Soja (cuit) | 515 mg |
| avocat | 485 mg |
| Jus de pamplemousse (blanc) | 484 mg |
| Épinards (cuits) | 466 mg |
| Plantains (cuits) | 464 mg |
| haricots blancs | 454 mg |
| Purée de tomates | 439 mg |
| Haricots rouges (cuits) | 402 mg |
Étant donné que les sels de potassium contenus dans les aliments sont très solubles dans l'eau, la teneur en potassium des aliments peut être sensiblement réduite par ce qu'on appelle le trempage ( trempage dans l'eau pendant environ trois à cinq heures). Ceci est particulièrement important pour les personnes souffrant de troubles rénaux et métaboliques.
radioactivité
Le potassium naturel se compose de 0,0117 pour cent de l' isotope radioactif 40 K et a donc une activité spécifique de 31,6 becquerels par gramme. Avec 0,17 mSv par an, près de 10 pour cent de la dose de rayonnement naturel en Allemagne (une moyenne de 2,1 mSv par an) au propre potassium du corps.
Le 40 K se désintègre par désintégration β : avec une probabilité de 89 % par désintégration β - en calcium 40 stable et avec une probabilité de 11 % par désintégration β + - ou capture d'électrons (EC, K-capture) en argon 40 stable . La demi-vie est de 1,248 milliard d'années.
La désintégration de 40 K à 40 Ar est une source essentielle d'argon dans l'atmosphère terrestre et peut également être utilisée pour déterminer l'âge au moyen de la datation potassium-argon .
Particularité physique
Le potassium métallique peut selon une simulation informatique sous pression extrême être à la fois fixe et liquide car, selon la simulation alors bien que la plupart des atomes se trouvent dans des barres pleines , cependant, pour arranger certains atomes pour que le liquide soit. Sous une pression extrême , le potassium est un bloc solide d'où s'échappe en même temps du potassium liquide.
Preuve de potassium
En plus de la détection spectroscopique basée sur la couleur de la flamme , les ions potassium dissous dans l' eau peuvent être détectés et déterminés potentiométriquement avec une électrode sélective d'ions spécialisée en K + . La plupart des électrodes potassiques utilisent la complexation spécifique du potassium par la valinomycine C 54 H 90 N 6 O 18 , qui est noyée dans une membrane plastique à une concentration d'environ 0,7 %.
Une preuve qualitative du potassium est possible en utilisant l'acide perchlorique . Le perchlorate de potassium (KClO 4 ) , peu soluble dans l' eau à froid, se forme sous forme de précipité blanc . Cependant, d'autres forment des cations tels que le rubidium , le césium et le blanc d' ammonium , lourds dans les précipités solubles à froid .
Le potassium peut être dosé quantitativement à l'aide de la gravimétrie . Ici, le potassium est sous forme de tétraphénylborate de potassium (K [B (C 6 H 5 ) 4 ]) en ajoutant à la solution avec Kalignost précipité et le précipité résultant équilibré.
D'autres preuves sont possibles sous forme de précipitations d' hexanitrocobaltate de potassium (III) , d'hydrogéno tartrate de potassium (K A = 3,80 · 10 −4 ) et d'hexachloroplatinate de potassium (IV) .
Dans une analyse de routine ( chimie clinique ( sanguine ), chimie de l' environnement , la chimie de l' eau ), le potassium est déterminée quantitativement jusqu'au niveau de trace à l' aide photométrie de flamme . La limite de quantification évoquée ici est de 100 µg/l. En spectrométrie d'absorption atomique , 1 µg/l peut encore être détecté avec la technique de la flamme , et 0,004 µg/l avec la technique du four graphite.
liens
→ Catégorie : Composé de potassium
Dans ses composés, le potassium n'apparaît que sous forme de cation monovalent avec l'état d'oxydation 1.
Oxydes
L'oxyde de potassium est un solide blanc très réactif et a une structure cristalline antifluorite dans le système cristallin cubique du groupe d'espace Fm 3 m (groupe d'espace n° 225) . Là, les positions des anions et des cations sont inversées par rapport à leurs positions dans la fluorite , avec des ions potassium liés à 4 ions oxyde et des ions oxyde liés à 8 ions potassium.
Le peroxyde de potassium est un solide oxydant très réactif qui n'est pas lui-même inflammable , mais qui réagit violemment avec les substances inflammables . Il se décompose violemment au contact de l' eau . Il est utilisé comme oxydant et agent de blanchiment, ainsi que pour purifier l' air .
L'hyperoxyde de potassium est un composé jaune salé . Il se décompose dans l' eau pour former de l'hydroxyde de potassium , du peroxyde d'hydrogène et de l' oxygène .
Halogénures

Le chlorure de potassium forme des cristaux incolores, inodores et facilement solubles dans l'eau . Le chlorure de potassium est naturellement présent sous forme de sylvine . D'autres minéraux et roches courants contenant du potassium et du chlorure sont la carnallite (KCl · MgCl 2 · 6 H 2 O), la kaïnite (KCl · MgSO 4 · 3 H 2 O) et la sylvinite (KCl · NaCl). Il est utilisé dans l' industrie alimentaire comme agent raffermissant et exhausteur de goût . Il est utilisé pour la production d' engrais potassique et de presque tous les composés potassiques utilisés industriellement tels que le carbonate de potassium , l'hydroxyde de potassium utilisé.
Le fluorure de potassium est une poudre blanche hygroscopique qui se présente généralement sous forme de dihydrate . Il est utilisé pour la production d' émaux , en tant qu'additif pour ciment , en tant que composant dissolvant les oxydes des poudres de soudage d'aluminium, en tant que conservateur du bois et pour la gravure du verre .
Le bromure de potassium est utilisé pour la production d' argent - émulsions sur films et plaques pour films photographiques utilisés. Dans les révélateurs photographiques, il neutralise la formation de buée et retarde le développement.
L'iodure de potassium est en laboratoire pour la préparation de la solution d'iodure de potassium utilisée ( solution de Lugol). Il est également utilisé dans la production d' iodure d'argent et dans la production de produits pharmaceutiques et en chimie analytique pour la détection de certains composés .
Tous ces composés de potassium ont une structure cristalline cubique de la chlorure de sodium de type.
Plus de connexions
L'hydroxyde de potassium est un solide blanc, hygroscopique et inodore. Dans l' eau , il se dissout pour former l' hydroxyde de potassium à base forte , générant beaucoup de chaleur . En technologie des microsystèmes , il est utilisé pour la gravure anisotrope sélective du silicium monocristallin . En microbiologie, il est utilisé pour différencier les bactéries gram-positives et gram-négatives dans la procédure de test rapide . Il est utilisé comme électrolyte dans les capteurs galvaniques d'oxygène . Il remplit le même objectif dans les piles alcalines-manganèse très répandues et les batteries nickel-cadmium historiquement importantes . Il est utilisé comme régulateur d'acidité dans l' industrie alimentaire .
Le carbonate de potassium est une poudre blanche hygroscopique . Il a une structure cristalline monoclinique dans le groupe d'espace P 2 1 / c (groupe d'espace n° 14) . Il est utilisé dans la fabrication du verre , de la peinture et des révélateurs photographiques .
L'hydrogénocarbonate de potassium est utilisé comme agent de démoulage et régulateur d'acidité dans les aliments et comme agent levant .
Le chlorate de potassium est un sel blanc stable qui forme une solution incolore dans l' eau . La connexion a un fort pouvoir oxydant et servira entre autre à la fabrication d' allumettes , d' amorces et autres produits pyrotechniques utilisés.
Sous sa forme pure, le perchlorate de potassium forme des prismes rhombiques pouvant atteindre quelques centimètres. Le système cristallin est orthorhombique dans le groupe spatial Pnma (groupe spatial n° 62) . Il est souvent utilisé en pyrotechnie en raison de son fort effet allume-feu et de sa bonne durée de conservation , par exemple comme agent oxydant dans les éclairs . Il n'est que rarement utilisé dans les moteurs de fusée car il a été remplacé par le perchlorate d'ammonium .
Le nitrate de potassium est le composant principal de la poudre noire . Il est également utilisé pour la conservation des aliments utilisés.
Le sulfate de potassium est principalement utilisé comme engrais .
Le phosphate de potassium est utilisé comme additif dans les détergents , comme engrais et comme régulateur d'acidité dans les aliments .
Le bichromate de potassium est un sel d'orange. Il a une structure cristalline triclinique dans le groupe d'espace P 1 (groupe d'espace n° 2) . En laboratoire , il est utilisé comme agent oxydant , réactif pour la détection du peroxyde d' hydrogène et substance à titre basique en raison de sa bonne durée de conservation . En ingénierie, il est utilisé en tannerie , en galvanoplastie , sur des allumettes et pour la production d' acide chromosulfurique .
Le permanganate de potassium est un solide cristallin métallique, brillant , presque noir et un puissant agent oxydant .
L'hexacyanoferrate de potassium (II) forme des cristaux monocliniques jaunes . Par oxydation avec du peroxyde d'hydrogène ou du chlore, on peut produire du Kaliumhexacyanidoferrat (III) . Dans l' industrie alimentaire, il est utilisé comme agent de démoulage et stabilisant . Cependant, il ne peut être utilisé qu'en petites quantités dans les aliments , car du cyanure d' hydrogène peut se former lorsqu'il est chauffé ou lorsqu'il est exposé à des acides .
Le cyanure de potassium (cyanure) est le sel de potassium du cyanure d' hydrogène et est également très toxique. Il est utilisé dans les procédés de fabrication industrielle , où il est principalement utilisé pour l'extraction de l'or ( lixiviation au cyanure ) et dans les bains galvaniques , mais aussi en chimie organique de synthèse pour la production de nitriles .
Le tartrate acide de potassium (tartre) est un sel de l'acide tartrique . Il est produit lors du stockage du vin ou du jus de raisin . Il est utilisé pour produire de l'acide tartrique et, avec l'hydrogénocarbonate de sodium, comme agent levant .
Les savons sont des sels de sodium ou de potassium d' acides gras . Pour la production , les graisses sont bouillies avec une solution de soude caustique ou d'hydroxyde de potassium . Ce processus s'appelle l' ébullition du savon , la réaction chimique de saponification . Les graisses sont décomposées en glycérine et les sels alcalins des acides gras (les savons eux-mêmes). Alternativement, les savons peuvent être fabriqués directement à partir d'acides gras libres en les faisant réagir avec des alcalis pour former leurs sels . Les acides gras appropriés sont, par exemple, l' acide laurique , l' acide myristique , l' acide palmitique , l' acide stéarique , l' acide oléique et l' acide ricinoléique .
Preuve individuelle
- ↑ a b Harry H. Binder: Lexique des éléments chimiques. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Les valeurs des propriétés (encadré) sont prises à partir www.webelements.com (potassium) , sauf indication contraire .
- ↑ CIAAW, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Entrée sur le potassium dans Kramida, A., Ralchenko, Yu., Reader, J. et NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed. : NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Consulté le 11 juin 2020.
- ↑ a b c d e Entrée sur le potassium sur WebElements, https://www.webelements.com , consulté le 11 juin 2020.
- ^ NN Greenwood, A. Earnshaw : Chimie des éléments. 1ère édition. VCH, Weinheim 1988, ISBN 3-527-26169-9 , page 97.
- ↑ Robert C. Weast et al (éd.) : CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , pp. E-129 à E-145. Les valeurs y sont basées sur g / mol et données en unités cgs. La valeur spécifiée ici est la valeur SI calculée à partir de celle-ci, sans unité de mesure.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang : valeurs corrigées pour les points d'ébullition et les enthalpies de vaporisation des éléments dans les manuels. Dans : Journal of Chemical & Engineering Data. 56, 2011, pp. 328-337, doi : 10.1021 / je1011086 .
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing : Corps solide. (= Manuel de physique expérimentale . Volume 6). 2e édition. De Gruyter, Berlin 2005, ISBN 3-11-017485-5 , p.361 .
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Electrochemical Series, pp. 8-22.
- ↑ a b Entrée sur le potassium dans la base de données des substances GESTIS de l' IFA , consultée le 16 décembre 2019. (JavaScript requis)
- ↑ Entrée sur le potassium dans l' inventaire des classifications et étiquetages de l' Agence européenne des produits chimiques (ECHA), consulté le 1er août 2016. Les fabricants ou les distributeurs peuvent étendre la classification et l'étiquetage harmonisés .
- ^ A b Statistiques et informations sur la potasse . Commission géologique des États-Unis.
- ^ David J. Wishart : Encyclopédie des Grandes Plaines . U of Nebraska Press, 2004, ISBN 978-0-8032-4787-1 , page 433.
- ^ Une nouvelle technique trouve des métaux gazeux dans les atmosphères d'exoplanètes wired.com, 31 août 2010.
- ↑ Astronomers Find Potassium in Giant Planet's Atmosphere sciencedaily.com, 1er septembre 2010 (consulté le 20 septembre 2010).
- ↑ AE van Arkel, P. Aßmann, G. Borelius, G. Chaudron, EJ Daniels, R. Gadeau, W. Geibel, W. Graßmann, CR Hayward, G. Jantsch, W. Kroll, K. Lins : Reine Metals : Production · Propriétés · Utilisation , éditeur AE van Arkel, Verlag Springer-Verlag, 2013, ISBN 9783642996955 .
- ↑ Georg Brauer : Métaux alcalins libres . Dans : Manuel de chimie inorganique préparatoire . Ferdinand Enke Verlag, Stuttgart 1954, p. 724 ff .
- ^ PE Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth : Explosion de Coulomb pendant les premières étapes de la réaction des métaux alcalins avec l'eau. Dans : Chimie de la nature. Volume 7, numéro 3, mars 2015, pp. 250-254, doi: 10.1038 / nchem.2161 , PMID 25698335 .
- ↑ Freie Universität Berlin , Institute for Chemistry and Biochemistry Disposal of Potassium ( Souvenir du 13 décembre 2013 dans l'archive web archive.today )
- ↑ J. Evers, TM Klapötke , G. Oehlinger : Croûte dangereuse d'hydroxyde de potassium monohydraté. Dans : Chemical & Engineering News , 80 (37), pp. 2, 4.
- ↑ GLCM van Rossen, H. van Bleiswijk : A propos du diagramme d'état des alliages potassium-sodium. Dans : Z. anorg. Allg. Chem. , 1912, 74, pages 152-156. doi: 10.1002 / zaac.19120740115 .
- ↑ Konrad Mengel: Nutrition et métabolisme de la plante. 7e édition. Fischer, Iéna 1991, ISBN 3-334-00310-8 , p. 335-346.
- ↑ Shieh et al : Canaux potassiques : défauts moléculaires, maladies et opportunités thérapeutiques. Dans: Pharmacol Rev . 52 (4), déc. 2000, pp. 557-594, PMID 11121510 .
- ^ Tamargo et al : Pharmacologie des canaux potassiques cardiaques. Dans : Cardiovasc Res . 62 (1), 1 avril 2004, p. 9-33, PMID 15023549 .
- ↑ Niemeyer et al. : Modulation du canal K+ sensible à l'acide du domaine à deux pores TASK-2 (KCNK5) par des changements de volume cellulaire. Dans : J Biol Chem . 276 (46), 16 novembre 2001, pp. 43166-43174, PMID 11560934 .
- ↑ Shen et al. : L'isoforme de cotransporteur KCl KCC3 peut jouer un rôle important dans la régulation de la croissance cellulaire. Dans : Proc Natl Acad Sci USA . 98 (25), 4 déc 2001, p. 14714-14719, PMID 11724933 .
- ↑ Young et al. : Déterminants de la fibrose cardiaque dans les états hyperminéralocorticoïdes expérimentaux In : Am J Physiol-Endocrinol Metab . 269 (4 Pt 1), oct. 1995, pp. E657-E662, PMID 7485478 .
- ↑ Young & Ma: effets protecteurs vasculaires de potassium. Dans : Semin Néphrol . 19, 1999, pp. 477-486, PMID 10511387 .
- ↑ Krishna : Effet de l'apport en potassium sur la tension artérielle. Dans : J Am Soc Nephrol . 1 (1), juillet 1990, pp. 43-52, PMID 2104250 .
- ^ Suter : Potassium et hypertension. Dans : Nutr Rev. 56 (5 Pt 1), mai 1998, pp. 151-153, PMID 9624886 .
- ↑ Young et al : Mécanismes de protection cardiovasculaire du potassium. Dans : Am J Physiol-Regul Integr Comp Physiol . 268 (4 Pt 2), avril 1995, pp. R825-R837, PMID 7733391 .
- ^ Tannen : L'influence du potassium sur la pression artérielle. Dans : Rein Int Suppl . 22, 1987, pages S242-S248, PMID 3323616 .
- ↑ Frassetto et al. : Alimentation, évolution et vieillissement - les effets physiopathologiques de l'inversion post-agricole des rapports potassium/sodium et base/chlorure dans l'alimentation humaine. Dans : Eur J Nutr. 40 (5), octobre 2001, pp. 200-213, PMID 11842945 .
- ↑ Frassetto et al. : Estimation de la production nette endogène d'acide non carbonique chez l'homme à partir des teneurs en potassium et en protéines de l'alimentation. Dans : Am J Clin Nutr. 68 (3), sept. 1998, pp. 576-583, PMID 9734733 .
- ↑ Frassetto et al. : Le bicarbonate de potassium réduit l'excrétion urinaire d'azote chez les femmes ménopausées. Dans : J Clin Endocrinol Metab . 82 (1), janvier 1997, pp. 254-259, PMID 8989270 .
- ↑ Manz et al. : Facteurs affectant la capacité d'excrétion rénale des ions hydrogène chez les enfants en bonne santé. Dans : Pédiatre Néphrol . 16 (5), mai 2001, pp. 443-445, PMID 11405120 .
- ↑ Remer et al. : Charge potentielle d'acide rénal alimentaire et excrétion rénale nette d'acide chez des enfants et des adolescents en bonne santé et vivant en liberté. Dans : Am J Clin Nutr. 77 (5), mai 2003, pp. 1255-1260, PMID 12716680 .
- ^ Remer : Influence de l'alimentation sur l'équilibre acido-basique. Dans : Semin Dial. 13 (4), juillet-août 2000, pp. 221-226, PMID 10923348 .
- ↑ Tannen : Effet du potassium sur l'acidification rénale et l'homéostasie acido-basique. Dans : Semin Néphrol . 7 (3), septembre 1987, pp. 263-273, PMID 2825318 .
- ↑ Autorité européenne de sécurité des aliments : EFSA Journal. 8 (2), 2010, p.1469.
- ↑ Institut fédéral d'évaluation des risques : Utilisation de minéraux dans les aliments : Aspects toxicologiques et physiologiques .
- ↑ Curhan et al. : Comparaison du calcium alimentaire avec un supplément de calcium et d'autres nutriments en tant que facteurs affectant le risque de calculs rénaux chez les femmes. Dans : Ann Intern Med . 126 (7), 1er avril 1997, p. 497-504. PMID 9092314 .
- ↑ Hirvonen et al. : Apport nutritionnel et consommation de boissons et risque de calculs rénaux chez les hommes fumeurs. Dans : Am J Epidemiol. 150 (2), 15 juillet 1999, p. 187-194. PMID 10412964 .
- ↑ Keßler & Hesse : Étude croisée de l'influence de l'eau minérale riche en bicarbonate sur la composition urinaire en comparaison avec le citrate de sodium et de potassium chez des sujets masculins sains. Dans : Br J Nutr. 84 (6), déc. 2000, p. 865-871. PMID 11177203 .
- ↑ Macdonald et al. : Associations nutritionnelles avec la perte osseuse lors de la transition ménopausique : mise en évidence d'un effet bénéfique du calcium, de l'alcool et des nutriments des fruits et légumes et d'un effet néfaste des acides gras. Dans : Am J Clin Nutr. 79 (1), janvier 2004, p. 155-165. PMID 14684412 .
- ↑ Morris et al. : Effets différents des suppléments de KCl et de KHCO3 : implications physiopathologiques et cliniques. Dans : Semin Néphrol. 19 (5), sept. 1999, pp. 487-493. PMID 10511388 .
- ↑ Sellmeyer et al : Le citrate de potassium prévient l'augmentation de l'excrétion urinaire du calcium et la résorption osseuse induites par un régime riche en chlorure de sodium. Dans : J Clin Endocrinol Metab. 87 (5), mai 2002, p. 2008-2012. PMID 11994333 .
- ^ A b Suter : Les effets du potassium, du magnésium, du calcium et des fibres sur le risque d'accident vasculaire cérébral. Dans : Nutr Rev. 57 (3), mars 1999, pp. 84-88. PMID 10101922 .
- ↑ a b Institut Max Rubner, Institut fédéral de recherche pour la nutrition et l'alimentation (2008) Étude nationale de consommation II. Rapport sur les résultats, partie 2. L'enquête nationale sur la nutrition des adolescents et des adultes. ( Memento du 28 décembre 2013 dans Internet Archive ) (PDF; 3,3 Mo).
- ↑ a b Eaton et al. Nutrition paléolithique revisité: une rétrospective de douze ans sur sa nature et ses implications. Dans : Eur J Clin Nutr. 51 (4), 1997, p. 207-216. PMID 9104571 .
- ^ P. Elliott, I. Brown : Apports de sodium dans le monde. Document de référence préparé pour le Forum et la réunion technique sur la réduction de l'apport en sel dans les populations (Paris 5-7 octobre 2006) . (PDF; 2,2 Mo).
- ↑ a b Organisation mondiale de la santé : Ligne directrice : Apport de potassium pour les adultes et les enfants. Genève 2012. (PDF; 564 Ko).
- ^ Organisation mondiale de la santé : Stratégie mondiale sur l'alimentation, l'activité physique et la santé. Stratégies de réduction du sodium dans la population . Consulté le 13 décembre 2013.
- ↑ Suter et al. : Facteurs nutritionnels dans le contrôle de la pression artérielle et de l'hypertension. Dans : Nutr Clin Care, 5 (1), janvier-février 2002, pp. 9-19, PMID 12134718 .
- ↑ Tobian : Le chlorure de sodium et le potassium alimentaires ont des effets sur la physiopathologie de l'hypertension chez l'homme et l'animal. Dans : Am J Clin Nutr. 65 (2 suppl), février 1997, pp. 606S-611S, PMID 9022555 .
- ↑ Bazzano et al : Apport alimentaire en potassium et risque d'AVC chez les hommes et les femmes aux États-Unis : National Health and Nutrition Examination Survey I étude épidémiologique de suivi. Dans : AVC. 32 (7), juillet 2001, pp. 1473-1480, PMID 11441188 .
- ↑ Ascherio et al. : Apport de potassium, magnésium, calcium et fibres et risque d'accident vasculaire cérébral chez les hommes américains. Dans : Circulation. 98 (12), 22 septembre 1998, p. 1198-1204, PMID 9743511 .
- ↑ Barri & Wingo : Les effets de la déplétion potassique et de la supplémentation sur la tension artérielle : une revue clinique. Dans : Am J Med Sci. 314 (1), juillet 1997, pp. 37-40, PMID 9216439 .
- ↑ Geleijnse et al. : Les électrolytes sont associés à la tension artérielle à un âge avancé : l'étude de Rotterdam. Dans : J Hum Hypertens. 11 (7), juillet 1997, pp. 421-423, PMID 9283057 .
- ↑ Khaw & Barrett-Connor : Potassium alimentaire et tension artérielle dans une population. Dans : Am J Clin Nutr. 39 (6), juin 1984, pp. 963-968, PMID 6720624 .
- ↑ Khaw & Barrett-Connor : Fibres alimentaires et réduction des taux de mortalité par cardiopathie ischémique chez les hommes et les femmes : une étude prospective de 12 ans. Dans : Am J Epidemiol. 126 (6), déc. 1987, pp. 1093-1102, PMID 2825519 .
- ↑ Siani et al. : Essai contrôlé de suppléments potassiques oraux à long terme chez des patients souffrant d'hypertension légère. Dans : Br Med J (Clin Res Ed). 294 (6585), 6 juin 1987, pp. 1453-1456, PMID 3300841 .
- ↑ Svetkey et al. : Essai en double aveugle, contrôlé par placebo, du chlorure de potassium dans le traitement de l'hypertension légère. Dans : Hypertension. 9 (5), mai 1987, pp. 444-450, PMID 3570421 .
- ↑ Sacks et al. : Effets sur la pression artérielle de la réduction du sodium alimentaire et du régime Dietary Approaches to Stop Hypertension (DASH). Groupe de recherche collaborative DASH-Sodium. Dans : N Engl J Med . 344 (1), 4 janvier 2001, pp. 3-10, PMID 11136953 .
- ↑ Vollmer et al. : De nouvelles connaissances sur les effets sur la tension artérielle des régimes pauvres en sel et riches en fruits et légumes et en produits laitiers faibles en gras. Dans : Curr Control Trials Cardiovasc Med.2 (2), 2001, pp. 71-74, PMID 11806776 .
- ↑ Zemel : Régime alimentaire et hypertension : l'étude DASH. Approches diététiques pour stopper l'hypertension. Dans : Nutr Rev. 55 (8), août 1997, pp. 303-305, PMID 9287480 .
- ↑ Institut fédéral d'évaluation des risques : Utilisation de minéraux dans les aliments.
- ↑ Autorité européenne de sécurité des aliments : EFSA Journal. 8 (2), 2010, p.1469.
- ↑ Harrington, Cashman : Un apport élevé en sel semble augmenter la résorption osseuse chez les femmes ménopausées, mais un apport élevé en potassium atténue cet effet indésirable. Dans : Nutr Rev. 61 (5 Pt 1), mai 2003, pp. 179-183, PMID 12822707 .
- ↑ Lemann et al. : L'administration de potassium réduit et la privation de potassium augmente l'excrétion urinaire de calcium chez les adultes en bonne santé. Dans : Rein Int. 39 (5), mai 1991, pp. 973-983, PMID 1648646 .
- ↑ New et al. : Des estimations plus faibles de la production endogène nette d'acide non carbonique sont positivement associées à des indices de santé osseuse chez les femmes préménopausées et périménopausées. Dans : Am J Clin Nutr. 79 (1), janvier 2004, p. 131-138. PMID 14684409 .
- ↑ Barzel : Le squelette comme système d'échange d'ions : implications pour le rôle du déséquilibre acido-basique dans la genèse de l'ostéoporose. Dans : J Bone Miner Res . 10 (10), octobre 1995, pp. 1431-1436, PMID 8686497 .
- ↑ Frassetto et al. : Effet de l'âge sur la composition acido-basique du sang chez l'homme adulte : rôle du déclin fonctionnel rénal lié à l'âge. Dans : Am J Physiol. 271 (6 Pt 2), décembre 1996, pp. F1114-F1122, PMID 8997384 .
- ↑ Lemann : Relation entre le calcium urinaire et l'excrétion acide nette telle que déterminée par les protéines alimentaires et le potassium : une revue. Dans : Néphron. 81 Suppl 1, 1999, pp. 18-25, PMID 9873210 .
- ↑ Massey : Protéines alimentaires animales et végétales et santé osseuse humaine : une approche des aliments complets. Dans : J Nutr. 133 (3), mars 2003, p. 862S-865S, PMID 12612170 .
- ↑ Morris et al. : Effets différents des suppléments de KCl et de KHCO 3 : implications physiopathologiques et cliniques. Dans : Semin Néphrol. 19 (5), sept. 1999, pp. 487-493, PMID 10511388 .
- ^ Remer et Manz : N'oubliez pas le statut acido-basique lors de l'étude des effets métaboliques et cliniques de la déplétion alimentaire en potassium. Dans : J Clin Endocrinol Metab. 86 (12), décembre 2001, pp. 5996-5997, PMID 11739479 .
- ^ Remer : Influence de l'alimentation sur l'équilibre acido-basique. Dans : Semin Dial. 13 (4), juillet-août 2000, pp. 221-226, PMID 10923348 .
- ↑ un b S. Jehle et al. La neutralisation partielle du régime alimentaire occidental acidogène avec la masse osseuse augmente de citrate de potassium chez les femmes ménopausées souffrant d' ostéopénie. Dans : J Am Soc Nephrol. 17, 2006, p. 3213-3222, PMID 17035614 .
- ↑ M. Marangella et al. : Effets de la supplémentation en citrate de potassium sur le métabolisme osseux. Dans : Calcif Tissue Int. 74, 2004, p. 330-335, PMID 15255069 .
- ↑ DE Sellmeyer et al. : Le citrate de potassium prévient l'augmentation de l'excrétion urinaire du calcium et la résorption osseuse induite par un régime riche en chlorure de sodium. Dans : J Clin Endocrinol Metab. 87, 2002, p. 2008-2012, PMID 11994333 .
- ↑ USDA National Nutrient Database for Standard Reference, Release 24 Content of Selected Foods per Common Measure, Potassium, K (mg) trié par teneur en éléments nutritifs ( Memento du 5 avril 2013 dans Internet Archive ) (PDF; 150 ko).
- ↑ abricot sec . Site Web du réseau allemand de conseils et d'informations sur la nutrition. Consulté le 21 octobre 2012.
- ↑ Régime pauvre en potassium - Conseils pratiques .
- ↑ Office fédéral de la radioprotection : Quels radionucléides trouve-t-on dans les aliments ? Consulté le 19 août 2014.
- ^ C. Michael Lederer, Jack M. Hollander, Isadore Perlman : Tableau des isotopes, John Wiley & Sons , New York, 1967.
- ↑ Potassium-40 - avec une demi-vie de 1,28 milliard d'années, durable et radioécologiquement pertinent
- ↑ Livechart - Tableau des nucléides - Données sur la structure nucléaire et la désintégration. Consulté le 11 février 2020 .
- ↑ Table des nucléides. Consulté le 11 février 2020 .
- ^ Andreas Hermann : Les éléments peuvent être à la fois solides et liquides. Dans : Actualités - Université d'Edimbourg . 9 avril 2019, consulté le 10 avril 2019 .
- ↑ a b Karl Cammann (Ed.) : Chimie analytique instrumentale. Spektrum, Heidelberg 2001, ISBN 3-8274-0057-0 , p. 4-60.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 102e édition. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , page 1286.
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 101e édition. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 , page 1176.
- ↑ entrée sur le chlorure de potassium dans la base de données de substance GESTIS de l' IFA , consulté le 17 Décembre 2 019. (JavaScript requis)
- ↑ S.-P. Ballstaedt, P. Reinhard, M. Rentschler, E. Rottländer, AA Bodenstedt, D. Briesen, A. Bruckhaus, J. Büschenfeld, A. Hauptmann, DA Hiller : Changement de sols par influences anthropiques : Un livre d'étude interdisciplinaire , Verlag Springer Berlin Heidelberg, 1997, ISBN 3-540-61556-3
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 101e édition. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 , page 1170.
- ↑ Accès à l' hydroxyde de potassium dans la base de données de substance GESTIS de l' IFA , consulté le 17 Décembre 2 019. (JavaScript requis)
- ↑ Y. Idemoto, JW Richardson, N. Koura, S. Kohara, CK Loong : Structure cristalline de (Li x K 1-x ) 2 CO 3 (x = 0,0,43,0,5,0,62,1) par diffraction de neutrons sur poudre une analyse. Dans : Journal of Physics and Chemistry of Solids , 59, 1998, pp. 363-376, doi : 10.1016 / S0022-3697 (97) 00209-6 .
- ↑ JK Brandon, ID Brown : Une détermination précise de la structure cristalline du dichromate de potassium triclinique, K 2 Cr 2 O 7 . Dans : Revue canadienne de chimie . ruban 46 , non. 6 , 15 mars 1968, p. 933-941 , doi : 10.1139 / v68-155 ( PDF ).
- ↑ Axel Trautmann, Jörg Kleine-Tebbe : Allergologie en clinique et en pratique Allergènes - Diagnostic - Thérapie . Georg Thieme Verlag, 2013, ISBN 978-3-13-159352-8 , p. 227 ( aperçu limité dans la recherche Google Book).
- ↑ Hans-Dieter Jakubke, Ruth Karcher (éd.) : Lexicon of Chemistry , Spectrum Academic Publishing House, Heidelberg, 2001.