Réaction de Wittig
La réaction de Wittig est une réaction organique-chimique qui sert à créer des liaisons C = C et porte le nom de son découvreur Georg Wittig . Il peut être utilisé pour oléfiner des composés carbonylés ( aldéhydes ou cétones ) avec des phosphorylures en substituant l' oxygène du carbonyle pour former des alcènes :
En tant que réaction de formation d'oléfines, il est d'une grande importance dans les laboratoires et l'industrie. La réaction de Wittig est une méthode largement applicable pour la synthèse d'oléfines et tolère une grande variété de groupes fonctionnels . Normalement, seuls les groupes fonctionnels très acides tels que les acides carboxyliques ou les composés 1,3-dicarbonylés s'avèrent perturber la réaction de Wittig .
Général
Des variantes inter- et intramoléculaires sont connues dans la réaction de Wittig. La réaction est régiosélective , c'est-à-dire que la double liaison carbone-carbone nouvellement formée remplace les doubles liaisons carbone-oxygène antérieures. Les aldéhydes et les cétones entrent en ligne de compte en tant que composants carbonylés, les aldéhydes étant plus réactifs et les cétones moins encombrées stériquement pouvant être sélectivement oléfinées par rapport aux cétones encombrées stériquement. Les esters d'acide carboxylique sont presque inertes dans une réaction de Wittig.
Un inconvénient est la sélectivité en principe peu prononcée ( E , Z ), qui peut cependant être contrôlée par des conditions de réaction appropriées. En raison de sa grande tolérance aux groupes fonctionnels, la réaction de Wittig peut elle-même entraîner un grand nombre de groupes fonctionnels dans le réactif de Wittig.
La réaction de Wittig est utilisée dans la synthèse de substances naturelles oléfiniques telles que les vitamines A et D, les caroténoïdes ( β-carotène voir ci-dessous), le squalène, les phéromones insaturées , les hormones d'insectes, les parfums et les prostaglandines .
histoire
Découverte
Dans ses expériences sur la quaternisation des principaux éléments du groupe, Wittig a obtenu un zwitterion qui présentait des propriétés remarquables.
En présence de composés carbonylés, ils réagissent doucement avec le carbone carbonyle pour former une double liaison carbone-carbone et de l'oxyde de triphénylphosphine .
Wittig a publié cette nouvelle réaction, découverte en 1947 à l' Université de Tübingen , sous le titre About triphenyl-phosphine-methylene as olefin-forming reagents et dorénavant appelé cette réaction carbonyl-oléfination . Cependant, le nom de réaction de Wittig a été utilisé plus tard. Aujourd'hui, le sel de triphénylalkylphosphonium est généralement utilisé comme sel de Wittig pour cette réaction et l'oxyde de triphénylphosphine est obtenu comme sous-produit .
La réaction de Wittig s'est rapidement avérée très polyvalente et universellement applicable. Georg Wittig a reçu le prix Nobel de chimie en 1979 .
Premières applications industrielles
BASF a pris note de la nouvelle méthode avec enthousiasme. Il a permis d'utiliser une brique synthétique existante [dérivé du (2 E , 4 E ) -3-méthyl-5- (2,6,6-triméthylcyclohex-1-en-1-yl) pentane] avec la facilité accessible (2 E , 4 E , 6 E ) -2,7-dimethylocta-2,4,6-trienedial pour se lier au β- carotène . Un brevet a été déposé (BASF) trois ans seulement après la publication de Wittig.

Faire les ylides
Les alkyles/aryles phosphorés trisubstitués peuvent être quaternisés dans une réaction S N 2 . Par exemple, la triphénylphosphine ( 1 ) réagit avec le bromure d'éthyle ( 2 ) pour former un sel de phosphonium via le bromure d' éthyl triphénylphosphonium ( 3 ) pour former un ylure ( 4 ) et un ylène :

La triphénylphosphine ( 1 ) et le bromure d'éthyle ( 2 ) sont chauffés à 130°C en autoclave dans le benzène pendant 20 heures. Le sel de phosphonium précipite sous forme cristalline au refroidissement (rendement 90%).
Les phosphines sont de bons nucléophiles, mais de mauvaises bases. Pour cette raison, l' élimination de E2 en compétition avec la réaction S N 2 est presque complètement supprimée. La plupart des halogénures d'alkyle primaires et secondaires peuvent être convertis en leurs sels de phosphonium avec de bons rendements.
Contrairement aux halogénures de phosphonium pour la plupart isolés, les ylures produits à partir d'eux par déprotonation au niveau de l'atome α-C sont généralement encore convertis directement.
Le bromure d'éthyltriphénylphosphonium ( 3 ) est déprotoné à l'hydrure de sodium sous gaz inerte dans le DMSO .
Il se forme un composé de phosphore extérieurement neutre, connu sous le nom d'ylure ( 4 ) ou de phosphorane. Ces bétaïnes peuvent également être formulées sous forme d' Ylene . D'autres réactifs de déprotonation courants sont le phényllithium ou le n - butyllithium .
Une méthode moderne et simple pour déprotoner l'ion phosphonium dans des conditions sans lithium est l'utilisation de tert- butanolate de potassium dans le THF ou, dans le cas de groupes carbonyle à encombrement stérique, dans le toluène . Le sel de Wittig peut être mélangé à sec avec la base dans des proportions équimolaires et mélangé avec le solvant, ce qui est une alternative à l' ylure instantanée plus facile à utiliser . Les ylures de phosphore peuvent également être obtenus par addition de carbène à des phosphines.
Mécanismes de la réaction de Wittig
Le mécanisme de la réaction de Wittig peut être vu de manière générale ou d'un point de vue stéréochimique.
Réaction de Wittig, en général
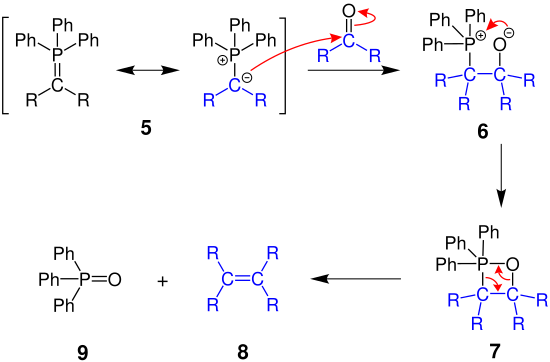
Le mécanisme suivant explique la réaction générale de Wittig, dans laquelle les phosphorylures réagissent avec les composés carbonylés pour former des alcènes.
L'atome de carbone chargé négativement du phosphorylide 5 attaque le composé carbonylé du matériau de départ et une phosphore bétaïne 6 est formée , qui réagit en outre pour former l'oxaphosphétane 7 , un cycle à quatre chaînons. Celui-ci se décompose finalement en alcène 8 et en oxyde de triphénylphosphine 9 en raison de la forte double liaison phosphore-oxygène.
Réaction de Wittig, aspects stéréochimiques
Globalement, le mécanisme n'a pas encore été précisément clarifié, ou il se déroule différemment selon les substituants. Pour la plupart, la réaction se déroule en plusieurs étapes ; les interconnexions individuelles peuvent être isolées. Dans le cas des composés réactifs ylidène/carbonyle, l'attaque du carbanion et la formation de l'oxaphosphétane se déroulent de concert selon les règles de Woodward-Hoffmann . Il est également prouvé que la présence de substituants très grand (de l' encombrement stérique de haut), la réaction par des niveaux de radicaux libres (SET s Ingle e Lectron t ransfert) se prolonge.
Lorsque la bétaïne est formée, il est déterminé si l'alcène est configuré ( E ) ou ( Z ). Cependant, la première étape est partiellement réversible.
- Dans le cas d'une addition réversible, le produit d'addition thermodynamiquement plus stable est formé dans ces cas (contrôle de la réaction thermodynamique).
- Dans le cas d'une addition irréversible, il se forme le produit qui se forme plus rapidement (énergie d'activation plus faible ; contrôle de la réaction cinétique).
Peu de temps après la découverte, il a été reconnu que la réaction de Wittig est généralement assez diastéréosélective. En fonction de la réactivité des composants ylure/carbonyle utilisés, la diastéréosélectivité peut être spécifiquement modifiée en choisissant les substituants (à la fois sur l'ylure et sur le composé carbonyle) et les conditions de réaction, le rapport de rendement des isomères. Comme la réactivité du carbonyle est habituellement donnée, des tentatives sont faites pour influencer la diastéréosélectivité en ajustant la réactivité de l'ylure. La règle générale :
| Réactivité du composé carbonylé | ||||
|---|---|---|---|---|
| haute | milieu | meugler | ||
| Réactivité de l' ylure | ||||
| haute | ( Z ) | ( Z ) | ( E , Z ) | |
| milieu | ( Z ) | ( E , Z ) | ( E , Z ) | |
| meugler | ( E ) | ( E ) | ( E ) | |
Possibilités de faire varier la réactivité de l'oxaphosphétane
La déstabilisation peut avoir lieu en remplaçant les substituants sur le phosphore par des donneurs π/σ. Les ( Z )-oléfines sont alors généralement formées avec des rendements élevés .
La stabilisation peut avoir lieu en remplaçant les substituants sur le phosphore par des accepteurs /σ. Les ( E )-oléfines sont alors généralement formées avec des rendements élevés .
Multi-étage (composants moins réactifs)
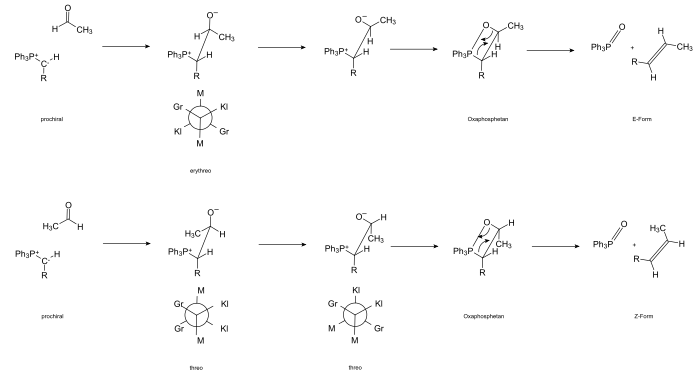
La réaction est initiée par l'attaque du carbanion sur l'atome de carbone carbonyle polarisé positivement et la formation de bétaïne. Le composé carbonylé est dans la plupart des cas prochiral ; H. Lorsque la bétaïne est formée, un nouveau centre de chiralité est formé qui, selon le côté d'attaque, est (pro- R ou pro- S ) ( R ) ou ( S ) -configuré.
Le carbanion d'Ylides est également prochiral. Il y a donc une formation intermédiaire d'un composé qui contient deux atomes de carbone chiraux adjacents. Selon le type d'arrangement des substituants, il existe deux formes différentes qui peuvent être attribuées aux glucides thréose et érythrose . À des fins de nommage, les substituants sont triés en fonction de leur taille. Si une conformation apparaît (par rotation autour de l'axe CC) dans laquelle les substituants grand, moyen et petit se font face, on parle de forme érythro , alternativement de forme thréo . Le passage par le stade intermédiaire de la bétaïne a pu être démontré en isolant des représentants stables.
La bétaïne réagit via la conformère, ce qui permet une cycloaddition thermique [2 + 2] pour former l'oxaphosphétane cyclique. L'existence de l'intermédiaire à quatre noyaux peut être démontré par 31 spectroscopie P-RMN. L'oxaphosphétane formé à -80°C est stable à ces températures. Il se décompose lorsqu'il est chauffé à 0°C.
Une rétro - [2 + 2] cycloaddition conduit à la formation d'oxyde de triphénylphosphine et du ( E ) -alcène.
Concerté (composants plus réactifs)
Dans le cas des ylures non stabilisés, la réaction est rapide. En raison de l'attraction de Coulomb, les réactifs se rapprochent orthogonalement (les atomes polarisés positivement s'attachent à chacun chargé négativement). Dans le même temps, les « gros » groupes méthyle sont positionnés le plus loin possible les uns des autres pour des raisons stériques. La liaison est formée par torsion du complexe de transition et cycloaddition concertée [2 s +2 a ] (fermeture de cycle disrotatoire). L'étape intermédiaire de la bétaïne est pratiquement ignorée.
Le Z- oxaphosphétane est finalement formé via un quadricycle « torsadé » .
Réactions secondaires
Les ylures non stabilisés sont instables à l'oxygène et à l'eau. L'hydrolyse transforme un ylure en un oxyde de phosphine et un hydrocarbure.
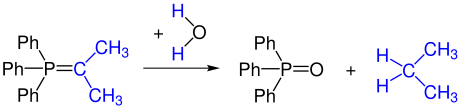
Une partie de l'ylure peut être réoxydée pour former le composé carbonylé par réaction partielle avec l'oxygène (ou par ajout d'agents oxydants). Ce composé carbonylé réagit avec un autre ylure pour former un alcène.

Ces réactions secondaires sont généralement indésirables et réduisent le rendement, c'est pourquoi on travaille sous gaz inerte et à l'abri de l'humidité. Cependant, certaines de ces réactions sont également utilisées en préparation.
Réactions de Wittig énantiosélectives
En utilisant des ligands phosphorés chiraux, Trost et Curran ont atteint un excès énantiomérique ( ee ) de 30 à 40 % dans une réaction de Wittig intramoléculaire . Regardez là.
Réactions de type Wittig
Avec d'autres composés carbonylés et hétérocarbonylés
Les ylures de phosphore réagissent également de manière similaire avec d'autres composés carbonylés que les aldéhydes ou les cétones, par exemple avec les cétènes , avec les isocyanates , avec divers anhydrides et imines .

Ylides d'arsenic
Comme cela, l'homologue du phosphore forme des sels d'arsonium quaternaire, qui peuvent également être déprotonés avec des bases en position . Ces ylures d'arsenic se comportent comme des ylures d'azote dans l'oléfination carbonylée.
Exemples
La polyvalence de la réaction de Wittig est illustrée dans la figure suivante à l'aide de quelques exemples :
Limites de la réaction de Wittig
Un inconvénient de la réaction de Wittig est qu'elle est limitée aux aldéhydes et aux cétones (voir ci-dessus pour les exceptions). Les dérivés d'acide carboxylique sont plus ou moins inertes vis-à-vis des ylures. La réaction de Wittig nécessite également des conditions basiques qui peuvent initier des réactions secondaires telles que des éliminations ou des racémisations. Des réactifs d'oléfination alternatifs sont, par exemple, dans les composés titanocènes (voir réaction de Tebbe ).
Alternatives à la réaction de Wittig
L'oléfination de Peterson , l' oléfination de Julia et la réaction de Tebbe . De plus, la métathèse .
variantes
- Réaction de Horner-Wadsworth-Emmons
- Variante de Schlosser de la réaction de Wittig
- Takai oléfination
Littérature
- Thomas Laue, Andreas Plagens : Nom et mots clés des réactions en chimie organique. 5e édition. Vieweg + Teubner-Verlag, 2006, ISBN 3-8351-0091-2 .
- Marcel Hoffmann : Développement des réactions catalytiques de Wittig. Berlin, Mensch - & - Buch-Verlag, 2014, ISBN 978-3-86387-476-6 .
Preuve individuelle
- ↑ G. Wittig, G. Geissler : A la réaction du pentaphényl-phosphore et de certains dérivés . Dans : Liebigs Ann. Chem. Band 580 , non. 1 , 1953, p. 44-57 , doi : 10.1002 / jlac.19535800107 .
- ↑ G. Wittig, U. Schöllkopf : À propos du triphényl-phosphine-méthylène en tant que réactifs formant des oléfines . Dans : Rapports chimiques . ruban 87 , non. 9 , 1954, p. 1318-1330 , doi : 10.1002 / cber.19540870919 .
- © G. Wittig, H. Pommer : DBP 954247 , 1956.
- © G. Wittig, H. Pommer : Dans : Chem.Abstr. 53, 1959, page 2279.
- ↑ a b Heinz G. Becker et al. (Ed.): Organikum . Stage de base en chimie organique . Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3 .
- ↑ L. Fitjer, U. Quabeck: Dans Chem . Commun. 15, 1985, pages 855-864.
- ↑ D. Spitzner, K. Austria : Réactions de dominos induites par anionisation - Synthèse d'un terpène de type Norpatchoulenol . Dans : European Journal of Organic Chemistry . ruban 2001 , non. 10 , 2001, p. 1883-1886 , doi : 10.1002 / 1099-0690 (200105) 2001 : 10 <1883 :: AID-EJOC1883> 3.0.CO; 2-M .
- ↑ M. Schlosser, B. Schaub: Dans Chimia 36, 1982, pp 396-397..
- ↑ Jerry March : Chimie organique avancée . McGraw-Hill, Kogakusha 1977, ISBN 0-07-040247-7 .
- ^ KPC Vollhardt , NE Schore : Chimie organique. 4e édition. Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X , page 891.
- ↑ Robert B. Woodward, Roald Hoffmann : La préservation de la symétrie orbitale . Verlag Chemie, Weinheim 1970, ISBN 3-527-25323-8 , pages 1-178.
- ↑ Kaim, W. : Transfert d'un électron : Adieu aux mécanismes de paires d'électrons ? Dans : Nachr.Chem.Tech. Laboratoire. 32, 1984, pages 436-439.
- ↑ Peter Sykes : mécanismes réactionnels de la chimie organique. 7e édition. Verlag Chemie, 1979, ISBN 3-527-21047-4 .
- ↑ M. Schlosser, KF Christmann Dans : Liebigs Ann. Chem.708 , 1967, p.1.
- ↑ Thomas Laue, Andreas Plagens : Nom et mots clés des réactions de la chimie organique. 5e édition. Vieweg + Teubner-Verlag, 2006, ISBN 3-8351-0091-2 .
- ↑ BE Maryanoff, AB Reitz, MS Mother, RR Whittle, RA Olofson : Stéréochimie et mécanisme de la réaction de Wittig. Intermédiaires de réaction diastéromériques et analyse du déroulement de la réaction . Dans : J. Am. Chimie Soc. ruban 108 , non. 24 , 1986, p. 7664-7678 , doi : 10.1021 / ja00284a034 .
- ↑ E. Vedejs comprennent: Sujets à Stéréochimie. Tome 21, 1994, ISBN 0-471-52120-5 .
- ^ A. Streitwieser, CH Heathcock : Chimie organique. Verlag-Chemie, 1980, ISBN 3-527-25810-8 .
- ^ Nguyên Trong Anh : Les règles de Woodward-Hoffmann et leur application . Verlag Chemie, 1970, ISBN 3-527-25430-7 .
- ↑ H.-J. Bestmann, R. Armsen, H. Wagner, Chem.Ber . 102, 1969, pages 2259-2269.
- ↑ BM Trost, DP Curran : Une annulation de cyclopenténone énantiodirigée. Synthèse d'un bloc de construction utile pour les produits naturels cyclopentanoïdes condensés . Dans : J. Am. Chimie Soc. ruban 102 , non. 17 , 1980, p. 5699-5700 , doi : 10.1021 / ja00537a059 .
- ↑ Asknes et Frøyen, Acta Chem. Scand. , 22, 1968, page 2347.
- ↑ Froyen: .. Acta Chem Scand, Ser. B . 28, 1974, page 568.
- ↑ Chopard, Hudson, Searle : Tetrahedron Lett. , 1965, page 2357.
- ↑ Flitsch, Peters: Tetrahedron Lett. , 1969, page 1161.
- ↑ Gara, Massy-Westropp et Reynolds: Tetrahedron Lett. , 1969, page 4171.
- ↑ Bestmann, Seng: tétraèdre . 21, 1965, page 1373.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Manuel de chimie inorganique . 81-90. Édition. Walter de Gruyter, Berlin 1976, ISBN 3-11-005962-2 .