Mésomérie
En chimie, la mésomérie (également la structure de résonance ou de résonance ) décrit le phénomène selon lequel les relations de liaison dans certaines molécules ou certains ions polyatomiques ne peuvent pas être représentées par une seule formule structurelle , mais uniquement par plusieurs formules limites . Aucune de ces formules limites ne décrit adéquatement les conditions de liaison et donc la distribution des électrons . La distribution électronique réelle dans la molécule ou l'ion se situe entre les distributions électroniques données par les formules limites. Ceci est indiqué par la flèche mésomère (Flèche de résonance ) avec le symbole ↔ . La flèche mésomère ne doit pas être confondue avec la flèche d' équilibre à double flèche ⇌, qui indique un équilibre chimique. Le terme mésomérie a été introduit en 1933 par Christopher Kelk Ingold .
L'état réel d'une molécule, c'est-à-dire l'état intermédiaire entre les structures limites, est appelé l' état mésomérique .
La différence d'énergie entre les structures limites et l'état mésomérique réel, qui dans de nombreux cas peut être estimée, est appelée énergie mésomère ou énergie de résonance . Plus une molécule ou un ion possède de structures limites mésomères, plus il est stable. Dans le cadre de la théorie de la structure de valence ( théorie VB), les énergies naturelles des structures aux limites individuelles et leur poids (c'est-à-dire leur part dans la fonction d'onde globale) peuvent être calculées.
Exemple de benzène
| Benzène (C 6 H 6 ) | |
| structures limites mésomères | |

| |
| doubles liaisons délocalisées | représentation habituelle |
 |
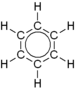
|
| Énergie mésomérique | |

| |
Un exemple de composé mésomère est le benzène (voir figure). D'autres aromatiques sont également des composés mésomères.
Selon la règle de l' octet , ces molécules sont particulièrement stables dans lesquelles chaque atome est entouré de huit électrons de valence . Deux formules structurales peuvent être établies pour le benzène dans lesquelles tel est le cas (structures limites mésomères).
Le fait qu'aucune des deux formules limites du benzène n'est correcte peut être déduit des longueurs de liaison des liaisons entre les atomes de carbone. Les atomes de carbone liés les uns aux autres par des doubles liaisons devraient être plus proches les uns des autres que ceux qui ne sont liés les uns aux autres que par une seule liaison atomique . Cependant, ce n'est pas le cas. Les longueurs de liaison entre les atomes de carbone sont uniformément de 139 pm .
Dans le cycle benzénique, chaque atome de carbone a quatre électrons de valence , dont deux connectent l'atome aux atomes de carbone voisins. Un électron se lie à l'atome d'hydrogène associé. Les six autres π - électrons rendement trois formelles en n liaisons , tel qu'il est exprimé dans la formule de structure avec trois doubles liaisons. Dans le modèle orbital valable aujourd'hui , les six électrons π forment un nuage de charge délocalisé (système d'électrons 6 π délocalisé) au-dessus et au-dessous du niveau du cycle carboné ( liaison multicentrique ).
Il en résulte un état énergétique réduit de 151 kJ / mol , ce qui augmente l' énergie de liaison du même montant, ce qui se traduit par une plus grande stabilité par rapport aux formules limites hypothétiques ( cyclohexatriène ) avec trois doubles liaisons isolées . Cette différence d'énergie est appelée mésomérie ou énergie de résonance et résulte de la différence des énergies d'hydrogénation du cyclohexatriène hypothétique et du benzène.
La même valeur résulte de la différence des énergies de combustion des deux composés.
Cependant, une autre substance de référence peut également être utilisée pour l'énergie mésomérique. Dans le cas d'une comparaison des énergies d'hydrogénation ou des énergies de combustion du benzène avec la molécule linéaire correspondante (hexatriène), il en résulte une valeur légèrement inférieure. Cette énergie de résonance est appelée «Dewar Resonance Energy (DRE)».
Sels d'acides carboxyliques et d'acides carboxyliques vinyliques
Un cas très similaire d'électrons délocalisés se trouve dans les sels d' acides carboxyliques tels que les acides formique et acétique ; ici aussi, cela conduit à la stabilisation mésomérique de l' anion carboxylate (acide formique: anion formate; acide acétique: anion acétate). En insérant une ou plusieurs doubles liaisons C = C, on obtient des sels d' acides carboxyliques vinyliques . La mésomérie n'est pas perdue. Anion carboxylate stabilisé mésomère (en haut) et anion carboxylate vinylogous (en bas):
En majuscules (anion carboxylate), la mésomérie peut être indiquée par la notation suivante:
Des exemples d'acides carboxyliques vinyliques sont l'acide ascorbique (vitamine C) et l' acide vulpinique .
Voir également
Preuve individuelle
- ↑ Entrée sur la mésomérie . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / goldbook.M03845 Version: 2.1.5.
- ↑ Entrée sur la résonance . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / goldbook.R05326 Version: 2.1.5.
- ^ Sason S. Shaik, Philippe C. Hiberty: Guide d'un chimiste à la théorie de liaison de Valence . John Wiley & Sons, 2007, ISBN 978-0-470-19258-0 .


