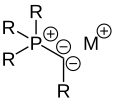
Ylide
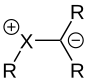
Un ylide est un sel interne dans lequel un centre anionique est directement adjacent à un groupe cationique et est stabilisé par celui-ci.
histoire
Les premiers ylides ont été synthétisés par Michaelis et Gimborn en 1894, mais n'ont pas été reconnus comme tels. En conséquence, la première synthèse consciente et l'isolement d'un ylide ont eu lieu en 1919 par Staudinger et Meyer.
structure
De nombreuses propriétés des ylures peuvent être attribuées à la structure électronique spéciale de la liaison ylide centrale. Ce lien peut être décrit de différentes manières. D'une part en tant que zwitterion, avec à la fois le caractère covalent ("-yl") et ionique ("-id") de la liaison. La molécule correspond à un zwitterion avec une séparation de charge entre un groupe onium ( par exemple phosphonium ) et un centre anionique directement adjacent tel qu'un carbanion . La stabilisation s'effectue par hyperconjugaison négative de la charge négative du centre anionique dans une orbitale σ * -antiliante du groupe onium à l'un de ses substituants. De là, la description aboutit à une structure limite mésomère avec un caractère de double liaison entre le groupe onium et le centre anionique.
Dans le passé, la description et a continué à jouer Ylen (" yl ") et de manière covalente avec le caractère à double liaison alkylischem (" s ") jouent un rôle. Dans cette structure, cependant, la règle de l' octet est violée. Cette blessure s'expliquait par l' implication des orbitales d du groupe onium. Cependant, des études informatiques ont pu montrer que cela ne joue qu'un rôle secondaire.
Dans des publications plus récentes, la description en tant que carbène stabilisé au phosphane est proposée et discutée en détail.
Synthèse des ylides
En particulier, la synthèse de P - et S - ylures est habituellement effectuée par déprotonation des sels de phosphonium ou sulfonium correspondant à la α position du groupe onium. Cependant, d'autres voies de synthèse sont également connues. Par exemple, les N- ylures peuvent être obtenus par réaction de complexes de carbène avec des amines . La synthèse des Br ylures, d'autre part, peut être réalisée en faisant réagir des précurseurs de brome (III) appropriés avec du bis (perfluoaralkylsulfone) méthylène. Les Br ylures ainsi obtenus réagissent à leur tour avec les chlorures ou iodures d'aryle pour former les dérivés Cl ou I correspondants.
Types d'ylides
Dans un grand nombre d'ylures, un atome de carbone agit comme centre anionique. Ces composés sont désignés, par exemple, comme P- , S- ou As- Ylides conformément à l'atome central du groupe onium.
P- Ylide
Les ylures sont souvent appelés familièrement ylures de phosphore (également appelés phosphoranes ). Ce sont des composés organophosphorés dans lesquels l'atome de phosphore a l' état d'oxydation +V. Appliquer P- Ylide en particulier dans la réaction de Wittig . Dans la plupart des cas, ils ne sont pas isolés ici, mais plutôt préparés in situ et réagi directement avec un aldéhyde , qui reçoit finalement le groupe méthylène de l'ylure (c'est-à-dire, C = O devient C = CH 2 ). Cette réaction et ses variantes ( par exemple la réaction de Horner-Wadsworth-Emmons ) sont utilisées comme étape clé dans un grand nombre de procédés industriels (par exemple dans la synthèse de vitamines).
Schmidbaur a été le premier à reconnaître que les P- Ylides conviennent comme ligands pour les métaux en raison de leurs propriétés de donneur (charge négative du carbanion). Il réussit également à isoler pour la première fois le triméthylméthylène phosphorane (Me 3 P = CH 2 ), un composé extrêmement réactif.
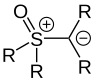
S- Ylide
Une deuxième classe importante d'ylides sont les S ylides. Ceux-ci peuvent être convertis en ylures de sulfonium de la forme R 2 S + -C - R 2 avec du soufre à l'état d'oxydation + III et en ylures de sulfoxonium de la forme R 2 (O) S + -C - R 2 avec un atome de soufre dans le + état d'oxydation Subdiviser V. En particulier, les ylures de sulfonium sont utilisés dans la réaction de Johnson-Corey-Chaykovsky ou se produisent comme intermédiaire dans l'oxydation de Swern .
N- Ylide
Le type d'ylides le plus important après les ylides P et S sont les n ylides. Celles-ci présentent une grande diversité structurelle. Dans les ylures d'ammonium , qui sont structurellement similaires à la P ylures, l'azote est tétravalent et sp 3 hybridé. En face se trouvent les ylures d'azométhine , de pyridinium et de triazolium . Dans ceux-ci, l'azote est trivalent et sp 2 hybride.
Ylides plus simples
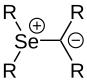
D'autres ylures d'éléments du groupe principal du groupe onium sont connus, par exemple avec l' arsenic ( As- Ylide), l' antimoine ( Sb- Ylide), le sélénium ( Se- Ylide) ou les halogènes ( halogène -Ylide).
En plus de ceux-ci, il existe cependant un grand nombre d'autres groupes fonctionnels dans lesquels un élément autre que le carbone forme le centre anionique. Par exemple, les liaisons S - O dans les sulfoxydes ou les sulfones peuvent être comprises comme ylidiques. Dans ces cas, les atomes d'oxygène fonctionnent comme des centres anioniques. Il en va de même pour les oxydes de phosphine .
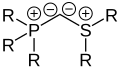
Bisylides
Une autre classe d'ylides sont les bisylides. Dans ces composés, un carbanion doublement chargé négativement est substitué par deux groupes onium. Ces connexions sont également chargées de manière neutre en conséquence. Si les deux groupes onium sont des groupes phosphonium, ces composés sont également appelés carbodiphosphoranes, bien que des bisylures avec substitution mixte de sulfonium et de phosphonium/sulfonium soient également connus. Des groupes selonium peuvent également être utilisés pour stabiliser le composé. De plus, les allènes fortement courbés peuvent également être compris comme des bisylides (carbodicarbènes).
Yldiide
Dans les yldiides, parfois aussi appelés ylures métallés, un carbanion doublement chargé négativement, contrairement aux bisylides, n'est stabilisé que par un groupe onium. Ces composés sont en conséquence anioniques . Les cations de métaux alcalins agissent comme des contre-ions . Les yldiides conviennent à l'introduction de substituants ylure par des réactions de métathèse de sel .
utilisation
Les P -Ylides sont particulièrement bien connus pour leur utilisation comme réactifs pour la formation de liaisons C = C dans la réaction de Wittig , pour laquelle leur découvreur Georg Wittig a reçu le prix Nobel de chimie en 1979 . Les S- Ylides, quant à eux, sont principalement utilisés dans la réaction de Johnson-Corey-Chaykovsky dans la synthèse d' époxydes , d' aziridines et de cyclopropanes . En plus de ces applications, les ylures servent également de ligands, par exemple dans les carbènes à substitution ylure ou leurs homologues plus lourds. L'abondance d'électrons dans l'atome de carbone ylidique permet d'obtenir des donneurs σ particulièrement forts . Les phosphines à substitution ylide se distinguent également par des ligands donneurs particulièrement puissants. Il existe également un grand nombre d'exemples de complexes de métaux de transition à substitution ylure.
Preuve individuelle
- ↑ a b c Christoph Janiak , Hans-Jürgen Meyer , Dietrich Gudat , Ralf Alsfasser : Riedel Modern Inorganic Chemistry : . DE GRUYTER, 2012, ISBN 978-3-11-024900-2 , doi : 10.1515 / 9783110249019 .
- ↑ A. Michaelis, HV Gimborn : A propos de la bétaïne et de la choline de la triphénylphosphine . Dans : Rapports de la Société chimique allemande . ruban 27 , non. 1 , janvier 1894, p. 272-277 , doi : 10.1002 / cber.18940270152 .
- ^ Ali Ramazani, Ali Reza Kazemizadeh: Préparation d'ylides de phosphore stabilisés via des réactions à plusieurs composants et leurs applications synthétiques . Dans : Chimie Organique Actuelle . ruban 15 , non. 23 , 1er décembre 2011, p. 3986-4020 , doi : 10.2174 / 138527211798072412 .
- ↑ Fausto Ramirez, Samuel Dershowitz : Phosphineméthylènees. 1 II Triphénylphosphinecylméthylènees . Dans : Le Journal de Chimie Organique . ruban 22 , non. 1 , janvier 1957, ISSN 0022-3263 , p. 41-45 , doi : 10.1021 / jo01352a010 .
- ↑ H. Staudinger, Jules Meyer : A propos des nouveaux composés organiques du phosphore III. Dérivés de phosphinométhylène et phosphinimines . Dans : Helvetica Chimica Acta . ruban 2 , non. 1 , 1919, p. 635-646 , doi : 10.1002 / hlca .19190020164 .
- ^ Un b Steven M. Bachrach: Structure moléculaire des ylures de phosphonium . Dans : Le Journal de Chimie Organique . ruban 57 , non. 16 juillet 1992, ISSN 0022-3263 , p. 4367-4373 , doi : 10.1021 / jo00042a012 .
- ↑ a b c d Viktoria H. Gessner (Ed.): Modern Ylide Chemistry (= Structure and Bonding ). Springer International Publishing, Cham 2018, ISBN 978-3-319-89544-4 , doi : 10.1007 / 978-3-319-89545-1 .
- ↑ Daniel Himmel, Ingo Krossing, Andreas Schnepf : Liaisons datives dans les connexions d' éléments de groupe principal : un plaidoyer pour moins de flèches . Dans : Angewandte Chemie . ruban 126 , non. 2 , 7 janvier 2014, p. 378-382 , doi : 10.1002 / anie.201300461 .
- ↑ Gernot Frenking : Liens datifs dans les connexions des éléments du groupe principal : un plaidoyer pour plus de flèches . Dans : Angewandte Chemie . ruban 126 , non. 24 , 10 juin 2014, p. 6152-6158 , doi : 10.1002 / anie.201311022 .
- ↑ Daniel Himmel, Ingo Krossing, Andreas Schnepf : Datif ou pas datif ? Dans : Angewandte Chemie . ruban 126 , non. 24 , 10 juin 2014, p. 6159-6160 , doi : 10.1002 / anie.201403078 .
- ↑ a b c Hillary J. Dequina, Jennifer M. Schomaker : Aziridinium Ylides : intermédiaires sous-utilisés pour la synthèse d'amines complexes . Dans : Tendances de la chimie . ruban 2 , non. 10 octobre 2020, p. 874-887 , doi : 10.1016 / j.trechm.2020.08.003 , PMID 33665590 .
- ↑ Masahito Ochiai, Norihiro Tada, Kentaro Murai, Satoru Goto, Motoo Shiro : Synthèse et caractérisation des ylures de brome et de leurs réactions inhabituelles de transfert de ligand avec les N-hétérocycles . Dans : Journal de l'American Chemical Society . ruban 128 , non. 30 , 2006, p. 9608-9609 , doi : 10.1021 / ja063492 + .
- ↑ Masahito Ochiai, Norihiro Tada, Takuya Okada, Atushi Sota, Kazunori Miyamoto : Transylidations thermiques et catalytiques entre les ylides d'halonium et synthèse et réaction des ylides de chloronium aliphatiques stables . Dans : Journal de l'American Chemical Society . ruban 130 , non. 7 , février 2008, ISSN 0002-7863 , p. 2118–2119 , doi : 10.1021 / ja074624h .
- ↑ a b F. Volatron, O. Eisenstein: Wittig contre réaction Corey-Chaykovsky. Etude théorique de la réactivité du méthylure de phosphonium et du méthylure de sulfonium avec le formaldéhyde . Dans : Journal de l'American Chemical Society . ruban 109 , non. 1er janvier 1987, ISSN 0002-7863 , p. 1–14 , doi : 10.1021 / ja00235a001 .
- ↑ a b c Jie Jack Li: réactions Nom: une collection de mécanismes de réaction détaillés . 4e édition. Springer, Berlin 2009, ISBN 978-3-642-01053-8 .
- ↑ Giorgiana Denisa Bisag, Silvia Ruggieri, Mariafrancesca Fochi, Luca Bernardi : Sulfoxonium ylides : composés simples à réactivité caméléonique . Dans : Chimie organique et biomoléculaire . ruban 18 , non. 43 , 2020, ISSN 1477-0520 , p. 8793-8809 , doi : 10.1039 / D0OB01822H .
- ↑ John A. Seed, Helen R. Sharpe, Harry J. Futcher, Ashley J. Wooles, Stephen T. Liddle: Nature of the Arsonium ‐ Ylide Ph 3 As = CH 2 and a Uranium (IV) Arsonium – Carbene Complex . Dans : Angewandte Chemie . ruban 132 , non. 37 , 7 septembre 2020, ISSN 0044-8249 , p. 16004–16008 , doi : 10.1002 / anie.202004983 .
- ^ Un b Douglas Lloyd, Ian Gosney, Raymond A. Ormiston: Arsonium ylides (avec quelques mentions également d'arsinimines, de stibonium et d'ylures de bismuthonium) . Dans : Avis de la société chimique . ruban 16 , 1987, ISSN 0306-0012 , p. 45 , doi : 10.1039 / cs9871600045 .
- ↑ Józef Drabowicz, Aneta Rzewnicka, Remigiusz Żurawiński : Selenonium Ylides : synthèses, aspects structurels et applications synthétiques . Dans : Molécules . ruban 25 , non. 10 , 22 mai 2020, ISSN 1420-3049 , p. 2420 , doi : 10.3390 / molécules25102420 , PMID 32455915 .
- ↑ WH Pirkle, GF Koser: ylures de halonium. je . Dans : Journal de l'American Chemical Society . ruban 90 , non. 13 juin 1968, ISSN 0002-7863 , p. 3598-3600 , doi : 10.1021 / ja01015a075 .
- ↑ Masahito Ochiai, Norihiro Tada, Takuya Okada, Atushi Sota, Kazunori Miyamoto : Transylidations thermiques et catalytiques entre les ylides d'halonium et synthèse et réaction des ylides de chloronium aliphatiques stables . Dans : Journal de l'American Chemical Society . ruban 130 , non. 7 , février 2008, ISSN 0002-7863 , p. 2118–2119 , doi : 10.1021 / ja074624h .
- ^ Terence P. Cunningham, David L. Cooper, Joseph Gerratt, Peter B. Karadakov, Mario Raimondi : Liaison chimique dans les oxofluorures de soufre hypercoordonné . Dans : Journal of the Chemical Society, Faraday Transactions . ruban 93 , non. 13 , 1997, p. 2247-2254 , doi : 10.1039 / a700708f .
- ↑ Daniel Kaiser, Immo Klose, Rik Oost, James Neuhaus, Nuno Maulide : réactions de formation et de rupture de liaison au soufre (IV) : sulfoxydes, sels de sulfonium, ylures de soufre et sels de sulfinate . Dans : Examens chimiques . ruban 119 , non. 14 , 24 juillet 2019, ISSN 0009-2665 , p. 8701-8780 , doi : 10.1021 / acs.chemrev.9b00111 , PMID 31243998 .
- ^ DB Chesnut, A. Savin: La fonction de localisation des électrons (ELF) Description de la liaison PO dans l'oxyde de phosphine . Dans : Journal de l'American Chemical Society . ruban 121 , non. 10 , mars 1999, ISSN 0002-7863 , p. 2335-2336 , doi : 10.1021 / ja984314m .
- ↑ Takayoshi Fujii, Tomio Ikeda, Toshie Mikami, Tetsuya Suzuki, Toshiaki Yoshimura : Synthèse et structure de (MeN) Ph 2 S – C – SPh 2 (NMe) . Dans : édition internationale d'Angewandte Chemie . ruban 41 , non. 14 , 2002, ISSN 1521-3773 , p. 2576-2578 , doi : 10.1002 / 1521-3773 (20020715) 41:14 <2576 :: AID-ANIE2576> 3.0.CO; 2-8 .
- ↑ Sergio Pascual, Matthew Asay, Ona Illa, Tsuyoshi Kato, Guy Bertrand : Synthèse d'un Mixed Phosphonium – Sulfonium Bisylide R 3 P – C – SR 2 . Dans : édition internationale d'Angewandte Chemie . ruban 46 , non. 47 , 3 décembre 2007, p. 9078-9080 , doi : 10.1002 / anie.200704071 .
- ↑ Tomohito Morosaki, Tsubasa Suzuki, Wei-Wei Wang, Shigeru Nagase, Takayoshi Fujii : synthèses, structures et réactivités de deux carbones stabilisés au chalcogène . Dans : édition internationale d'Angewandte Chemie . ruban 53 , non. 36 , 1er septembre 2014, p. 9569-9571 , doi : 10.1002 / anie.201404795 .
- ↑ Alois Fürstner , Manuel Alcarazo , Richard Goddard, Christian W. Lehmann : Chimie de coordination des Ene-1,1-diamines et un prototype « Carbodicarbene » . Dans : édition internationale d'Angewandte Chemie . ruban 47 , non. 17 , 14 avril 2008, p. 3210-3214 , doi : 10.1002 / anie.200705798 .
- ^ C. Adam Dyker, Vincent Lavallo, Bruno Donnadieu, Guy Bertrand : Synthèse d'un allène acyclique extrêmement courbé (un « carbodicarbène ») : un ligand fort donneur . Dans : édition internationale d'Angewandte Chemie . ruban 47 , non. 17 , 14 avril 2008, p. 3206-3209 , doi : 10.1002 / anie.200705620 .
- ↑ Thomas Baumgartner, Bernd Schinkels, Dietrich Gudat, Martin Nieger, Edgar Niecke : Lithium Phosphoranylidene Ylides Mes * -P (E) C (H) Li (THF) 3 (E = NMes *, C (SiMe 3) 2) : Synthèse , Structure cristalline et transmétallation . Dans : Journal de l'American Chemical Society . ruban 119 , non. 50 , décembre 1997, ISSN 0002-7863 , p. 12410-12411 , doi : 10.1021 / ja9718127 .
- ↑ Stéphanie Goumri-Magnet, Heinz Gornitzka, Antoine Baceiredo, Guy Bertrand : Utilité de synthèse des phosphanylcarbènes stables : synthèse et structure cristalline d'un α- (Lithiométhylène) phosphorane . Dans : édition internationale d'Angewandte Chemie . ruban 38 , non. 5 , 1999, ISSN 1521-3773 , p. 678-680 , doi : 10.1002 / (SICI) 1521-3773 (1990301) 38 : 5 <678 :: AID-ANIE678> 3.0.CO; 2-L .
- ↑ Thorsten Scherpf, Regina Wirth, Sebastian Molitor, Kai-Stephan Feichtner, Viktoria H. Gessner : Combler le fossé entre les bisylides et les methandiides : isolement, réactivité et structure électronique d'un yldiide . Dans : édition internationale d'Angewandte Chemie . ruban 54 , non. 29 , 13 juillet 2015, p. 8542–8546 , doi : 10.1002 / anie.201501818 .
- ↑ Chandrajeet Mohapatra, Lennart T. Scharf, Thorsten Scherpf, Bert Mallick, Kai ‐ Stephan Feichtner : Isolement d'un diylide ‐ Stannylene et Germylene stabilisés : Renforcement de la force des donneurs grâce à l'alignement coplanaire de paires isolées . Dans : édition internationale d'Angewandte Chemie . ruban 58 , non. 22 , 27 mai 2019, ISSN 1433-7851 , p. 7459–7463 , doi : 10.1002 / anie.201902831 , PMID 30901140 , PMC 6563488 (texte intégral gratuit).
- ↑ Chandrajeet Mohapatra, Heidar Darmandeh, Henning Steinert, Bert Mallick, Kai-Stephan Feichtner : Synthèse de composés dinucléaires de faible valeur du groupe 14 avec des liaisons élément-élément par transylidation . Dans : Chimie - Un Journal Européen . ruban 26 , non. 66 , 26 novembre 2020, ISSN 0947-6539 , p. 15145–15149 , doi : 10.1002 / chem.202004242 , PMID 32954596 , PMC 7756224 (texte intégral gratuit).
- ^ Adalbert Maercker : La réaction de Wittig . Dans : Réactions organiques . John Wiley & Sons, Inc., Hoboken, NJ, États-Unis 2011, ISBN 978-0-471-26418-7 , p. 270-490 , doi : 10.1002 / 0471264180.ou014.03 .
- ^ Le prix Nobel de chimie 1979. Récupéré le 6 août 2021 (anglais américain).
- ↑ réaction de Corey-Chaykovsky . Dans : Nom des réactions . Springer Berlin Heidelberg, Berlin, Heidelberg 2006, ISBN 978-3-540-30030-4 , p. 157-159 , doi : 10.1007/3-540-30031-7_70 .
- ↑ Abir Sarbajna, VSVSN Swamy, Viktoria H. Gessner : Phosphorus-ylures : puissants substituts pour la stabilisation des composés réactifs du groupe principal . Dans : Sciences chimiques . ruban 12 , non. 6 , 2021, ISSN 2041-6520 , p. 2016-2024 , doi : 10.1039 / D0SC03278F , PMID 34163963 , PMC 8179322 (texte intégral gratuit).
- ↑ Thorsten Scherpf, Christopher Schwarz, Lennart T. Scharf, Jana-Alina Zur, Andreas Helbig : Phosphines à fonction Ylide : Ligands donneurs puissants pour une catalyse homogène . Dans : édition internationale d'Angewandte Chemie . ruban 57 , non. 39 , 24 septembre 2018, p. 12859–12864 , doi : 10.1002 / anie.201805372 , PMID 29862622 , PMC 6174943 (texte intégral gratuit).
- ↑ Philip Weber, Thorsten Scherpf, Ilja Rodstein, Dominik Lichte, Lennart T. Scharf: A Highly Active Ylide ‐ Functionalized Phosphine for Palladium ‐ Catalyzed Aminations of Aryl Chlorides . Dans : édition internationale d'Angewandte Chemie . ruban 58 , non. 10 , 4 mars 2019, ISSN 1433-7851 , p. 3203-3207 , doi : 10.1002 / anie.201810696 .
- ↑ Christopher Schwarz, Jens Handelmann, Daniel M. Baier, Alina Ouissa, Viktoria H. Gessner : Phosphines mono- et diylide substituées (YPhos) : impact des propriétés du ligand sur l'activité catalytique dans les hydroaminations catalysées par l'or (i) . Dans : Catalyse Science & Technologie . ruban 9 , non. 23 , 2019, ISSN 2044-4753 , p. 6808-6815 , doi : 10.1039 / C9CY01861A .
- ↑ John A. Seed, Helen R. Sharpe, Harry J. Futcher, Ashley J. Wooles, Stephen T. Liddle: Nature of the Arsonium ‐ Ylide Ph 3 As = CH 2 and a Uranium (IV) Arsonium – Carbene Complex . Dans : édition internationale d'Angewandte Chemie . ruban 59 , non. 37 , 7 septembre 2020, ISSN 1433-7851 , p. 15870–15874 , doi : 10.1002 / anie.202004983 .
- ↑ Tim Oswald, Malte Fischer, Niclas Struckmann, Marc Schmidtmann, Rüdiger Beckhaus : Reaction of Pentafulvene Titanium and Zirconium Complex with Phosphorus Ylides: Stoechiometric Reactions and Catalytic Intramolecular Proton Shuttles . Dans : Organométalliques . ruban 38 , non. 4 , 25 février 2019, ISSN 0276-7333 , p. 829-843 , doi : 10.1021 / acs.organomet.8b00831 .
- ↑ Alice Johnson, Isabel Marzo, M. Concepción Gimeno : les ligands d'ylide en tant que blocs de construction pour les complexes de métaux bioactifs du groupe 11 . Dans : Chimie - Un Journal Européen . ruban 24 , non. 45 , 9 août 2018, ISSN 0947-6539 , p. 11693-11702 , doi : 10.1002 / chem .201801600 .
- ↑ Xiao-Qiang Hu, Dominik Lichte, Ilja Rodstein, Philip Weber, Ann-Katrin Seitz : Ylide-Functionalized Phosphine (YPhos) – Palladium Catalysts : Selective Monoarylation of Alkyl Ketones with Aryl Chlorides . Dans : Lettres organiques . ruban 21 , non. 18 , 20 septembre 2019, ISSN 1523-7060 , p. 7558-7562 , doi : 10.1021 / acs.orglett.9b02830 .
- ↑ Rachid Taakili, Cécile Barthes, Amel Goëffon, Christine Lepetit, Carine Duhayon : NHC Core Phosphonium Ylide-based Palladium (II) Pincer Complexes : The Second Ylide Extremity Makes the Difference . Dans : Chimie inorganique . ruban 59 , non. 10 , 18 mai 2020, ISSN 0020-1669 , p. 7082-7096 , doi : 10.1021 / acs.inorgchem.0c00561 .