Anthocyanes
Anthocyanines ou anthocyanes ( anglais anthocyanes , de grec ancien ἄνθος de la « fleur », « fleur » et le grec ancien κυάνεος kyáneos « bleu foncé », « bleu noir », « couleur foncée ») sont végétales solubles dans l'eau des pigments qui se produisent dans la cellule la sève de presque toutes les plantes, fleurs et fruits supérieurs lui donne une couleur rouge intense, violette ou bleue.
En 1835, le pharmacien allemand Ludwig Clamor Marquart donna le nom d' Anthokyan à un composé chimique qui donna aux fleurs une couleur bleue pour la première fois dans son traité « Les couleurs des fleurs » . En 1849, FS Morot réussit à isoler ce colorant, appelé « cyanine », sous forme impure. En 1913, Richard Willstätter réussit à identifier l'anthocyane du bleuet. Ce terme a été introduit plus tard pour désigner tout un groupe de composés chimiquement similaires au "bleu de fleur" d'origine. Il a également été rapidement reconnu que la cristallisation des sels de colorants d'oxonium (sels de flavylium) était considérablement plus facile que la précipitation des colorants neutres (quinoïdes).
Les anthocyanes appartiennent au groupe des substances apparentées aux flavones , les flavonoïdes , et aux substances végétales secondaires comptées.
Ils doivent leur bonne solubilité dans l'eau à une teneur en sucres liés glycosidiquement. Color Decisive n'est que la part sans sucre , l' aglycone d'anthocyanine, qui est donc appelée anthocyanidine . Les anthocyanes les plus importants sont dérivés de la cyanidine et de la delphinidine .
En anglais, seul le terme « anthocyanin » est utilisé à la place du terme « anthocyanin ».
Arriver
| Aliments | Anthocyanes [mg/100 g de fruits] |
|---|---|
| Chou palmier | 800-1000 |
| Chokeberry (Aronia) | 200-1000 sous forme de cyanidine |
| Pomme (pelure) | 10-100 |
| Aubergine (bol) | 750 sous forme de delphinidine |
| fraise | 7-50 sous forme de pélargonidine |
| canneberge | 25-65 sous forme de cyanidine |
| hibiscus | 500-1500 delphinidine et cyanidine (2 : 1) |
| Sureau | 200-1000 sous forme de cyanidine |
| jus de sureau | 1900-6600 mg / 100 ml sous forme de cyanidine |
| Orange sanguine (pulpe) | 200 sous forme de cyanidine |
| mûre | 50-350 sous forme de cyanidine |
| Myrtille (myrtille) | 10-515 sous forme de cyanidine |
| Framboise (rouge) | 20-230 sous forme de cyanidine |
| Framboise (noir) | 180-700 |
| Cerise | 2-450 sous forme de cyanidine |
| griotte | 35 sous forme de cyanidine |
| Groseille (rouge) | 10-20 |
| Groseille (noir) | 130-420 delphinidine et péonidine (2 : 1) |
| Jus de groseille (noir) | 1300-4000 mg/100 ml |
| Chou rouge ( chou rouge ) | 12-40 sous forme de cyanidine |
| Raisin (rouge) | 5-750 (fortement dépendant de la variété) |
| vin rouge | 2-1000 mg / 100 ml sous forme de malvidine |
Les anthocyanes sont des colorants chymochromiques que l'on ne trouve que dans la sève cellulaire des plantes terrestres , mais pas chez les animaux , les micro - organismes ou les plantes aquatiques . Chez les plantes aquatiques, le renouvellement de la photosynthèse n'est pas suffisant pour la production en raison de la faible intensité lumineuse sous l'eau. Mais toutes les plantes terrestres ne contiennent pas d'anthocyanes : dans les plantes de type œillet , cactus et mollugo , la bétalaïne joue le rôle d'anthocyanes.
Les anthocyanes sont présentes dans presque toutes les plantes supérieures, principalement dans les fleurs et les fruits , mais aussi dans les feuilles et les racines. Dans les parties respectives de la plante, ils se trouvent principalement dans les couches cellulaires externes telles que les cellules épidermiques . Les quantités y sont relativement importantes : un kilogramme de mûres contient environ 1,15 gramme d'anthocyanes, par exemple, et jusqu'à 20 grammes par kilogramme d'écorce peuvent être obtenus à partir de légumineuses rouges et noires . Les baies d' açaï , l' aronia , les cerises , les raisins bleus , les myrtilles et le chou rouge ainsi que les violettes africaines sont riches en anthocyanes . Les anthocyanes sont moins courantes, par exemple, dans les bananes, les asperges, les pois, le fenouil, les poires et les pommes de terre. Les glycosides de pélargonidine , cyanidine , delphinidine et leurs éthers méthyliques malvidine , péonidine et pétunidine sont le plus souvent présents dans la nature . On estime que 2% du carbone total qui est fixé dans les plantes par photosynthèse est converti en flavonoïdes et leurs dérivés tels que les anthocyanes. C'est pas moins de 10 9 tonnes par an.
Dans les plantes, les anthocyanes se trouvent avec d'autres substances colorantes naturelles telles que les flavones chimiquement proches , les caroténoïdes , les anthoxanthines et les bétalaïnes . En plus de ceux-ci, ils sont également responsables de la couleur des feuilles en automne, lorsque la photosynthèse cesse et que la chlorophylle n'est pas nouvellement formée.
Les anthocyanes sont également de plus en plus produites dans des plantes relativement jeunes dans lesquelles la production de chlorophylle et de cire n'a pas encore commencé et qui ne seraient donc pas protégées des rayons UV . Des parties ou même la plante entière sont colorées et protégées à l'aide de colorants appelés anthocyanes de jeunesse. Lorsque la production de chlorophylle commence, la production de pigments anthocyaniques est réduite. Le schéma de formation des anthocyanes dans les plantes est spécifique au type de plante, car il dépend des conditions du sol, de la lumière, de la chaleur et du type ou de la variété de la plante. Il est extrêmement rare que les plantes n'aient qu'une seule anthocyanine comme colorant, mais cela arrive quand même. L'absence ou la présence particulièrement élevée d'une certaine anthocyanine dans une plante peut être attribuée à des circonstances génétiques.
Tâche dans les plantes
La peau des plantes est généralement de couleur plus foncée que l'intérieur de la plante, à l'exception des oranges sanguines, par exemple. Les peaux des plantes sont donc capables d'absorber la lumière visible et de convertir une partie de l'énergie du rayonnement en énergie thermique. Les anthocyanes ont d'autres tâches dans les plantes : elles doivent
- absorber la lumière UV à ondes courtes du soleil dans la coque et transférer l'énergie rayonnante à la plante sous forme de chaleur. Cela permet d' éviter d' endommager les protéines dans la cellule et l' ADN dans les noyaux cellulaires .
- leur couleur attire les insectes et autres animaux et aide ainsi les plantes à se multiplier.
- Liaison des radicaux libres dans la sève des plantes qui surviennent lors du stress oxydatif .
Les deux premiers points expliquent également pourquoi les anthocyanes se trouvent dans les couches externes des parties de la plante : ce n'est qu'ici qu'elles peuvent accomplir leur tâche. Lorsque les plantes sont exposées à une forte lumière UV ou à un rayonnement ionisant, la plante stimule la production d'anthocyanes via des messagers chimiques.
structure
Des clarifications structurelles fondamentales dans le domaine des colorants végétaux ont été réalisées par Richard Willstätter et ont reçu le prix Nobel de chimie en 1915.
| Anthocyanidine | CAS (a) | Structure de base (R 3 = OH, R 6 = H) | R 1 , R 2 | - | R 5 | R 7 | - | λ max (b) | - | pK S 1 | pK S 2 | pK S 3 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pélargonidine (c) | 134-04-3 |

|
H, H | OH | OH | 506 nm | nb | .... | .... | |||
| Cyanidine (c) | 528-58-5 | OHH | OH | OH | 525 nm | 2,98 ± 0,05 | 7.5 | .... | ||||
| Peonidine (paeonidine) | 134-01-0 | LCO 3 , H | OH | OH | 523 nm | 2,09 ± 0,10 | 6.8 | .... | ||||
| Rosinidine | 4092-64-2 | LCO 3 , H | OH | LCO 3 | .... | .... | .... | |||||
| Delphinidine (c) | 528-53-0 | OH OH | OH | OH | 535 nm | 1,56 ± 0,20 | 5,85 | .... | ||||
| pétunidine | 1429-30-7 | OCH 3 , OH | OH | OH | 535 nm | .... | .... | .... | ||||
| Malvidine | 643-84-5 | LCO 3 , LCO 3 | OH | OH | 535 nm | 1,76 ± 0,07 | 5,36 ± 0,04 | 8,39 ± 0,07 | ||||
|
(une) Numéros CAS des chlorures.
(b)Absorption UV des 3-glucosides dans du méthanol avec 0,01 % de HCl. Les anthocyanidines absorbent la lumière environ 10 nm plus longtemps que les glycosides d'anthocyanidines (c'est-à-dire le décalage vers le bleu dû au résidu glycoside, voir effet hypsochrome ).
(c) composé parent non substitué.
| ||||||||||||
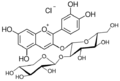
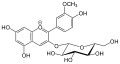
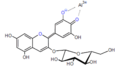
Les anthocyanidines ont toujours un substituant p- hydroxyphényle (cycle B) en position 2 et un groupe hydroxyle en position 3 . Dans la nature, le contre - ion des sels de benzopyrylium est généralement des carboxylates de divers acides solubles dans l'eau, et souvent du chlorure dans les préparations de laboratoire . Les anthocyanidines naturelles les plus importantes sont hydroxy-substituées en position 5 et 7 du cycle A.
Dans le cas des glycosides d'anthocyanidines, les anthocyanes (angl. Anthocyanosides , anthocyanines ), sont généralement au niveau du groupe hydroxyle à l'atome de carbone -3 C molécules de sucre via une liaison glycosidique liée à O. Ceux-ci peuvent être, par exemple, le glucose , le galactose , l' arabinose , le rhamnose et le xylose sous diverses formes saccharidiques . Par acylation avec des plantes aromatiques au niveau de ces acides, on obtient la variété des anthocyanes. La forme glycoside confère aux molécules une solubilité accrue dans l'eau, ce qui est important pour le transport dans les cellules végétales, ainsi qu'une stabilité accrue.
Propriétés
Les anthocyanes sont sensibles à la lumière et à la température ; à des valeurs de pH inférieures à 3, elles sont les plus stables sous la forme de leurs sels de flavylium. Les anthocyanes réagissent avec les tanins et précipitent dans les solutions aqueuses. Les agents oxydants décolorent les anthocyanes, ils sont particulièrement sensibles dans le domaine alcalin.
Les anthocyanes absorbent la lumière dans le domaine visible entre 450 et 650 nm. La gamme de longueurs d'onde est influencée non seulement par la structure moléculaire mais aussi par la valeur du pH de la sève cellulaire ou de l'environnement et elles apparaissent donc rouges, violettes ou bleues. La lumière de ces longueurs d'onde est filtrée hors de la lumière visible et la partie de la lumière réfléchie nous apparaît comme une couleur. Le spectre de couleurs va du bleu au rouge. En milieu acide , la couleur rouge prédomine, en milieu basique , on retrouve notamment les tons bleus et violets. Les changements de couleur ont également lieu dans certaines plantes: les fleurs du lungwort ( Pulmonaria officinalis ) sont d' abord rose, violet plus tard, les changements de valeur du pH au cours de la vie. La peau des baies des mûres passe du rose au bleu foncé à mesure qu'elles mûrissent, tandis que leur jus aigre-doux est rouge foncé.
Dépendance au pH de la couleur
Les changements de couleur des anthocyanes sont basés sur des réactions chimiques . Les termes « chou rouge » et « chou bleu » ne désignent pas des types de chou différents, mais la seule différence entre les plats lors de la préparation est l'ajout différent de vinaigre lors de la cuisson.
- A des valeurs de pH inférieures à 3, les anthocyanes sont colorées en rouge et se présentent sous forme de cations flavylium .
- Des valeurs de pH comprises entre 4 et 5 conduisent à des pseudobases carbinol incolores ("leuco bases", chromenol) dues à l' hydroxylation , avec lesquelles les anthocyanes ne peuvent plus remplir leurs tâches dans les plantes.
- A des valeurs de pH comprises entre 5 et 7, les anthocyanes sont présentes sous forme de flavenols à structure quinoïde et sont violets.
- A des valeurs de pH comprises entre 7 et 8, cette molécule est déprotonée en l' anion flavenolate , qui a une couleur bleue. Ici, les électrons de la molécule entière sont délocalisés sur la plus longue distance possible et peuvent donc être excités avec la plus faible énergie lumineuse possible.
- S'il n'y a pas de groupes glycosides en position 5, des valeurs de pH de 8 et plus conduisent également à des dianions flavenolates, mais dans le milieu alcalin, l'ouverture hydrolytique du cycle pyrane entre en compétition . La molécule est irréversiblement convertie en un anion chalcone jaune .
- Par rapport aux valeurs de pK S des dihydroxybenzènes (pK S d' environ 9,5 et 11,7), les anthocyanidines sont plus de 1000 fois plus acides. Les sels de Flavylium dans l'eau sont plus de 10 fois plus acides que l'acide formique (pK S 3,8).
Complexes métalliques
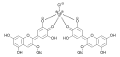
Les anthocyanes avec des groupes hydroxyles voisins dans le cycle B forment des complexes métalliques en présence de sels d'aluminium ou de fer . La complexation des ions métalliques conduit à un décalage du maximum d'absorption des composés de 14 à 23 nm vers des longueurs d'onde plus courtes ( blue shift, hypsochrome shift ). Sigurdson et Giusti décrivent un décalage du maximum d'absorption des anthocyanes jusqu'à 50 nm vers des longueurs d'onde plus longues (décalage bathochrome) en ajoutant des ions aluminium. Cela donne aux anthocyanes complexées une couleur bleue à violette. Les hortensias développent leur couleur bleue à partir de la delphinidine en présence de sels d'aluminium ou de fer dans le sol.
biosynthèse
La formation des anthocyanes suit la biosynthèse de tous les flavonoïdes (voir : Biosynthèse ). Les proanthocyanidines oligomères sont un précurseur biologique . La chalcone synthase (CHS) a été identifiée comme l' enzyme clé de la voie de synthèse des anthocyanes, dont l' expression est régulée au niveau de l' ARNm . Divers facteurs externes, des influences environnementales telles que la température, la lumière et la disponibilité de l'eau, ont une influence sur cela. Mais le stress des plantes peut aussi jouer un rôle.
Dans les semis , par exemple, la synthèse de l'anthocyanine dite de jeunesse dans les cotylédons et dans l' hypocotyle est stimulée par les composants de la lumière rouge et bleue de la lumière solaire, qui sont enregistrés par le phytochrome (lumière rouge) et le cryptochrome (lumière bleue) molécules qui fonctionnent comme des photorécepteurs . Les plantes adultes produisent des anthocyanes dans les feuilles et les pousses, en particulier lorsqu'elles sont exposées à la lumière ultraviolette, ce qui signifie un stress pour la plante. Les anthocyanes ne sont probablement que les produits finaux stables de la synthèse, mais les précurseurs absorbant les UV sont importants pour protéger la plante.
Même avec le feuillage à l'automne des anthocyanes se forment qui donnent la couleur rouge des feuilles d'automne. Les anthocyanures sont le produit final de la voie de l'acide cinnamique , qui est déclenchée par la dégradation de la phénylalanine . Cette voie métabolique n'est pas retrouvée chez les plantes qui fixent l'azote par symbiose avec des bactéries . Par conséquent, il n'y a pas de couleur d'automne due aux anthocyanes.
Fondamentalement, les anthocyanures dans les feuilles ne se forment que dans la couche la plus externe, l' épiderme . Dans les organes de germination, les anthocyanures se forment dans le sous-épiderme en dessous et dans les organes foliaires, en particulier près des nervures et du bord des feuilles. Cette restriction locale est due à l'existence de facteurs génétiques de transcription dans ces zones, qui permettent la synthèse d'anthocyanures en réponse à certains facteurs. Dans ce contexte, on parle de modèle de compétence .
Extraction et utilisation
Les extraits d'anthocyanes sont principalement obtenus à partir d'écorces de fruits à forte concentration en anthocyanes, tels que les myrtilles. Les méthodes d' extraction et de chromatographie sont combinées pour l'isolement de mélanges d'anthocyanes hautement concentrés .
Les fruits sont fortement homogénéisés dans un mixeur et une solution d'éthanol acidifié est ajoutée. Après une première filtration, le résidu est extrait de la même manière. La solution limpide recueillie est concentrée et de l'acétate d'éthyle est ajouté quatre fois chacun et extrait par agitation . La solution aqueuse est collectée, refroidie à quatre degrés Celsius et placée sur une colonne de résine de polystyrène à base d'acide sulfonique échangeuse de cations (Amberlite XAD-7HP). La colonne est d'abord rincée à l'eau déminéralisée pour éliminer les autres résidus organiques tels que le sucre. Pour éluer les anthocyanes, une solution éthanolique acidifiée est à nouveau ajoutée et l'échantillon est élué. La solution éthanolique recueillie est mélangée à de l'eau déminéralisée et placée dans une seconde colonne (Sephadex LH-20) à base d'hydroxypropyle. La colonne est éluée une fois de plus avec une solution éthanolique acidifiée et les fractions sont séparées par chromatographie. Des anthocyanes très concentrés peuvent être obtenus à partir des fractions de la chromatographie sur colonne par HPLC semi-préparative (LC-6AD). Après séparation par HPLC, les produits peuvent être analysés par spectroscopie UV-Vis.
Dans l' UE , les anthocyanes sont généralement approuvés comme additifs alimentaires sous le numéro E E 163 sans restriction de quantité maximale ( quantum satis ) pour les aliments. (Glycosides de pélargonidine E 163a, cyanidine E 163b, péonidine E 163c, delphinidine E 163d, pétunidine E 163e, malvidine E 163f). Ils sont utilisés comme additifs alimentaires pour colorer, par exemple, les pâtes de fruits, les confiseries, les sodas, les confitures, les confitures, les fruits en conserve, les agents de boulangerie pour les produits de boulangerie fine, les enrobages et les glaces. Ils sont généralement ajoutés aux produits acides, car ils ne sont stables que dans ceux-ci. L'utilisation de certains aliments ne serait de toute façon pas autorisée, car il y aurait un risque de tromperie, comme le pain, divers produits laitiers, les pâtes et le miel.
Ils ne sont pas utilisés comme colorants dans l'art en raison de leur manque de stabilité.
Analytique
Les anthocyanes sont plus facilement identifiées et quantifiées à l' aide de méthodes chromatographiques telles que la HPLC , généralement avec un spectromètre de masse couplé (LCMS). Une phase inversée C 18 (voir HPLC) convient à la HPLC. De plus petites quantités peuvent également être déterminées avec un détecteur électrochimique , de plus grandes quantités peuvent également être déterminées avec un détecteur photométrique .
Lors de l'analyse, il est avantageux d'utiliser des acides tels que l'acide formique pour abaisser le pH en dessous de 3, car les anthocyanes sont les plus stables dans ces conditions. Étant donné que les plantes ont un schéma de distribution spécifique des anthocyanidines / glycosides, l'analyse HPLC des ingrédients est utilisée pour déterminer si, par exemple, un vin provient d'une certaine zone de culture et de quel cépage il s'agit. Lorsque les vins sont conservés pendant une période plus longue, des polymères anthocyaniques se forment de plus en plus, de sorte que l'âge d'un vin peut être déterminé en mesurant ce que l'on appelle l' indice de monomère . Les polymères d'anthocyanes résultent de couplages oxydatifs (procédure radicale) des composés quinoïdes neutres dominants.
physiologie
Les anthocyanes du jus de raisin rouge et du jus de cassis ne sont absorbés par l'organisme que dans une faible mesure et/ou métabolisés rapidement , comme l'ont conclu les faibles concentrations d'anthocyanes dans le plasma sanguin (pH 7,4) et dans l' urine . L'apport quotidien varie considérablement d'une personne à l'autre, de sorte que les valeurs moyennes ne sont guère significatives. La biodisponibilité des anthocyanes n'est que d'environ 1 pour cent lorsqu'elles sont consommées avec des aliments normaux.
Les anthocyanes ont des effets antioxydants qui peuvent dépasser ceux de la vitamine C et de la vitamine E , au moins in vitro , plusieurs fois. Cependant, il est douteux que les anthocyanes puissent également développer ce puissant effet antioxydant in vivo , car leur biodisponibilité est faible. Dans le corps humain, ils se lient aux radicaux libres et protègent ainsi l' ADN ainsi que les lipides et les glucides des dommages. D'autres effets sont attribués aux anthocyanes : Ils sont censés améliorer les processus visuels, avoir un effet protecteur anti-inflammatoire et vasculaire.
Les anthocyanes ne sont que très peu toxiques. Les anthocyanes ingérées par les plantes ne présentent aucun danger.
Preuve individuelle
- ↑ Jens Fleschhut : « Études sur le métabolisme, la biodisponibilité et les effets antioxydants des anthocyanes » , thèse 2004 ; Tableaux 1.2 et 1.3. urne : nbn : de : swb : 90-26403
- ↑ Lidija Jakobek, Marijan Seruga, Martina Medvidovic-Kosanovic, Ivana Novac : Teneur en anthocyanes et activité antioxydante de divers jus de fruits rouges ; Dans : Deutsche Lebensmittel-Rundschau. 103e volume, numéro 2, 2007.
- ↑ BUCHWEITZ, M., KAMMERER, DR, CARLE, R. : Amélioration significative : Stabilisation des anthocyanes avec des hydrocolloïdes (PDF ; 2,1 Mo) ; Dans : Lebensmitteltechnik, 2012, p. 42-43.
- ↑ a b c H.-D. Belitz, Hans-Dieter Belitz, Werner Grosch, Peter Schieberle : Manuel de chimie alimentaire . 5ème, entièrement révisé. Édition. Springer, Berlin [et al.] 2001, ISBN 978-3-540-41096-6 , p. 814 , tab.18.22 .
- ↑ pK une de détermination de la valeur (PDF, 185 ko).
- ↑ Robert E. Asenstorfer, Patrick G. Iland, Max E. Tate, Graham P. Jones: Charge equilibria and pKa of malvidin-3-glucoside by electrophoresis , Analytical Biochemistry , Volume 318, Issue 2, 15 July 2003, p. 291 -299. ( doi: 10.1016 / S0003-2697 (03) 00249-5 ).
- ↑ a b Propriétés de couleur des delphinidine-3-monoglucosides à différentes valeurs de pH ( Memento du 29 octobre 2013 dans Internet Archive ).
- ↑ 4.1.3 Séparation des résidus glycosidiques sur les anthocyanes ( Memento du 4 octobre 2013 dans Internet Archive ). (PDF; 109 Ko).
- ↑ Substances naturelles comme indicateurs de pH .
- ↑ Les colorants jaunes absorbent en dessous de 400 nm, voir Quercétine , Chalcon à 350 nm.
- ↑ Pericles Markakis (Ed.) : Les anthocyanes comme colorants alimentaires . Elsevier, Oxford 2012, ISBN 978-0-323-15790-2 , p. 17 ( aperçu limité dans la recherche Google Book).
- ^ Gregory T. Sigurdson, M. Monica Giusti: Effets bathochromes et hyperchromes de la complexation du sel d'aluminium par les anthocyanes de sources comestibles pour le développement de la couleur bleue . Dans : Journal de chimie agricole et alimentaire . ruban 62 , non. 29 , 23 juillet 2014, ISSN 0021-8561 , p. 6955-6965 , doi : 10.1021 / jf405145r ( acs.org [consulté le 28 avril 2021]).
- ↑ Entrée sur E 163: anthocyanes dans la base de données européenne sur les additifs alimentaires, consulté le 16 Juin, à 2020.
- ↑ S. Koswig, H.-J. Hofsommer : méthode HPLC pour l'analyse des anthocyanes dans les jus colorés et autres aliments colorés . Dans : Fruits liquides . ruban 62 , non. 4 , 1995, p. 125-130 .
Littérature
- E. Bayer (1966) : Formation complexe et couleurs des fleurs . Dans : Angew. Chem. , volume 78, n° 18-19, pages 834-841. doi: 10.1002 / anie.19660781803 .
- K. Herrmann (1986) : Colorants anthocyaniques dans les aliments . Dans : Nutrition Umschau , volume 33, n° 9, pages 275-278.
- K. Herrmann (1995) : Indications d'un effet antioxydant des anthocyanes . Dans : Gordian , Vol.95 , No.5 , pp.84-86.
- MN Clifford (2000) : Anthocyanes - nature, occurrence et charge alimentaire . Dans : Journal of the Science of Food and Agriculture , volume 80, n° 7, pp. 1063-1072. doi : 10.1002 / (SICI) 1097-0010 (20000515) 80 : 7 <1063 :: AID-JSFA605> 3.0.CO; 2-Q .
- G. Mazza, E. Miniati : Anthocyanes dans les fruits, les légumes et les céréales . CRC Press, Boca Raton 1993. ISBN 0-8493-0172-6 .
- H. Halbwirth (2010): La création et la pertinence physiologique des modèles d'hydroxylation divergents dans la voie des flavonoïdes dans Int J Mol Sci. , volume 11, pages 595-621, PMC 2852856 (texte intégral gratuit).
- Maria Claudia Lazzè, Monica Savio, Roberto Pizzala, Ornella Cazzalini, Paola Perucca, Anna Ivana Scovassi, Lucia Anna Stivala, Livia Bianchi : Les anthocyanes induisent des perturbations du cycle cellulaire et l'apoptose dans différentes lignées cellulaires humaines . Dans : Carcinogenèse . ruban 25 , non. 8 , 2004, p. 1427-1433 , doi : 10.1093/carcin/bgh138 .
- Wang E, Yin Y, Xu C, Liu J. Isolement de mélanges d'anthocyanes de haute pureté et de monomères à partir de myrtilles à l'aide de techniques chromatographiques combinées. J Chromatogr A. 31 janvier 2014, 1327 : 39-48. doi: 10.1016 / j.chroma.2013.12.070. Publication en ligne du 30 décembre 2013. PMID 24433700 .