Le cycle de l'acide citrique
| Parent |
| Catabolisme de l'acétyl-CoA |
| Ontologie des gènes |
|---|
| QuickGO |
L' acide citrique du cycle (également du cycle du citrate , de l' acide citrique du cycle , le cycle de l' acide tricarboxylique , cycle de Krebs ou cycle de Szent-Györgyi-Krebs ) est un cycle de biochimiques des réactions qui joue un rôle important dans le métabolisme (métabolisme) de aérobie des cellules d' êtres vivants et principalement pour la décomposition oxydante des substances organiques. Le but de la production d'énergie et de la fourniture de produits intermédiaires pour la biosynthèse est utilisé. L' acétyl-CoA qui se forme comme produit intermédiaire lorsque les graisses , les sucres , l' alcool et les acides aminés sont décomposés est décomposé en dioxyde de carbone (CO 2 ) et en eau (H 2 O). Des produits intermédiaires qui peuvent être utilisés pour constituer des composants organiques du corps de l'être vivant ( anabolisme ) sont formés, ainsi que de l'énergie directement et indirectement disponible sous forme biochimiquement disponible (sous forme d' adénosine triphosphate ATP).
Le cycle de l'acide citrique se déroule chez les eucaryotes dans la matrice des mitochondries chez les procaryotes dans le cytoplasme de. La séquence inverse des réactions a lieu dans le soi-disant cycle de l'acide citrique réducteur , que certaines bactéries utilisent pour assimiler le dioxyde de carbone .
étymologie
Il est nommé d'après le citrate de produit intermédiaire résultant , l' anion de l'acide citrique . La séquence de réaction est également connue sous le nom de cycle de Krebs après son découvreur Hans A. Krebs (1900–1981) . En plus de Fritz Albert Lipmann , Krebs a reçu le prix Nobel de médecine en 1953 pour avoir clarifié les voies de dégradation métabolique.
Découverte
En 1937, le biochimiste Hans Adolf Krebs (en collaboration avec William Arthur Johnson) fut le premier à postuler le cycle du citrate comme voie d' oxydation du pyruvate . Krebs a étudié l'influence de divers acides organiques sur la consommation d'oxygène lors de l'oxydation du pyruvate en utilisant des suspensions de poitrines de pigeon écrasées. Ce muscle de vol est particulièrement bien adapté à l'examen car il a une activité oxydante élevée due à une vitesse de respiration très élevée. Krebs a confirmé l'observation d' Albert Szent-Györgyi , entre autres , selon laquelle les acides C 4 - dicarboxyliques des tissus animaux ( succinate , L - malate , fumarate et oxaloacétate ) stimulent la consommation d'oxygène des muscles. Krebs a confirmé cette observation et a constaté que l'oxydation du pyruvate produisait également un tel effet. Ceci est illustré par C 6 tricarboxylique acides citrate, cis - aconitate et isocitrate , ainsi que le C 5 composé α-cétoglutarate stimulés. D'autres acides organiques n'ont pas montré l'effet mentionné. Cependant, cela était extrêmement important, car de très petites quantités conduisaient déjà à une oxydation d'une quantité multiple de pyruvate.
La deuxième observation importante du cancer était que le malonate - étroitement lié au succinate et un inhibiteur compétitif de la succinate déshydrogénase - inhibe l' utilisation aérobie du pyruvate dans les suspensions musculaires, quel que soit l'acide organique actif ajouté. Cela montre que le succinate et la succinate déshydrogénase doivent être des composants essentiels de la réaction impliquée dans l'oxydation du pyruvate.
À partir de ces observations de base et de preuves supplémentaires, Krebs a conclu que les acides tri- et dicarboxyliques actifs énumérés ci-dessous pourraient être disposés dans un ordre chimiquement logique. Étant donné que l'incubation du pyruvate et de l'oxaloacétate avec du tissu musculaire écrasé a provoqué une accumulation de citrate dans le milieu, Krebs a conclu que cette séquence ne fonctionne pas de manière linéaire, mais cyclique - sa fin est liée à son début. Il ne s'était trompé que sur la dernière réponse manquante. Ne s'applique pas: pyruvate + oxaloacétate → citrate + CO 2 . Ainsi, Krebs a suggéré que la voie qu'il a appelée le «cycle de l'acide citrique» était la voie principale de l'oxydation des glucides dans le muscle.
Rôle dans le métabolisme
Les produits de dégradation de divers nutriments, qui sont décomposés dans le métabolisme, se jettent dans le cycle de l'acide citrique. L'acétyl-CoA, l'acide acétique lié à la coenzyme A , peut être décrit comme le produit de dégradation central de diverses classes de nutriments. Les molécules d'acétyl-CoA sont formées directement à partir d' acides gras, par exemple par β-oxydation . Dans la glycolyse, les glucides sont décomposés en pyruvate (acide pyruvique), qui est ensuite décarboxylé en acétate par le complexe pyruvate déshydrogénase et le résidu acétyle est lié à la coenzyme A. Enfin, les protéines sont également hydrolysées en acides aminés qui, après désamination , peuvent être convertis en leurs α- cétoacides correspondants , par exemple α-cétoglutarate d' acide L - glutamique ou oxaloacétate de L- aspartate. Ces céto-acides sont souvent des intermédiaires dans le cycle de l'acide citrique et y pénètrent directement.
Lorsque l'acétyl-CoA est dégradé via le cycle de l' acide citrique, de l'énergie est obtenue sous forme de GTP , ainsi que des agents réducteurs ( NADH , FADH 2 ). Au cours de ces processus, le résidu acétyle de l'acétyl-CoA est progressivement décomposé en dioxyde de carbone et en eau. Les électrons obtenus dans le cycle de l'acide citrique et liés aux coenzymes (NAD + et FAD) sont introduits dans la chaîne respiratoire et transférés à l'accepteur d'électrons terminal oxygène (O 2 ). L'énergie libérée est utilisée pour former l'ATP.
Le cycle de l'acide citrique sert également de fournisseur de diverses molécules précurseurs de l' anabolisme . Par exemple, les α-céto-acides peuvent être retirés du cycle afin de former des acides aminés ou d'autres substances. L'oxaloacétate peut également être réinjecté dans la gluconéogenèse.
procédure
Chez les eucaryotes , le cycle de l'acide citrique a lieu dans les mitochondries , chez les procaryotes dans le cytoplasme ou, si nécessaire, dans les équivalents mitochondriaux. C'est un processus métabolique amphibolique , i. c'est-à-dire qu'il peut servir à la fois les voies anaboliques et cataboliques . Le cycle de l'acide citrique fait partie des processus de dégradation oxydative et précède la chaîne respiratoire dans les organismes aérobies.
Le cycle de l'acide citrique peut être considéré comme la troisième des quatre étapes du catabolisme des glucides. Elle a lieu après glycolyse et décarboxylation oxydative du pyruvate en acétyl-CoA, mais avant la fin de l'oxydation dans la chaîne respiratoire .
Le bilan net suivant peut être établi pour le cycle de l'acide citrique:
L'acétyl-CoA, acide acétique lié à la coenzyme A, également connu sous le nom d'acide acétique «activé», est décomposé en dioxyde de carbone (CO 2 ), hydrogène (il est lié aux porteurs hydrogène / électron NADH et FADH 2 ) et coenzyme A par le cycle de l'acide citrique . Voici le diphosphate de guanosine (GDP) phosphorylé en guanosine triphosphate (GTP).
Dans la chaîne respiratoire, les électrons liés au NADH et au FADH 2 (8 équivalents de réduction par acétyl-CoA ) sont transférés à l'oxygène en tant qu'accepteur d'électrons terminal. L'énergie libérée lors de la migration des électrons à travers la chaîne respiratoire du complexe protéique au complexe protéique et enfin à l'oxygène est rendue utilisable en transportant des protons de l'intérieur de la mitochondrie (matrice) dans l'espace intermembranaire et créant ainsi une différence de potentiel, une chimiosmose. potentiel ΔP, à travers le gradient de protons se forme. Poussée par ce potentiel, l' ATP synthase phosphoryle finalement l' ADP en ATP. Les organismes anaérobies ne peuvent pas laisser le cycle de l'acide citrique se dérouler complètement; il y est interrompu. C'est parce qu'ils n'ont pas le complexe α-cétoglutarate déshydrogénase pour convertir l'α-cétoglutarate en succinyl-CoA ou cela est réprimé.
Lorsque le 2 pyruvate est dégradé via l'acétyl-CoA et le cycle de l'acide citrique ainsi que l'oxydation de l'hydrogène séparé (20 équivalents de réduction) dans la chaîne respiratoire, 25 ATP fournit beaucoup plus d'énergie que dans la glycolyse du glucose jusqu'à 2 pyruvate, dans lequel seulement 2 ATP sont formés.
Réactions partielles

La séquence de réaction est décrite dans la figure ci-dessus. Le point de départ du cycle de l' acide citrique est une addition d' acétyl-CoA à l' oxaloacétate catalysée par la citrate synthase et une hydrolyse subséquente pour former du citrate ( 1 ). Si nécessaire, le citrate est retiré du cycle et introduit dans la biosynthèse du cholestérol ou la synthèse des acides gras . Ces processus se déroulant dans le cytosol nécessitent de l'acétyl-CoA, qui - contrairement au citrate - est incapable de traverser la membrane mitochondriale, mais peut être synthétisé à partir du citrate ( navette de citrate ). L'acétyl-CoA pour le cycle de l' acide citrique peut provenir de diverses sources, par exemple de la β-oxydation d'acides gras.
L' isomérisation ultérieure 2a-b du citrate par l' aconitase donne l' isocitrate . L'importance de cette étape réside dans la conversion d'un alcool tertiaire (citrate) difficile à oxyder en un alcool secondaire (isocitrate) facile à oxyder .
L'isocitrate est oxydé et décarboxylé par l' isocitrate déshydrogénase aux étapes 3a-b . En plus du premier équivalent de réduction NADH, il se forme un α-cétoglutarate (autre nom: 2-oxoglutarate), un produit intermédiaire également important pour le métabolisme des acides aminés ( voie métabolique cataplérotique : transamination réductrice en L - glutamate ⇒ biosynthèse des acides aminés; voie métabolique anaplérotique : désamination du glutamate ⇒).
La réaction suivante 4 , qui délivre une seconde molécule de CO 2 en plus du NADH via une décarboxylation oxydative , est catalysée par le complexe α-cétoglutarate déshydrogénase , qui est fonctionnellement et structurellement similaire au complexe pyruvate déshydrogénase. Des expériences avec des substrats marqués par des isotopes montrent que le CO 2 libéré dans le procédé ne peut pas être attribué au carbone du groupement carbonyle des acétyl-CoAs, mais, comme celui de l'étape 3b, provient de l'oxaloacétate.
Le succinyl-CoA qui en résulte est un autre produit clé du cycle de l'acide citrique ( voie métabolique cataplérotique : biosynthèse de la porphyrine ; voies métaboliques anaplérotiques: dégradation des acides aminés L - valine , L - isoleucine et L - méthionine , oxydation des acides gras impairs , voir aussi oxydation des acides gras ).
Le moyen de l' hydrolyse catalysée par succinyl-CoA synthetase de 5 du thioester succinyl-CoA à haute énergie en succinate est le seul équivalent énergétique du cycle de l'acide citrique sous forme de GTP. Une nucléoside diphosphate kinase peut convertir le GTP en ATP.
À l'étape 6, le succinate est le substrat de la succinate déshydrogénase , qui, par oxydation, fournit un troisième équivalent de réduction sous forme de FADH 2 ainsi que de fumarate , qui se produit également par une voie métabolique anaplérotique par la dégradation des acides aminés L - acide aspartique , La L - phénylalanine et la L - tyrosine dans le cycle de l 'acide citrique sont introduites.
La fumarase catalyse l ' addition stéréospécifique d' eau à la double liaison du fumarate à l 'étape 7 , de sorte que du L - malate se forme. A l'étape 8 , la malate déshydrogénase convertit le L-malate en substrat de la première étape, l'oxaloacétate, avec récupération du NADH. Cela ferme le cycle. D'autres voies métaboliques sont liées à l'oxaloacétate (cataplérotique: transamination réductrice en aspartate ⇒ biosynthèse des acides aminés; anaplérotique: désamination de l'aspartate ⇒ oxydation des acides aminés).
| Substrat | Réactifs / coenzymes |
enzyme | Type de réaction | Les inhibiteurs | Activateurs | Produits / Coenzymes |
|
|---|---|---|---|---|---|---|---|
| 1 | Oxaloacétate | Acétyl-CoA, eau | Citrate synthase | condensation | Citrate, NADH, succinyl-CoA, ATP | Citrate | |
| 2a | Citrate | - | Aconitase | Déshydratation | aconitate de cis , eau | ||
| 2 B | aconitate de cis | l'eau | L'hydratation | Isocitrate | |||
| 3a | Isocitrate | NAD + | Isocitrate déshydrogénase | oxydation | NADH, ATP | Ca 2+ , ADP | Succinate oxalique, NADH |
| 3b | Succinate oxalique | H + | Décarboxylation | α-cétoglutarate, CO 2 | |||
| 4e | α-cétoglutarate | NAD + , CoA-SH | Complexe α-cétoglutarate déshydrogénase | Décarboxylation oxydative | NADH, succinyl-CoA | Ca 2+ | Succinyl-CoA, NADH, CO 2 |
| 5 | Succinyl-CoA | PIB, phosphate | Succinyl-CoA synthétase | Transfert de phosphate | Succinate, GTP, CoA-SH | ||
| 6e | Succinate | MODE | Succinate déshydrogénase | oxydation | Malonate | Mg 2+ | Fumarate, FADH 2 |
| 7e | Fumarate | l'eau | Fumarase | L'hydratation | L-malate | ||
| 8ème | L- Malat | NAD + | Malate déshydrogénase | oxydation | Oxaloacétate, NADH | ||
| Ne fait pas partie du cycle de l'acide citrique: | |||||||
| UNE. | Pyruvate | NAD + , CoA-SH | Complexe de pyruvate déshydrogénase | Décarboxylation oxydative | NADH, acétyl-CoA | Ca 2+ | Acétyl-CoA |
| B. | Pyruvate | ATP, H + , CO 2 | Pyruvate carboxylase | Carboxylation | Acétyl-CoA | Oxaloacétate, ADP, phosphate | |
régulation
Le cycle de l'acide citrique en tant que pivot central du métabolisme aérobie est soumis à de fortes influences régulatrices. Outre l' inhibition du produit («rétroaction négative», inhibition compétitive ) et l' inhibition par d'autres composés intermédiaires , en particulier le NAD + / NADH, l'ADP / ATP et le Ca 2+ jouent un rôle majeur comme effecteurs . En particulier, les sous-étapes d' exergonie majeure sont soumises à un contrôle réglementaire : synthèse de citrate 1 (ΔG o = -38 kJ / mol), formation de cétoglutarate 3 (ΔG o = -7 kJ / mol) et formation de succinyl-CoA 4 (ΔG o = -37 kJ / mol).
Les étapes partielles exergoniques mentionnées ci-dessus sont inhibées par des taux élevés de NADH. Par exemple, si la chaîne respiratoire s'arrête en raison d'un manque d'oxygène, si moins de NADH est consommé et que sa concentration augmente, le cycle d'acide citrique peut également s'arrêter.
Si, par contre, peu d'énergie est nécessaire (par exemple, les muscles au repos), la concentration d'ATP augmente à mesure que la concentration d'ADP diminue. Alors que l'ADP est un activateur allostérique de l'isocitrate déshydrogénase, l'ATP inhibe son effet: le cycle est ralenti.
D'autres effecteurs du cycle de l'acide citrique peuvent être trouvés dans le tableau.
Les inhibiteurs
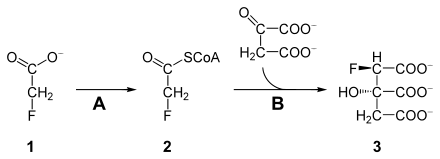
Le fluoroacétate est toxique car il peut bloquer le cycle de l'acide citrique. Le fluoroacétate ( 1 ) est d'abord métabolisé par une acétyl-CoA synthétase ( A , EC 6.2.1.1 ) en fluoroacétyl-CoA ( 2 ). Le fluoroacétyl-CoA, comme son analogue acétyl-CoA, est catalysé par la citrate synthase ( B ) et condensé avec l'oxaloacétate. Le produit, (2 R , 3 S ) -fluorocitrate ( 3 ), ne peut pas être traité par l'aconitase et la bloque, de sorte que le cycle de l' acide citrique se rompt à ce stade. La cellule est coupée de l'alimentation en énergie et meurt (synthèse létale).
Cycle d'acide citrique chez l'homme
Chez l'homme également, les sucres sont décomposés en CO 2 et H 2 O via la glycolyse , la décarboxylation oxydative du pyruvate et le cycle de l'acide citrique avec la formation des vecteurs énergétiques NADH + H + , FADH 2 , GTP et ATP . L'énergie des vecteurs énergétiques formés (à l'exception de l'ATP) est transférée via la chaîne respiratoire à l' ADP , qui peut ensuite être transformée en ATP supplémentaire à l'aide d'un résidu de phosphate . Ici, NADH + H + libère approximativement l'énergie qui peut être utilisée pour former 3 ATP, FADH 2 libère approximativement l'énergie nécessaire pour former 2 ATP, GTP fournit l'énergie pour la formation d'une molécule d'ATP ADP et phosphate.
Avec une demande de performance accrue, due à un manque d'oxygène, sans lequel la chaîne respiratoire ne peut pas fonctionner, un pourcentage croissant du pyruvate obtenu dans la glycolyse n'est plus converti de manière aérobie en acétyl-CoA, mais en anaérobie avec consommation d'un NADH + H + par molécule de pyruvate en L - lactate , l ' anion de l' acide lactique. Il semble incompréhensible que NADH + H + soit consommé, car le corps a réellement besoin d'énergie dans cette situation. À y regarder de plus près, cependant, cette étape est nécessaire et énergisante, car le NADH + H + ne peut de toute façon pas être converti en ATP par la chaîne respiratoire (manque d'oxygène). Cependant, le 2 ATP, qui peut être utilisé directement par les muscles sans chaîne respiratoire, peut être formé lors de la glycolyse en décomposant 1 molécule de glucose en 2 molécules de pyruvate. Cela crée également 2 molécules de NADH + H + , de sorte qu'à la fin il y a un gain d'énergie de 2 ATP. Cependant, pour que la formation du pyruvate se déroule de manière régulière, il faut s'assurer que le pyruvate est éliminé du système encore et encore (afin que la concentration ne devienne pas trop élevée), ce qui se produirait normalement via la décarboxylation et le cycle de l'acide citrique. Comme cela n'est pas possible en raison d'un manque d'oxygène, comme mentionné, le pyruvate est décomposé en lactate. Ainsi, la glycolyse peut continuer et au moins 2 ATP se forment:
| Processus métabolique | Bilan énergétique |
|---|---|
| Conversion de 2 pyruvates en 2 lactates | −6 ATP (2 NADH + H + ) |
| Répartition de 1 glucose en 2 pyruvate | +8 ATP (2 NADH + H + et 2 ATP) |
| Balance par molécule de glucose | +2 ATP |
L'acide lactique doit être décomposé au-dessus d'une certaine concentration car il a un effet de réduction des performances en abaissant la valeur du pH . Les muscles libèrent du lactate dans le sang, qui est ensuite transporté vers le foie. Le lactate est ensuite converti en glucose dans le foie par le processus de gluconéogenèse . Ici, il faut plus d'énergie que celle absorbée par le muscle. Le processus de conversion du pyruvate en lactate n'est donc bénéfique qu'à court terme en termes d'énergie lorsqu'il est observé régionalement sur le muscle. Pour l'organisme dans son ensemble, cependant, cela signifie des pertes d'énergie à long terme (voir aussi cycle de Cori ). Cela montre que dans des situations extrêmes - ici des exigences de performances élevées - le corps peut être prêt à perdre de l'énergie à long terme afin d'atteindre les performances requises à court terme.
Le glucose formé dans le foie peut alors être réabsorbé par les cellules musculaires à travers le sang. Ce cycle est également connu sous le nom de cycle de Cori . La capacité à maintenir des performances élevées malgré des niveaux élevés de lactate est appelée tolérance au lactate dans la théorie de l'entraînement physiologique .
→ voir aussi: glycolyse , fermentation lactique
variantes
Les voies métaboliques modifiées du cycle de l'acide citrique, dans lesquelles une étape partielle est manquante, sont la norme chez les bactéries (13 sur 17 examinées). L'étape manquante peut ou non être remplacée par d'autres étapes de réaction. En fait, seuls deux types de bactéries sont connus pour avoir une activité de cétoglutarate déshydrogénase (KDH): Bacillus japonicum et Escherichia coli . La bactérie Escherichia coli exécute le cycle complet de l'acide citrique comme décrit dans des conditions aérobies . Dans des conditions anaérobies , il est capable de désactiver le KDH. Les voies métaboliques, qui formaient auparavant un cercle, sont désormais liées comme un arbre. M. tuberculosis, en revanche, peut basculer entre deux cycles d'acide citrique différents, tous deux différents de la voie eucaryote.
Les archées , mais aussi certaines bactéries, comme Helicobacter pylori , qui se développe dans des conditions microaérophiles, catalysent la conversion de l'α-cétoglutarate en succinyl-CoA au moyen d'un 2-cétoglutarate sensible à l'oxydation: la ferrédoxine oxydoréductase (OGOR, EC 1.2.7.3 ) . Contrairement à l'OGDC, celui-ci contient des amas de fer-soufre ; la flavine et l'amide d'acide lipoïque sont absents. Au lieu de NADH, la ferrédoxine est utilisée comme équivalent de réduction. Aussi Mycobacterium tuberculosis contient une enzyme dépendante CoA qui, cependant, est stable même dans des conditions aérobies.
Dans diverses mycobactéries (y compris Mycobacterium tuberculosis ), la sous-unité E1 de la cétoglutarate déshydrogénase est remplacée par une cétoglutarate décarboxylase, qui, indépendamment de la coenzyme A, produit initialement du succinate semialdéhyde, qui est converti d'une succinate semialdéhyde déshydratée dépendante du NADP + en succinate déshydratée déshydratée. .
renversement
Chez certaines bactéries, le cycle de l'acide citrique fonctionne dans l'ordre inverse pour l' assimilation du dioxyde de carbone ( cycle de l'acide citrique réducteur ). Ici, avec la consommation d'ATP et l'utilisation d'agents réducteurs, trois étapes énergétiquement défavorables du cycle de l'acide citrique oxydatif sont contournées: la citrate synthase est remplacée par une ATP citrate lyase, l'α-cétoglutarate déshydrogénase par une α-cétoglutarate synthase et la succinate -Déhydrogénase par une fumarate réductase.
En 2018, des groupes de recherche sur deux bactéries anaérobies thermophiles réductrices de soufre ( Desulfurella acetivorans et Thermosulfidibacter takaii ) ont découvert qu'ils utilisent un ordre inverse du cycle de l' acide citrique, mais ne codent pas un gène pour la citrate lyase ATP-dépendante requise dans le cycle de l'acide citrique réducteur. Cette voie métabolique a été appelée le cycle de l'acide citrique oxydant inverse ou inverse («roTCA») pour différencier le cycle de l'acide citrique réducteur («rTCA»). Les bactéries réussissent à inverser la formation du citrate en métabolisant efficacement les métabolites successeurs malate et acétyl-CoA; en conséquence, la concentration d'oxaloacétate est extrêmement faible, de sorte que l' équilibre du clivage du citrate est déplacé du côté de l'oxaloacétate. En économisant une molécule d'ATP, une seule molécule d'ATP est nécessaire dans le roTCA pour fixer deux molécules de CO 2 . Cela correspond aux besoins énergétiques de la voie réductrice de l'acétyl-CoA .
Voir également
- Respiration cellulaire
- Cycle du glyoxylate
- Cycles biochimiques
- Métabolisme du glucose
- Cycle d'acide citrique réducteur
Littérature
- Reginald Garrett, Charles M. Grisham: Biochimie . Édition étudiante internationale. 4e édition, Cengage Learning Service, Australie 2009, ISBN 0-495-11464-2 , p. 563ff.
- Geoffrey Zubay: biochimie. 4e édition. Mcgraw-Hill International, Londres 1999, ISBN 3-89028-701-8 .
- Donald Voet, Judith G. Voet: Biochimie . Wiley-VCH, Weinheim 1994, ISBN 3-527-29249-7 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochimie. 6e édition. Spectrum, Heidelberg 2007, ISBN 3-8274-1800-3 .
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (trad.): Biochimie. 4e édition. Pearson Studium, Munich 2008, ISBN 3-8273-7312-3 .
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (premier): Lehninger Biochemie. 4e édition. Springer, Berlin 2009, ISBN 3-540-68637-1 .
liens web
- Quel est le but du cycle du citrate? ( Souvenir du 2 mai 2016 dans les archives Internet )
Preuve individuelle
- ^ Prix Nobel de médecine 1953 .
- ^ HA Krebs et WA Johnson: Le rôle de l'acide citrique dans le métabolisme intermédiaire dans les tissus animaux. Dans: Enzymologia. Volume 4, 1937, pp. 148-156 (Réimpression: HA Krebs, WA Johnson: Le rôle de l'acide citrique dans le métabolisme intermédiaire dans les tissus animaux . In: FEBS letter . 117 Suppl, 25 août 1980, pp. K1-10 , PMID 6998725 . )
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3. Édition. Springer, Berlin 2009, ISBN 3-540-41813-X , p. 626.
- ↑ Hans Günther Schlegel, Georg Fuchs (Ed.): Microbiologie générale. 8e édition. Thieme, Stuttgart 2006, ISBN 3-13-444608-1 , p. 326.
- ^ Reginald Garrett, Charles M. Grisham: Biochimie. Édition étudiante internationale. 4e édition. Cengage Learning Services, Australie 2009, ISBN 0-495-11464-2 , p. 573.
- ↑ Marc W. van der Kamp, John D. McGeagh, Adrian J. Mulholland: «Synthèse létale» du fluorocitrate par la synthase de citrate expliquée par la modélisation QM / MM . Dans: Angewandte Chemie International Edition . enregistrer 50 , non. 44 , 24 octobre 2011, ISSN 1521-3773 , p. 10349-10351 , doi : 10.1002 / anie.201103260 .
- ↑ SJ Cordwell: Génomes microbiens et enzymes «manquantes»: redéfinir les voies biochimiques . Dans: Archives of Microbiology . enregistrer 172 , no. 5 , 1 octobre 1999, p. 269-279 , doi : 10.1007 / s002030050780 , PMID 10550468 .
- ↑ X mai, MW Adams: Caractérisation d'un quatrième type d'enzyme oxydant l'acide 2-céto d'un archéon hyperthermophile: la 2-cétoglutarate ferredoxine oxydoréductase de Thermococcus litoralis . Dans: Journal of Bacteriology . enregistrer 178 , non. 20 octobre 1996, p. 5890-5896 , PMID 8830683 , PMC 178443 (texte intégral gratuit).
- ↑ SM Pitson, GL Mendz, S. Srinivasan, SL Hazell: Le cycle de l'acide tricarboxylique de Helicobacter pylori . Dans: European Journal of Biochemistry / FEBS . enregistrer 260 , non. 1 , février 1999, p. 258-267 , PMID 10091606 .
- ↑ Anthony D. Baughn, Scott J. Garforth, Catherine Vilchèze, William R. Jacobs: Une alpha-cétoglutarate ferrédoxine oxydoréductase de type anaérobie complète le cycle de l'acide tricarboxylique oxydatif de Mycobacterium tuberculosis . Dans: PLoS pathogens . enregistrer 5 , non. 11 , novembre 2009, p. e1000662 , doi : 10.1371 / journal.ppat.1000662 , PMID 19936047 .
- ↑ Jing Tian, Ruslana Bryk, Manabu Itoh, Makoto Suematsu, Carl Nathan: Variante du cycle de l'acide tricarboxylique dans Mycobacterium tuberculosis: identification de l'alpha-cétoglutarate décarboxylase . Dans: Actes de la National Academy of Sciences . enregistrer 102 , non. 30 , 26 juillet 2005, p. 10670-10675 , doi : 10.1073 / pnas.0501605102 , PMID 16027371 .
- ↑ Achim Mall et al.: La réversibilité de la citrate synthase permet la croissance autotrophique d'une bactérie thermophile . Dans: Science (New York, NY) . enregistrer 359 , non. 6375 , 2 février 2018, p. 563-567 , doi : 10.1126 / science.aao2410 , PMID 29420287 .
- ↑ Takuro Nunoura et al.: Un cycle TCA primordial et réversible dans un thermophile facultativement chimiololithoautotrophe . Dans: Science (New York, NY) . enregistrer 359 , non. 6375 , 2 février 2018, p. 559-563 , doi : 10.1126 / science.aao3407 , PMID 29420286 .
- ↑ Stephen W. Ragsdale: Réactions furtives entraînant la fixation du carbone . Dans: Science (New York, NY) . enregistrer 359 , non. 6375 , 2 février 2018, p. 517-518 , doi : 10.1126 / science.aar6329 , PMID 29420277 .