Arine
| Didéhydrobenzène en tant que diradical (formule empirique : C 6 H 4 ) |
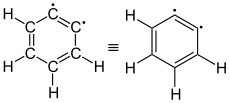 ortho- didéshydrobenzol (1,2-benzyne) |
 méta -idehydrobenzène (1,3-didéshydrobenzène) |
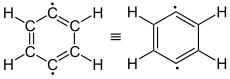 para -idehydrobenzène (1,4-didéshydrobenzène) |
En chimie , les arynes sont des intermédiaires non chargés, de courte durée, réactifs et cycliques . Ils sont dérivés des composés aromatiques , par lesquels deux substituants adjacents , principalement en position ortho , ont été séparés, ce qui donne deux orbitales atomiques avec deux électrons répartis entre ces deux atomes de carbone . Formellement, ortho- didéhydro-arynes ont une liaison carbone-carbone triple liaison en ce point . En raison de la triple liaison tendue , ces arynes ont des LUMO énergétiquement très profonds . Par conséquent, les arynes sont réactives en conséquence et ont tendance à subir des réactions d'addition . Par analogie avec les carbènes et les nitrènes , les arynes ont un état singulet et un état triplet .
récit
Dès 1902, Richard Stoermer et Bruno Kahlert , qui travaillaient à l'Université de Rostock, postulaient que la formation du 2-éthoxybenzofurane à partir de la réaction du 3-bromobenzofurane avec des bases dans l' éthanol a lieu via le stade intermédiaire réactif du 2,3-didéshydrobenzofurane. WE Bachmann et HT Clarke soupçonnaient également le didéshydrobenzène comme intermédiaire réactif dans la synthèse de Wurtz-Fittig en 1927 . D'autres recherches ont été menées en 1953 par John Dombrowski Roberts , qui a pu prouver l'existence d'arynes par la réaction de chlorobenzène marqué au 14 C avec de l'amide de potassium et une réaction ultérieure avec l' ammoniac . Roberts a découvert que le groupe NH 2 nouvellement introduit était situé à la fois sur l' atome de carbone 14 C et sur l'atome de carbone adjacent ( substitution ciné ). La formation des deux produits en quantités égales ne peut s'expliquer que par l'existence de l'intermédiaire symétrique, puisque la substitution aromatique nucléophile classique , qui se déroule par voie d'addition-élimination, ne fournit que l'isomère dans lequel le groupement NH 2 est attaché au 14 C- Atom est lié.
En 1960, Rolf Huisgen et Jürgen Sauer ont confirmé ces résultats; ils ont trouvé un rapport d'isomères de 48 pour cent à 52 pour cent, qui peut être attribué à l' effet isotopique . Erwin. F. Jenny et John D. Roberts ont trouvé des résultats similaires lors de la réaction du fluorobenzène marqué au 14 C avec du phényllithium . Après hydrolyse, ils ont obtenu un biphényle avec un taux de réarrangement de 53%.
En 1956, Georg Wittig a réussi à démontrer les intermédiaires réactifs de l'aryne en piégeant les réactions avec le furane dans diverses réactions de Diels-Alder . IP Fisher et FP Lossing ont trouvé le pic de déshydrobenzène dans des études de spectrométrie de masse en 1963 et ont pu déterminer son potentiel d'ionisation . En 1969, la première détection par spectroscopie de masse du 9,10-déshydrophénanthrène a été réalisée par Hans-Friedrich Grützmacher et Joachim Lohmann . La première détection spectroscopique infrarouge de la benzyne a succédé à OL Chapman par photolyse du peroxyde de phtaloyle , du benzocyclobutadiénon ou de l'anhydride phtalique et par spectroscopie d'isolement matriciel à basses températures. Chapman a attribué à tort une bande à 2085 cm -1 à la vibration d'étirement de la triple liaison CC , ce qui a été confirmé plus tard par d'autres groupes de recherche. Ce n'est qu'en 1992 que Juliusz G. Radziszewski a finalement réussi à prouver que la vibration d'étirement de la triple liaison CC produit une bande à 1846 cm -1 . Cela correspond à l'espérance que la triple liaison CC (formelle) due à la déformation du cycle est plus faible que celle des alcynes non sollicités, qui présentent une bande d'environ 2150 cm -1 . En piégeant les réactions avec le furane dans une réaction de Diels-Alder, Hans F. Ebel et Reinhard W. Hoffmann ont pu calculer la durée de vie du didéshydrobenzène sous vide jusqu'à un maximum de 20 ms . Ralf Warmuth a finalement réussi à isoler le 1,2-didéshydrobenzène dans un récipient moléculaire et à étudier la spectroscopie RMN 1 H et 13 C. Par comparaison avec le benzène, les données RMN peuvent être calculées comme suit: RMN 1 H δ (D 8 THF) = 7,69 ppm et 7,01 ppm; 13 C-RMN δ (D 8 THF) = 182,7 ppm, 126,8 ppm et 138,2 ppm.
La découverte de l'aryne intermédiaire
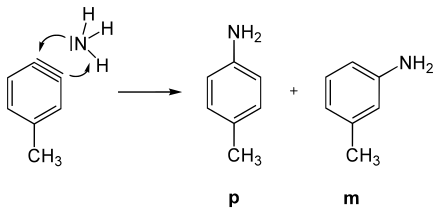
Le postulat d'un intermédiaire aryne a été fait sur la base d'une série d'expériences avec du chlorobenzène (C 6 H 5 Cl). Le chlorobenzène, un aromatique assez riche en électrons ( effet + M du chlore), s'avère très inerte envers la plupart des nucléophiles comme l' ion hydroxyde (OH - ); des températures supérieures à 200 ° C sont nécessaires pour engendrer une réaction. Avec l'amidure de sodium (NaNH 2 ) dans l' ammoniaque liquide , cependant, le chlorobenzène est converti en aniline à -33 ° C.
Si l'on considère non pas le chlorobenzène mais le p- chlorotoluène ( p -CH 3 C 6 H 4 Cl) comme composé de départ et le fait réagir avec les ions amide dans les mêmes conditions que pour le chlorobenzène, on trouve deux produits: un produit de substitution amino attendu et un inattendu. Ainsi, l'atome de chlore ne peut pas avoir été substitué directement par le groupe amino . De plus, lorsque le chlorotoluène réagit avec des ions amide, seuls les produits méta et para aminés sont trouvés, jamais l' isomère ortho .
Mécanisme de réaction
Il est connu d'après les réactions d'échange H / D que l'anion amide dans l'ammoniac liquide peut extraire des protons du benzène. Cela va particulièrement vite en position o sur (-I) -substituants, tels que B. chlore. A partir de ces faits, on peut conclure que l'atome de carbone principalement substitué par le chlore de l'aromatique n'est pas attaqué. En tant que base forte, l'ion amide déprotone un atome d'hydrogène alpha dans le chlorotoluène, qui conduit via un carbanion à un intermédiaire à triple liaison, l'aryne.
Dans l'addition ultérieure de NH 3 , à la fois le m - isomère et le p - isomère sont formées.
Le 2,6-diméthylchlorobenzène ne réagit pas pour former le dérivé d'aniline correspondant dans ces conditions. Le 2,6 - diméthylchlorobenzène ne possède pas d 'atomes d' α-hydrogène. Ainsi aucun proton ne peut être abstrait, l'aryne ne se forme pas.
Didéhydrobenzène

La liaison π «supplémentaire» est marquée en bleu .
L'aryne la plus simple, C 6 H 4 ( étiquetée 1 sur l'image de droite), est parfois appelée benzyne en raison du nom anglais . Cependant, cette désignation doit être considérée d'un œil critique, car elle implique une triple liaison spéciale. Un meilleur nom est le didéshydrobenzène ou le didéshydrobenzène , généralement appelé déshydrobenzène . Le déshydrobenzène est stabilisé par résonance , comme le montrent les structures 1 et 2 . La distribution réelle des électrons est de 3 plus apparente. La liaison π supplémentaire est située en 4a et est perpendiculaire aux liaisons π (en 4b ) du système aromatique. Le déshydrobenzène peut être décrit comme un diradical : la liaison π «supplémentaire» en 2 , 3 , 4a et 4b est ensuite scindée de manière homolytique , un électron se tenant chacun à côté de l'atome qui était auparavant impliqué dans la liaison π «supplémentaire».
En raison de la triple liaison, le déshydrobenzène est extrêmement réactif et a donc une durée de vie très courte. En solution, il réagit très rapidement avec les réactifs existants et en phase gazeuse avec lui-même pour former du di- ou triphénylène . Alors que dans les alcynes (dans le cas le plus simple de l' éthyne ), les orbitales p non hybrides sont normalement orthogonales vers le haut et le dos à l'axe moléculaire, ce qui entraîne un chevauchement optimal des orbitales, dans l'aryne, l'orbite p est déformée afin d'accueillir la triple liaison dans le système cyclique. Cela réduit le chevauchement optimal des orbitales.
Il existe trois diradicaux possibles du déshydrobenzène: 1,2-, 1,3- et 1,4-didéshydrobenzène. Les énergies de liaison sont en silico 106, 122 et 138 kcal / mol (444, 510 et 577 kJ / mol). Maitland Jones à Princeton a étudié les réarrangements possibles des 1,2-, 1,3- et 1,4-didéshydrobenzènes.
ortho -idéhydrobenzène
L' ortho- didéshydrolbenzol est l'isomère le mieux étudié du groupe des trois didéshydrobenzènes possibles. L'illustration et ses réactions seront traitées en conséquence dans ce qui suit. Comme le montre le grand nombre de publications, ceci est certainement dû à la très simple accessibilité expérimentale à travers un grand nombre de réactions de formation possibles, mais aussi au fait que les deux électrons peuvent s'apparier et ainsi atteindre l'état singulet énergétiquement plus favorable. Armin Schweig a calculé que la longueur de liaison pour la triple liaison CC dans l' ortho- didéshydrobenzène (selon le modèle de calcul ) était de 122 à 126 pm. Anita M. Orendt a déterminé une valeur de 124 ± 2 pm. Il s'agit d'une valeur proche d'une triple liaison C≡C normale, telle que l'éthyne (120,3 pm). Par coordination η -2 de la triple liaison C = C dans le complexe métallique, les ortho- dihydrobenzènes et même le tétradehydrobenzène peuvent être stabilisés et ainsi utilisés spécifiquement pour des synthèses organiques catalysées.
méta -idehydrobenzène
Contrairement aux ortho- didehydroarines, les méta et para isomères sont beaucoup plus instables et réactives. Selon réussi seulement en 1992 des groupes de travail à Wolfram Sander et Dieter Cremer, la première preuve spectroscopique IR de l'existence de 2,4-Didehydrophenol par photolyse de matrice- quinonediazide à 10 K .
Le premier isolement du 1,3-didéshydrobézole a été réalisé en 1996 dans le groupe de Wolfram Sander par photolyse de méta - para -cyclophane-9,10-dione ou par thermolyse en phase gazeuse du peroxyde de diacétyle . D'autres manières de préparer le méta-didéshydrobenzène sont la pyrolyse du 1,3-diiodobenzène ou la pyrolyse éclair sous vide du 1,3-dinitrobenzène . Le 1,3-didéshydrobenzène n'est pas très stable dans les conditions choisies et se réorganise en 3-hexène-1,5-diyne par une réaction d'ouverture de cycle.
para -idéhydrobenzène
En 1974, Richard Jones et Robert Bergman ont pu montrer qu'aux positions C-1 et C-6, le ( Z ) -hex-3-ène-1,5-diyne deutéré était converti en un mélange de 3,4- et 1,6-deutéré ( Z ) -hex-3-én-1,5-diyne passe, mais aucun isomère 1,3- ou 1,4-deutéré n'est formé. Le résultat ne peut s'expliquer que par un intermédiaire symétrique et cyclique, le 1,4-didéshydrobenzène.
La réaction de fermeture de cycle est appelée cyclisation de Bergman après son découvreur . Le fait que le 1,4-didéshydrobenzène se forme réellement pourrait être mis en évidence par des réactions de piégeage appropriées, par exemple par la formation de 1,4-dichlorobenzène en présence de tétrachlorure de carbone . Les travaux de Kyriacos Costa Nicolaou ont montré que la vitesse de cyclisation de Bergmann dépend de la proximité des deux atomes de carbone terminaux (C-1 et C-6). Dans le ( Z ) -Hex-3-én-1,5-diyne, les deux atomes de carbone terminaux sont distants de 412 pm , et la cyclisation a lieu à 200 ° C avec une demi-vie de 30 s . Si les extrémités de l' en-diine , par ex. B. rapprochés par une fermeture de cycle, la vitesse de réaction augmente. Dans le 3-cyclodécène-1,5-diyne, la distance entre C-1 et C-6 n'est que de 325 pm, et la cyclisation de Bergman a déjà lieu à température ambiante avec une demi-vie de 18 h . Mais la présence de substituants a également une influence sur la vitesse de cyclisation de Bergmann.
La cyclisation Bergman est une réaction réversible dans laquelle le 1,4-didehydrobenzene est convertie de nouveau en ( Z ) -hex-3-ène-1,5-diyne par une rétro - réaction Bergmann . Puisque l'en-diyne est le produit énergétiquement le plus stable par rapport au 1,4-didéshydrobenzène, la détection directe et l'isolement du 1,4-didéshydrobenzène sont par conséquent difficiles. La thermolyse du 1,4-diiodobenzène ne donne que de l'hex-3-én-1,5-diyne, le 1,4-didéshydrobenzène ne peut pas être détecté par spectroscopie. Dans un procédé de photolyse développé par Juliusz G. Radziszewski, cependant, le 1,4-didéshydrobenzène pourrait être représenté et caractérisé dans une matrice néon à 6 K à partir du 1,4-diiodobenzène par irradiation à 248 nm .
Hétarine
Les arynes dans lesquelles un atome de carbone a été formellement remplacé par un hétéroatome sont appelées hétarines . La présentation et les réactions des hétarines ont également été examinées dans de nombreux projets de recherche. Comme les arynes, les hétarines sont souvent formées par des réactions d'élimination de composés hétéroaromatiques halogénés. Dans leurs réactions également, les hétarines se comportent de la même manière que les arynes substituées, de sorte que l'hétéroatome peut avoir un effet directeur plus fort. La position de l'hétéroatome dans le système cyclique aromatique joue un rôle décisif. Un groupe de travail dirigé par Thomas Kauffmann a pu montrer qu'avec les quinoléines halogènes , le chlore et le brome en position 5, 6 ou 7 sont séparés via des arynes selon le mécanisme d'élimination-addition, tandis que le chlore, le brome ou l'iode en 8 positions sont séparés après l'addition -La sortie d'élimination est remplacée. Les représentants bien connus des hétarines sont environ 3,4-didéshydropyridine, 3,4-didéshydroquinoléine ou le 2,3-didéshydrobenzofurane mentionné ci-dessus. Dans le cas des dérivés halogénés de la pyridine, la formation formelle de la triple liaison peut avoir lieu en position 2,3 ou 3,4 à l'atome d'azote.
présentation
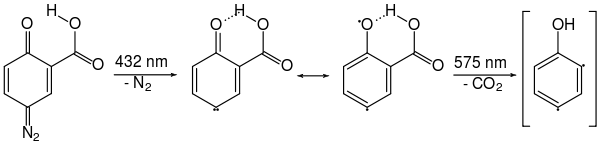
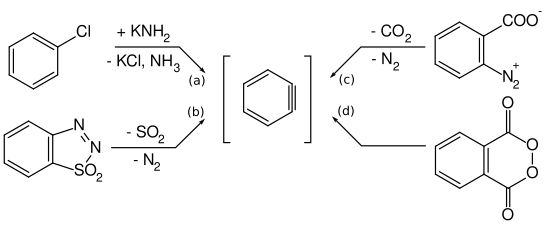
Les arynes sont principalement préparés à partir d'halogénures d'aryle par réaction avec des bases fortes selon l'équation (a). Mais d'autres voies de réaction ont également été décrites. Georg Wittig et Reinhard W. Hoffmann ont étudié la formation de didéshydrobenzène par décomposition de l'oxyde de benzothiadiazole à température ambiante selon l'équation (b). Martin Stiles et Roy G. Miller rapportent un chemin de réaction similaire par thermolyse du benzène- diazonium o -carboxylate dans du furane bouillant selon l'équation (c). Georg Wittig et Hans F. Ebel ont également rapporté la thermolyse du peroxyde de phtaloyle sous vide à 600 ° C selon l'équation (d).
La thermolyse du benzoldiazonioum- o -carboxylate, tel que l'acide anthranilique diazotisé , selon l'équation (c), a lieu via un mécanisme concerté:
Les arynes peuvent également être préparés par réaction du 1,2-fluorobromobenzène avec du lithium, des réactions de photolyse ou via des composés de Grignard avec des radicaux aromatiques.
Les recherches sur la formation d'arynes à partir d'halogénures d'aryle par réaction avec du phényllithium dans l'éther diéthylique montrent que cela se produit via un mécanisme en deux étapes. Dans la première étape, un atome d'ortho-hydrogène, qui se trouve à proximité immédiate de l'atome d'halogène, est séparé et remplacé par un métal alcalin . Ensuite, dans la deuxième étape, l'aryne est formée par séparation de l'halogénure de lithium.
Rolf Huisgen a pu montrer que dans des conditions bien choisies (phényllithium dans l'éther diéthylique ) le fluorobenzène réagit environ 10 fois plus vite que les autres halogénures d'aryle (fluor >> brome> chlore> iode). Georg Wittig et Liselotte Pohmer ont également pu montrer que la formation de déshydrobenzène est plus facile plus l'halogène est électronégatif et plus le métal est électropositif.
Constantes de vitesse de réaction pour la formation d'arynes à
partir d'halogénures d'aryle dans l'éther diéthylique à 20 ° C; 10 6 · k 2 [l · mol −1 · s −1 ]C 6 H 5 F C 6 H 5 Cl C 6 H 5 Br C 6 H 5 I. Phényllithium 40,8 4.0 4,9 2,8 Lithium pipéridide
(sans pipéridine )860 275 440 168
Si des amines sont ajoutées au mélange réactionnel, par exemple sous forme de pipéridide de lithium / pipéridine, les vitesses de réaction changent en fonction de la concentration en amine. Avec le bromobenzène , la vitesse de réaction augmente, tandis qu'à l'inverse elle diminue avec le fluorobenzène. En réduisant l'énergie d'activation de la réaction de métallation (1ère étape) dans le cas des composés fluoroaromatiques, celle-ci devient de plus en plus réversible, ce qui ralentit ou empêche en conséquence la formation d'aryne. Dans la réaction du fluoronaphtalène avec le pipéridide de lithium / pipéridine, la réaction de substitution se déroule alors de plus en plus via le mécanisme d'addition-élimination au lieu de via l'intermédiaire aryne, à mesure que la teneur en pipéridine augmente. Cela peut également expliquer la résistance du fluorobenzène à une réaction de substitution avec l'amidure de potassium dans l'ammoniac. Des recherches sur le fluorobenzène deutéré ont montré que l'étape de métallation peut se dérouler tout à fait normalement. Le produit intermédiaire est alors, en raison de la forte concentration d'ammoniac, reconverti en fluorobenzène (puis dédutéré). Rolf Huisgen a pu montrer que la vitesse de réaction de la formation d'aryne dans les dérivés de bromobenzène dépend également d'autres substituants du cycle. Par exemple, la vitesse de réaction pour un (autre) substituant brome en position ortho est de 140 fois et pour un substituant fluor est de 34 fois, tandis que les radicaux alkyle réduisent la vitesse de réaction. Si l'autre substituant est en position méta par rapport au brome, la vitesse de réaction avec le brome est 600 fois, avec le fluor même 1700 fois plus élevée. S'il y a un autre substituant en position para du brome, le changement de la vitesse de réaction est le plus petit.
Réactions / applications
Réactions aromatiques nucléophiles
Les Arynes peuvent réagir soit en tant qu'électrophiles, soit en tant que nucléophiles , selon le partenaire de réaction . En tant qu'intermédiaires électrophiles pauvres en électrons, ils réagissent facilement avec les nucléophiles. Rolf Huisgen et Jürgen Sauer ont pu montrer que les réactions nucléophiles et aromatiques ont souvent lieu via les arynes comme étapes intermédiaires. Le chemin de réaction via les arynes entre en compétition avec le chemin via une réaction d'addition-élimination. Entre autres choses, les conditions de réaction et les substituants du cycle décident laquelle des deux voies est préférée. Par exemple, lorsque les p -halo-toluènes (halogène = chlore, brome et iode) sont mis à réagir avec une solution d'hydroxyde de sodium 4 molaire à 340 ° C pour former du crésol, le processus se déroule presque complètement via une réaction d'élimination avec un intermédiaire aryne, tandis que le Le mécanisme d'addition a une part importante. Un changement dans le modèle de substitution est un indicateur important du mécanisme de réaction qui se produit dans une substitution aromatique. Si le groupe nouvellement entré est exclusivement sur le même atome de cycle, on peut supposer une réaction aromatique nucléophile classique. Dans ce cas, les groupes entrants et sortants à l'état de transition sont liés au même atome cyclique en même temps. Dans le cas d'une réaction d'élimination via les arynes , les atomes du cycle ortho (voisins) sont également inclus à la place , ce qui conduit toujours à un réarrangement partiel. John D. Roberts a étudié les réactions sur les halogénures d'aryle substitués avec de l'amide de sodium ou de potassium dans de l'ammoniaque liquide pour former des anilines substituées .
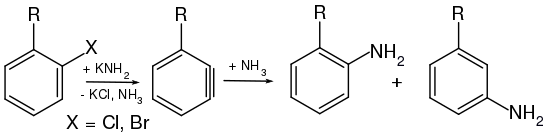
Reste (R) Halogène (X) Rendement total [%] Proportion ortho [%] Partager la méta [%] OCH 3 Br 33 0 100 CF 3 Cl 28 0 100 CH 3 Br 64 49 51 CH 3 Cl 64 45 55
L'amide de potassium peut également jouer le rôle de catalyseur et accélérer la formation de l'aryne. C'est ainsi que des réactions telles que la conversion du chlorobenzène avec l'anilide de potassium moins réactif en di- ou triphénylamine sont rendues possibles en premier lieu. Albert T. Bottini et John D. Roberts ont étudié l'hydrolyse alcaline du chlorobenzène [1- 14 C], et ont constaté que, dans les conditions du processus technique (15 pour cent NaOH, 370 ° C), la réaction de préférence via le processus d'élimination avec un Arin fonctionne comme une étape intermédiaire. En fonction des conditions de réaction choisies, en plus du phénol, le diphényléther et le o- et p- hydroxybiphényle sont également formés en différentes quantités .
Réactions de fermeture de l'anneau
Rolf Huisgen et H. König ont rapporté des réactions de fermeture de cycle intramoléculaire via des intermédiaires arynes. Une alkylarylamine, par exemple, a été mise à réagir avec du phényllithium (C 6 H 5 Li). Dans ce cas, le N -méthyl-2,3-dihydro-indole est formé via l'aryne correspondante avec un rendement de 58%. A l'opposé de cela, le composé de départ équivalent dans lequel le groupe alkyle et l'atome de chlore sont en position ortho l'un par rapport à l'autre et qui doit fournir exclusivement le N -méthyl-2,3-dihydroindole, forme une quantité significativement plus petite de produit.
Si le groupe amino contient un autre radical aromatique, les phénanthridines peuvent être synthétisées via l'intermédiaire aryne .
De même étendre cyclisation d' o - ou m -halogéno-acylanilides ou -thioacylaniliden avec du potassium amide (KNH 2 ) pour former un oxazole ou thiazole aromatique.
Réactions de Diels-Alder
Une réaction avec des arynes comme intermédiaire est la réaction de Diels-Alder avec des diènes. En quelques années, Georg Wittig a rendu compte de toute une série de réactions de Diels-Alder des arynes, entre autres avec le cyclopentadiène (a), le furane (b), les dérivés du pyrrole (c), le benzène (d), l' anthracène (e) et le cyclohexadiène ( F). L'anthracène est converti du déshydrobenzène avec le noyau benzénique central en triptycène par la réaction Diels-Alder . Le pentiptycène est les analogues de l'anthracène dans la réaction avec le 1,2,4,5-tétrabromobenzène et le butyllithium .
Par le palladium - les catalyseurs avec une régiosélectivité élevée des 1,2-didéshydrobenzènes en triphénylènes peuvent être trimérisés. En présence d'alcènes ou d'alcynes, la synthèse catalysée au palladium de dérivés de phénanthrène substitués est également réussie . Les arynes réagissent en conséquence avec les vinyl- indoles pour former des carbazoles . Le 1,2,4,5-tétrabromobenzène réagit avec le butyllithium et le furane pour former le 1,4,5,8-diépoxy-1,4,5,8-tétrahydroanthracène. Les stéréoisomères syn - et anti peuvent utiliser en raison des différentes solubilités du méthanol être séparés.
Réactions d'arylation
Si un halogénure d'aryle, tel que le chlorobenzène, est mis à réagir avec du phényllithium dans de l'éther diéthylique bouillant, il se forme du biphényle , la vitesse de réaction et le rendement étant relativement faibles. Comme mentionné ci-dessus sous l' illustration , l'aryne se forme beaucoup plus rapidement avec le pipéridure de lithium. Si du pipéridure de lithium est ajouté comme catalyseur au mélange d'halogénure d'aryle et de phényllithium , la réaction est considérablement accélérée et le rendement est amélioré.
En faisant varier le chlorure d'aryle (Aryl 1 Cl) et le composé lithium-aryle (Aryl 2 Li), il est possible de synthétiser un certain nombre de bisaryles en partie inhabituels.
Chlorure d' aryle 1 Aryl 2 -Lithium Temps de réponse en h Rendement aryle 1 - aryle 2 sans pipéridine avec pipéridine Chlorobenzène Phényllithium 9 17e 61 Chlorobenzène o-tolyllithium 2 6e 23 1-chloronaphtalène Phényllithium 2 4e 29 1-chloronaphtalène Phényllithium 9 22e 66 2-chloronaphtalène Phényllithium 2 dix 50 2-chlorobiphényle Phényllithium 6e 18e 65 9-chlorophénanthrène Phényllithium 1 13 58 9-chlorophénanthrène o-tolyllithium 1 14e 60 9-chlorophénanthrène Mésityllithium 40 9 36
Des aryldialkylamines très volumineuses, telles que la N- naphthyldiisopropylamine, qui ne sont pas accessibles par d'autres moyens, peuvent être préparées avec de bons rendements par des réactions d'arylation via des arynes .
Réactions d'insertion
Avec les triflates de 2- (triméthylsilyl) aryle, des précurseurs d'aryne très doux sont disponibles avec lesquels des réactions d'insertion sélective peuvent être effectuées. L'équation de réaction suivante montre une insertion dans une liaison CC d' un ester d'acide malonique .
Eiji Shirakawa a montré la possibilité d'insérer des arynes dans les liaisons C [BOND] N des dérivés de l' urée , et Akkattu T. Biju et Frank Glorius ont rapporté en 2010 des réactions d'insertion très sélectives d'arynes dans la liaison C [BOND] H des aldéhydes . Le 4-bromobenzaldéhyde peut être converti en 4-bromobenzophénone avec un rendement de 98%. Si le 1,2-didéshydrobenzène est mis à réagir avec des thiolates de magnésium, les arylthiolates correspondants sont obtenus. Le résidu de magnésium sur l'anneau peut être remplacé par des électrophiles appropriés.
Conversions de déshydrobenzène
La réaction du 1,2- à 1,3-didéshydrobenzène a été postulée pour expliquer la pyrolyse (à 900 ° C) du précurseur d'aryne 1 à substitution phényle en acénaphtylène 7 .
La réaction a lieu via plusieurs intermédiaires réactifs: l'aryne 2 est préparée à partir de l'anhydride phtalique phényl-substitué 1 et se réarrange en vinylidène 3 avec contraction du cycle, c'est-à-dire réduction du cyclohexa en cycle cyclopenta . Le carbène résultant subit une réaction d'insertion CH pour donner les pentalènes 4 et le clivage ultérieur d'une liaison pour donner le vinylidène 5 . Après isomérisation cis-trans en 6 , une dernière réaction d'insertion s'ensuit pour former de l'acénaphtylène. La preuve de la migration du phényle dans l'aryne 2 du 1,2-didéshydrobenzène au 1,3-didéshydrobenzène est basée sur la migration des isotopes . Si l' atome ipso -carbon est remplacé par un 13 C au stade intermédiaire, il se retrouve dans le mécanisme représenté dans l'acénaphtylène en position ipso-aryne. La présence de 13 C en position de pont ne peut être expliquée que si 15% isomérisent du 2 au 1,3-didéshydrobenzène A.
Thérapie tumorale
La formation de para-didéshydrobenzène par cyclisation de Bergman à partir d'ène diynes est d'un intérêt particulier pour la recherche, car elle peut expliquer le mécanisme d'action des cytostatiques d' énediine . Les calichéamicines , esperamicines et dynémicines utilisées dans le traitement du cancer agissent via les étapes intermédiaires réactives des dérivés de para-didéshydrobenzène et peuvent être utilisées spécifiquement pour briser les chaînes de sucre des doubles brins d'ADN in vivo , ce qui conduit à la mort cellulaire. Grâce à leur structure moléculaire particulière, la cyclisation Bergmann peut avoir lieu à température ambiante. Puisque les en-diines naturelles sont hautement toxiques, il faut développer des dérivés qui ont une toxicité maximale envers les cellules cancéreuses avec une faible toxicité envers les cellules saines.
Plus d'options
La chimie des arynes a été utilisée pour synthétiser de nouvelles arylamines dans une réaction en tandem comprenant deux réactions de Diels-Alder avec trois molécules de déshydrobenzène qui réagissent avec un imidazole :
liens web
Littérature
- Norman L. Allinger , Michael P. Cava , Don C. de Jongh , CR Johnson , NA Lebel , Calvin L. Stevens : Chimie organique. Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X , pp. 650-652.
- Hans Beyer , Wolfgang Walter : Manuel de chimie organique. 19e édition. S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2 , pages 447-448.
- RT Morrison, RN Boyd: Manuel de chimie organique. 3. Édition. Verlag Chemie, Weinheim 1986, ISBN 3-527-26067-6 , pages 1131-1136.
- A. Streitwieser. CH Heathcock: Chimie organique. Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8 , pages 1058-1060.
- Kurt PC Vollhardt , Neil E. Schore: Chimie organique. 4e édition. Wiley-VCH, Weinheim 2005, ISBN 3-527-31380-X , pages 1170-1172.
- Francis A. Carey, Richard J. Sundberg: Chimie organique avancée, Partie A: Structure et mécanisme. 5e édition. Plenum, New York, 2007, ISBN 978-0-387-44897-8 , pages 821-824.
- Reinhard W. Hoffmann : déhydrobenzène et cycloalkynes. Academic Press, 1968, ISBN 0-12-352050-9 .
- Paul Rademacher: Notes de cours Chimie organique IV: Intermédiaires réactifs (OCIV) (PDF; 4,9 Mo)
- Hans Henning Wenk: Isolation matricielle de didéshydrobenzènes fluorés et de diradicaux. Thèse. Bochum 2002, DNB 964588234 , urne : nbn: de: hbz: 294-4854 . (PDF; 4 Mo)
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Chimie organique: connaissances de base en chimie II, 5e édition. Springer Verlag, Berlin 2002, ISBN 3-540-42941-7 , pp. 119-120.
- Peter Sykes: Comment fonctionnent les réactions organiques? 2e édition. Wiley-VCH, Weinheim 2001, ISBN 3-527-30305-7 .
- Peter Sykes: Mécanismes de réaction en chimie organique. 7e édition. Verlag Chemie, Weinheim 1979, ISBN 3-527-21047-4 .
Preuve individuelle
- ^ TC Gilchrist, CW Rees: Carbenes, Nitrenes et Arynes. Th. Nelson and Sons, Londres 1969, ISBN 0-306-50026-4 .
- ^ Stefan Leisering, Christoph A. Schalley: réactivité et synthèse du tutoriel . Springer-Verlag, Berlin 2017, ISBN 978-3-662-53852-4 , p. 188 ( aperçu limité dans la recherche de livres Google).
- ^ Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Chimie organique . 6e édition. Springer-Verlag, Berlin / Heidelberg 2013, ISBN 978-3-540-77107-4 , p. 120 , doi : 10.1007 / 978-3-540-77107-4 .
- ↑ a b Hans Henning Wenk, Michael Winkler, Wolfram Sander: 100 ans de didéshydroaromatique . Dans: Angewandte Chemie . ruban 115 , non. 5 , 2003, p. 518-546 , doi : 10.1002 / anie.200390119 .
- ^ NOUS Bachmann, HT Clarke: Le mécanisme de la réaction de Wurtz-Fittig . Dans: J. Am. Chem. Soc. ruban 49 , 1927, p. 2089–2098 , doi : 10.1021 / ja01407a038 .
- ↑ JD Roberts, HE Simmons, LA Carlsmith, CW Vaughan: Réarrangement dans la réaction du chlorobenzène-1-C14 avec l'amide de potassium . Dans: J. Am. Chem. Soc. ruban 75 , 1953, pp. 3290–3291 , doi : 10.1021 / ja01109a523 .
- ↑ Erwin F. Jenny, John D. Roberts: À propos du mécanisme de formation du diphényle à partir du fluorobenzène et du phényllithium . Dans: Helvetica Chimica Acta . ruban 38 , non. 5 , 1955, pp. 1248–1254 , doi : 10.1002 / hlca.19550380520 .
- ↑ a b Georg Wittig, Liselotte Pohmer: À propos de l'occurrence intermédiaire du déshydrobenzène . Dans: Chemical Reports . ruban 89 , non. 5 , 1956, pp. 1334-1351 , doi : 10.1002 / cber.19560890539 .
- ^ A b I. P. Fisher, FP Lossing: potentiel d'ionisation de Benzyne . Dans: J. Am. Chem. Soc. ruban 85 , 1963, pp. 1018-1019 , doi : 10.1021 / ja00890a054 .
- ↑ Hans-Friedrich Grützmacher, Joachim Lohmann: Détection du 9.10-déhydro-phénanthrène par spectrométrie de masse par pyrolyse . Dans: Annals of Chemistry de Justus Liebig . ruban 726 , 1969, p. 47-66 , doi : 10.1002 / jlac.19697260109 .
- ^ OL Chapman, K. Mattes, CL McIntosh, J. Pacansky, GV Calder, G. Orr: Transformations photochimiques. LII. Benzyne . Dans: J. Am. Chem. Soc. ruban 95 , non. 18 , 1973, p. 6134-6135 , doi : 10.1021 / ja00799a060 .
- ^ Juliusz G. Radziszewski, B. Andes Hess Jr., Rudolf Zahradnik: Spectre infrarouge de o-benzyne: expérience et théorie . Dans: J. Am. Chem. Soc. ruban 114 , non. 1 , 1992, p. 52-57 , doi : 10.1021 / ja00027a007 .
- ↑ Hans F. Ebel, Reinhard W. Hoffmann: Détection du déshydrobenzène en phase gazeuse . Dans: les annales de la chimie de Liebig . ruban 673 , non. 1 , 1964, p. 1-12 , doi : 10.1002 / jlac.19646730102 .
- ↑ Ralf Warmuth: 1,2-didéshydrobenzol: un alcyne contraint ou un cumulène? - Caractérisation spectroscopique RMN dans un conteneur moléculaire . Dans: Angewandte Chemie . ruban 109 , non. 12 , 1997, p. 1406-1409 , doi : 10.1002 / anie.19971091234 .
- ^ Ralf Warmuth: Stabilisation en phase interne des intermédiaires réactifs . Dans: Eur. J. Org. Chem. Volume 2001 , no. 3 , 2001, p. 423-437 , doi : 10.1002 / 1099-0690 (200102) 2001: 3 <423 :: AID-EJOC423> 3.0.CO; 2-2 .
- ^ Frank H. Köhler: Dehydrobenzène: un problème de stabilisation (organométallique) . Dans: La chimie à notre époque . ruban 11 , non. 6 , 1977, pp. 190–196 , doi : 10.1002 / ciuz.19770110605 .
- ↑ a b c M. E. Blake, KL Bartlett, M. Jones Jr.: A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group . Dans: J. Am. Chem. Soc. ruban 125 , non. 50 , 2003, p. 6485-6490 , doi : 10.1021 / ja0213672 .
- ↑ AL Polishchuk, KL Bartlett, LA Friedman, M. Jones Jr.: Une conversion p-Benzyne en m-Benzyne par un décalage 1,2 d'un groupe phényle. Achèvement de la cascade Benzyne . Dans: J. Phys. Org. Chem. Band 17 , 2004, p. 798-806 , doi : 10.1002 / poc.797 .
- ^ Armin Schweig, Norbert Münzel, Hermann Meyer, Andreas Heidenreich: Le spectre électronique de l'o-benzyne . Dans: Chimie structurale . ruban 15 , non. 1 , p. 89-100 , doi : 10.1007 / BF00675788 .
- ↑ Anita M. Orendt, Julio C.Facelli, Juliusz G. Radziszewski, W. James Horton, David M. Grant, Josef Michl: Spectre RMN dipolaire 13 C de matrice isolée o-Benzyne-1,2- 13 C 2 . Dans: J. Am. Chem. Soc. ruban 118 , non. 4 , 1996, p. 846-852 , doi : 10.1021 / ja953417r .
- ^ Martin A. Bennett, Heinz P. Schwemlein: Complexes métalliques avec de petites cycloalkynes et arynes . Dans: Angewandte Chemie . ruban 101 , non. 10 , 1989, p. 1349-1373 , doi : 10.1002 / anie.19891011006 .
- ^ FGA Stone: Advances in Organometallic Chemistry, Volume 42 . Academic Press, 1998, ISBN 0-12-031142-9 ( pages 148-186 dans Google Book Search).
- ↑ Sabrina Brait, Stefano Deabate, Selby AR Knox, Enrico Sappa: La coordination et la transformation de Arene anneaux en métal de transition Carbonyle Cluster Complexes . Dans: Journal of Cluster Science . ruban 12 , non. 1 , 2001, p. 139-173 , doi : 10.1023 / A: 1016627113620 .
- ↑ Götz Bucher, Wolfram Sander, Elfi Kraka, Dieter Cremer: 2,4-Didehydrophenol - première détection spectroscopique IR d'une méta-aryne . Dans: Angewandte Chemie . ruban 104 , non. 9 , 1992, pp. 1225-1228 , doi : 10.1002 / anie.19921040916 .
- ↑ Ralph Marquardt, Wolfram Sander, Elfi Kraka: 1,3-Didehydrobenzol (méta-essence) . Dans: Angewandte Chemie . ruban 108 , non. 7 , 1996, p. 825-827 , doi : 10.1002 / anie.19961080719 .
- ↑ Wolfram Sander, Michael Exner, Michael Winkler, Andreas Balster, Angelica Hjerpe, Elfi Kraka, Dieter Cremer: Spectre vibratoire de m-Benzyne: une isolation matricielle et une étude computationnelle . Dans: J. Am. Chem. Soc. ruban 124 , non. 4 , 2002, p. 13072-13079 , doi : 10.1021 / ja012686g .
- ^ Un b Richard R. Jones, Robert G. Bergman: p-Benzyne. Génération comme intermédiaire dans une réaction d'isomérisation thermique et preuve de piégeage de la structure 1,4-benzènediyle . Dans: J. Am. Chem. Soc. ruban 94 , non. 2 , 1972, p. 660-661 , doi : 10.1021 / ja00757a071 .
- ↑ Thomas P. Lockhart, Paul B. Comita, Robert G. Bergman: Preuve cinétique pour la formation d'intermédiaires 1,4-déshydrobenzène discrets. Piégeage par transfert d'atomes d'hydrogène inter et intramoléculaire et observation du CIDNP à haute température . Dans: J. Am. Chem. Soc. ruban 103 , non. 14 , 1981, p. 4082-4090 , doi : 10.1021 / ja00404a018 .
- ↑ KC Nicolaou, W.-M. Dai: Chimie et biologie de l'endiine-cytostatica / antibiotique . Dans: Angewandte Chemie . ruban 103 , non. 11 , 1991, p. 1453-1481 , doi : 10.1002 / anie.19911031106 .
- ↑ Michael Klein: Synthèse, structure et propriétés des énediynes cycliques fonctionnalisées et étude des effets des substituants électroniques sur la cyclisation de Bergman des énediynes acycliques. Thèse. Regensburg 2003. (PDF; 1,4 Mo)
- ↑ Ralph Marquardt, Andreas Balster, Wolfram Sander, Elfi Kraka, Dieter Cremer, J. George Radziszewski: 1,4-Didehydrobenzol . Dans: Angewandte Chemie . ruban 110 , non. 7 , 1998, pp. 1001-1005 , doi : 10.1002 / (SICI) 1521-3757 (19980403) 110: 7 <1001 :: AID-ANGE1001> 3.0.CO; 2-D .
- ↑ Th. Kauffmann: L'Hétarine . Dans: Angewandte Chemie . ruban 77 , non. 13 , 1965, p. 557-571 , doi : 10.1002 / anie.19650771302 .
- ↑ Thomas Kauffmann, Rolf Wirthwein: Progrès dans la région hétarine . Dans: Angewandte Chemie . ruban 83 , non. 1 , 1971, p. 21-34 , doi : 10.1002 / anie.19710830104 .
- ↑ Thomas Kauffmann, Heinz Fischer, Reinhard Nürnberg, Rolf Writhwein: Hetarine, XIV À propos de la sélectivité des arynes hétéro et carbocycliques envers les bases . Dans: Annals of Chemistry de Justus Liebig . ruban 731 , no. 1 , 1970, p. 23-36 , doi : 10.1002 / jlac.19707310105 .
- ↑ Th. Kauffmann, R. Nürnberg, J. Schulz, R. Stabba: Hétarine, détection X d'une arine à 5 cycles (1-méthyl-4,5-déhydroimidazole) . Dans: Tetrahedron . ruban 8 , non. 43 , 1967, p. 4273-4280 , doi : 10.1016 / S0040-4039 (00) 73013-9 .
- ↑ Christopher J. Cramer, Stefan Debbert: Substitution hétéroatomique dans les σ biradicaux aromatiques: les six pyridynes . Dans: Chem. Phy. Lett. ruban 287 , non. 3-4 , 1998, pp. 320-326 , doi : 10.1016 / S0009-2614 (98) 00192-4 .
- ↑ Th. Kauffmann, J. Hansen, K. Udluft, R. Wirthwein: Recherches sur les arynes hétérocycliques . Dans: Angewandte Chemie . ruban 76 , non. 13 , 1964, p. 590 , doi : 10.1002 / anie.19640761375 .
- ↑ a b c Georg Wittig: 1,2-déhydrobenzol . Dans: Angewandte Chemie . ruban 77 , non. 17-18 , 1965, p. 752-759 , doi : 10.1002 / anie.19650771704 .
- ↑ a b c Rolf Huisgen, H. König: Réactions de fermeture d'anneau via Arine . Dans: Angewandte Chemie . ruban 69 , non. 8 , 1957, p. 268 , doi : 10.1002 / anie.19570690811 .
- ↑ a b c d Rolf Huisgen, Jürgen Sauer: Substitutions aromatiques nucléophiles via arynes . Dans: Angewandte Chemie . ruban 72 , non. 3 , 1960, p. 91-108 , doi : 10.1002 / anie.19600720302 .
- ↑ Georg Wittig, Reinhard W. Hoffmann: Dehydrobenzol à partir de 1,2,3-benzothiadiazol-1,1-dioxyde . Dans: Chemical Reports . ruban 95 , non. 11 , 1962, p. 2718-2728 , doi : 10.1002 / cber.19620951120 .
- ↑ Martin Stiles, Roy G. Miller: DÉCOMPOSITION DU BENZENEDIAZONIUM-2-CARBOXYLATE . Dans: J. Am. Chem. Soc. ruban 82 , non. 14 , 1960, p. 3802-3802 , doi : 10.1021 / ja01499a094 .
- ↑ a b Jan Bülle, Aloys Hüttermann: Les connaissances de base de la chimie organique: les réactions organiques les plus importantes en laboratoire et dans la nature . Georg Thieme Verlag, 2000, ISBN 3-13-119041-8 ( page 81 dans la recherche de livres Google).
- ^ Georg Wittig, Hans F. Ebel: sur l'apparition du déshydrobenzène dans les processus photochimiques et thermiques . Dans: les annales de la chimie de Liebig . ruban 650 , non. 1 , 1961, p. 20-34 , doi : 10.1002 / jlac.19616500103 .
- ↑ Ioannis Sapountzis, Wenwei Lin, Markus Fischer, Paul Knochel: Synthèse d'arynes fonctionnalisées à partir de diarylsulfonates 2-magnésés . Dans: Angewandte Chemie . ruban 116 , non. 33 , 2004, pp. 4464-4466 , doi : 10.1002 / anie.200460417 .
- ↑ a b Rolf Huisgen, Jürgen Sauer: Substitutions aromatiques nucléophiles, VIII. Cinétique de la libération de benzine à partir des halobenzènes . Dans: Chemical Reports . Volume 92, No. 1 , 1959, p. 192–202 , doi : 10.1002 / cber.19590920122 .
- ↑ R. Huisgen, W. Mack, L. Möbius: La preuve du stade intermédiaire dans les substitutions aromatiques nucléophiles avec élimination; à la structure de l'arine . Dans: Tetrahedron . ruban 9 , non. 1-2 , 1960, p. 29-39 , doi : 10.1016 / 0040-4020 (60) 80049-X .
- ^ Georg Wittig, Liselotte Pohmer: À propos de l'occurrence intermédiaire de déshydrobenzène . Dans: Chemical Reports . ruban 89 , non. 5 , 1956, pp. 1334-1351 , doi : 10.1002 / cber.19560890539 .
- ^ Rolf Huisgen, Jürgen Sauer: Réaction des naphtalènes halogènes avec le pipéridide de lithium . Dans: Angewandte Chemie . ruban 69 , non. 11 , 1957, p. 390 , doi : 10.1002 / anie.19570691109 .
- ↑ George E. Hall, Richard Piccolini, John D. Roberts: Réactions d'échange de dérivés de benzène deutérés avec de l'amide de potassium dans l'ammoniac liquide . Dans: J. Am. Chem. Soc. ruban 77 , non. 17 , 1955, p. 4540–4543 , doi : 10.1021 / ja01622a033 .
- ↑ Rolf Huisgen, Wilhelm Mack, Klaus Herbig, Nele Ott, Elisabeth Anneser: Nucleophile aromatic Substitutionen, XIV. Constantes de vitesse partielle pour la formation d'aryne à partir de bromoaromatiques utilisant le pipéridide de lithium . Dans: Chemical Reports . ruban 93 , non. 2 , 1960, p. 412-424 , doi : 10.1002 / cber.19600930222 .
- ^ Arynes comme réactifs électrophiles, 1ère édition: Réaction avec les alkylène-phosphoranes . Dans: Magazine mensuel de chimie . ruban 75 , non. 6 , 1964, p. 1759-1780 , doi : 10.1007 / BF00901736 .
- ↑ John D. Roberts, C. Wheaton Vaughan, LA Carlsmith, Dorothy A. Semenow: Orientation dans les aminations des halobenzènes substitués . Dans: J. Am. Chem. Soc. ruban 78 , non. 3 , 1956, pp. 611-614 , doi : 10.1021 / ja01584a025 .
- ^ FW Bergstrom, Richard E. Wright, Charles Chandler, WA Gilkey: L'ACTION DES BASES SUR LES COMPOSÉS HALOGÈNES ORGANIQUES. I. LA RÉACTION DES HALIDES D'ARYLE AVEC L'AMIDE DE POTASSIUM . Dans: J. Org. Chem. Band 1 , non. 2 , 1936, p. 170-178 , doi : 10.1021 / jo01231a007 .
- ^ Albert T. Bottini, John D. Roberts: Mécanismes pour les hydrolyses en phase liquide de chlorobenzène et d'halotoluènes . Dans: J. Am. Chem. Soc. ruban 79 , non. 6 , 1957, p. 1458–1462 , doi : 10.1021 / ja01563a050 .
- ↑ Kurt H. Meyer, Friedrich Bergius: À propos de la représentation du phénol du chlorobenzène . Dans: Rapports de la Société allemande de chimie . ruban 47 , non. 3 , 1914, p. 3155-3160 , doi : 10.1002 / cber.191404703117 .
- ↑ Horst König, Rolf Huisgen: Substitutions aromatiques nucléophiles, XI. Autres réactions de fermeture de cycle via arynes . Dans: Chemical Reports . ruban 92 , non. 2 , 1959, p. 429-441 , doi : 10.1002 / cber.19590920227 .
- ↑ Rolf Huisgen, Horst König, Arthur R. Lepley: Substitutionen nucléophile aromatique, XVIII. Nouvelles fermetures de bagues sur Arine . Dans: Chemical Reports . ruban 93 , non. 7 , 1960, p. 1496-1506 , doi : 10.1002 / cber.19600930708 .
- ↑ SV Kessar: Quelques nouveaux aspects de la benzyne et des cyclisations à médiation radicalaire . Dans: Journal of Chemical Sciences . ruban 100 , non. 2-3 , 1988, p. 217-222 ( PDF ).
- ↑ Bjorn F. Hrutford, JF Bunnett: UN PRINCIPE GÉNÉRAL POUR LA SYNTHÈSE DES COMPOSÉS HÉTÉROCYCLIQUES ET HOMOCYCLIQUES . Dans: J. Am. Chem. Soc. ruban 80 , non. 8 , 1958, p. 2021-2022 , doi : 10.1021 / ja01541a065 .
- ↑ a b c d Georg Wittig: Formation et réactions du déshydrobenzène (cyclohexadiénine) . Dans: Angewandte Chemie . ruban 69 , non. 8 , 1957, p. 245-251 , doi : 10.1002 / anie.19570690802 .
- ↑ Georg Wittig, Erhard Knauss: Dehydrobenzol et Cyclopentadiène . Dans: Chemical Reports . Volume 91, No. 5 , 1958, p. 895-907 , doi : 10.1002 / cber.19580910502 .
- ↑ Georg Wittig, Wolfgang Behnisch: Dehydrobenzol et N-méthyl-pyrrole . Dans: Chemical Reports . Volume 91, No. 11 , 1958, p. 2358-2365 , doi : 10.1002 / cber.19580911116 .
- ^ Martin Stiles, Roy G. Miller, Réaction de Benzyne avec le benzène et le naphtalène . Dans: J. Am. Chem. Soc. ruban 85 , non. 12 , 1963, pp. 798–1800 , doi : 10.1021 / ja00895a023 .
- ^ Georg Wittig, Renate Ludwig: Triptycène d'anthracène et de déshydrobenzène . Dans: Angewandte Chemie . ruban 68 , non. 1 , 1956, p. 40 , doi : 10.1002 / anie.19560680107 .
- ↑ Harold Hart: Iptycènes, cuppedophanes et capsophanes . Dans: Pure & App Chem . ruban 65 , 1993, p. 27-34 , doi : 10.1002 / jlac.19646730102 . Article (PDF; 989 kB)
- ↑ Diego Peña, Sonia Escudero, Dolores Pérez, Enrique Guitián, Luis Castedo: La première cyclotrimérisation efficace des Arynes catalysée par le palladium: synthèse des triphénylènes . Dans: Angewandte Chemie . ruban 110 , non. 19 , 1998, p. 2804-2806 , doi : 10.1002 / (SICI) 1521-3757 (19981002) 110: 19 <2804 :: AID-ANGE2804> 3.0.CO; 2-2 .
- ↑ Enrique Guitián, Dolores Pérez, Diego Peña: Réactions de cycloaddition catalysées par palladium d'Arynes . Dans: Palladium in Organic Synthesis, Topics in Organometallic Chemistry . ruban 14 , 2005, p. 194-206, , doi : 10.1007 / b104128 .
- ↑ Eiji Yoshikawa, Yoshinori Yamamoto: insertion intermoléculaire de déshydrobenzène-déshydrobenzène-alcène et déshydrobenzène-alcyne-alcène catalysée au palladium - synthèse de dérivés phénanthrène et naphtalène . Dans: Angewandte Chemie . ruban 112 , non. 1 , 2000, p. 185-187 , doi : 10.1002 / (SICI) 1521-3757 (20000103) 112: 1 <185 :: AID-ANGE185> 3.0.CO; 2-N .
- ↑ Diego Peña, Dolores Pérez, Enrique Guitián: Insertion d'arynes dans les σ-liaisons . Dans: Angewandte Chemie . ruban 118 , non. 22 , 2006, p. 3659-3661 , doi : 10.1002 / anie.200600291 .
- ↑ Ulf Pindur, Ludwig Pfeuffer, Manfred Eitel, Martina Rogge, Manfred Haber: Réactions Diels-Alder des vinyl indoles avec aryne et 1,4-benzoquinones: Nouveaux intercalateurs ADN potentiels . Dans: Livres mensuels de chimie / Mensuel chimique . ruban 122 , non. 4 , 1991, p. 291-298 , doi : 10.1007 / BF00810830 .
- ↑ Khalil Shahlai, Samuel Osafo Acquaah, Harold Hart: Utilisation du 1,2,4,5-tétrabromobenzène comme équivalent 1,4-benzadiyne: anti- et syn-1,4,5,8-tétrahydroanthracène 1,4: 5 , 8-diépoxydes Dans: Synthèses organiques . 75, 1978, page 201, doi : 10,15227 / orgsyn.075.0201 ; Coll. Vol.10, 2004, p. 678 ( PDF ).
- ↑ a b Rolf Huisgen, Jürgen Sauer, A. Hauser: Phénylation catalytique des aromatiques chlorés avec du phényllithium . Dans: Angewandte Chemie . ruban 69 , non. 8 , 1957, p. 267 , doi : 10.1002 / anie.19570690810 .
- ^ Rolf Huisgen, Jürgen Sauer, Alfred Hauser: Substitutionen aromatique nucléophile, VI. Arylation catalytique d'aromatiques chlorés . Dans: Chemical Reports . Volume 91, No. 11 , 1958, p. 2366-2374 , doi : 10.1002 / cber.19580911117 .
- ↑ Rolf Huisgen, Ludwig Zirngibl: Substitutions aromatiques nucléophiles, VII. Facteurs stériques et électroniques dans l'ajout de bases à la 1,2-naphtine . Dans: Chemical Reports . Volume 91, No. 11 , 1958, p. 2375-2382 , doi : 10.1002 / cber.19580911118 .
- ↑ Hiroto Yoshida, Masahiko Watanabe, Joji Ohshita, Atsutaka Kunai: Réaction d'insertion facile des arynes dans les liaisons carbone-carbone . Dans: Chem. Commun. ruban 26 , 2005, p. 3292-3295 , doi : 10.1039 / B505392G .
- ↑ Hiroto Yoshida, Eiji Shirakawa, Yuki Honda, Tamejiro Hiyama: Ajout d'urée aux Arynes: Synthèse simple des dérivés de benzodiazépine et de benzodiazocine . Dans: Angewandte Chemie . ruban 114 , non. 17 , 2002, p. 3381-3383 , doi : 10.1002 / 1521-3757 (20020902) 114: 17 <3381 :: AID-ANGE3381> 3.0.CO; 2-C .
- ↑ Akkattu T. Biju, Frank Glorius: Une hydroacylation intermoléculaire des arynes catalysée par des carbènes N-hétérocycliques . Dans: Angewandte Chemie . ruban 122 , non. 50 , 2010, p. 9955–9958 , doi : 10.1002 / anie.201005490 .
- ↑ Wenwei Lin, Ioannis Sapountzis, Paul Knochel: Synthèse de réactifs arylmagnésium fonctionnalisés par addition d'arylthiolates et d'amides de magnésium à l'aryne . Dans: Angewandte Chemie . ruban 117 , non. 27 , 2005, p. 4330-4333 , doi : 10.1002 / anie.200500443 .
- ^ Adrian L. Smith, KC Nicolaou: Les antibiotiques Enediyne . Dans: J. Med. Chem. Volume 39 , non. 11 , 1996, p. 2103-2117 , doi : 10.1021 / jm9600398 .
- ↑ Marc J. Schottelius, Peter Chen: 9,10-Dehydroanthracene: p-Benzyne-Type Biradicals Résumé de l'hydrogène de façon inhabituelle lentement . Dans: J. Am. Chem. Soc. ruban 118 , non. 20 , 1996, p. 4896-4903 , doi : 10.1021 / ja960181y .
- ↑ a b Samuel J. Danishefsky, Matthew D. Shair: Observations dans la chimie et la biologie des antibiotiques cycliques Enediyne: synthèses totales de calicheamicin γ 1 et A dynemicin . Dans: J. Org. Chem. Band 61 , non. 1 , 1996, p. 16-44 , doi : 10.1021 / jo951560x .
- ^ Elfi Kraka, Dieter Cremer: Conception informatique des médicaments anticancéreux. Une nouvelle ogive Enediyne . Dans: J. Am. Chem. Soc. ruban 122 , non. 34 , 2000, p. 8245-8264 , doi : 10.1021 / ja001017k .
- ↑ Chunsong Xie, Yuhong Zhang: Une nouvelle réaction en tandem de Benzyne: Synthèse en un seul pot d'Arylamines contenant de l'anthracène . Dans: Organic Letters . ruban 9 , 2007, p. 781-784 , doi : 10.1021 / ol063017g .