Sérotonine
| Formule structurelle | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Général | ||||||||||||||||||||||
| Nom de famille | Sérotonine | |||||||||||||||||||||
| Autres noms |
|
|||||||||||||||||||||
| Formule moléculaire |
|
|||||||||||||||||||||
| Brève description |
cristaux hygroscopiques sensibles à la lumière (chlorhydrate de sérotonine) |
|||||||||||||||||||||
| Identifiants externes / bases de données | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propriétés | ||||||||||||||||||||||
| Masse molaire | 176,22 g mol -1 (sérotonine) | |||||||||||||||||||||
| État physique |
fixé |
|||||||||||||||||||||
| Point de fusion |
167-168 °C (chlorhydrate de sérotonine) |
|||||||||||||||||||||
| p K S valeur |
10.4 |
|||||||||||||||||||||
| solubilité |
soluble dans l'eau (20 g l -1 à 27°C) et l'éthanol (3 g l -1 ) (chlorhydrate de sérotonine) |
|||||||||||||||||||||
| consignes de sécurité | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Données toxicologiques | ||||||||||||||||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | ||||||||||||||||||||||
La sérotonine , également la 5-hydroxytryptamine ( 5-HT ) ou l' entéramine , est une hormone tissulaire et un neurotransmetteur . Il se produit, entre autres, dans le système nerveux central , le système nerveux intestinal , système cardio - vasculaire et dans le sang . Le nom de cette amine biogène est dérivé de son effet sur la pression artérielle : la sérotonine est un composant du sérum qui régule le tonus (tension) des vaisseaux sanguins et contribue à la coagulation du sang . Il affecte également l'activité gastro-intestinale et la transmission des signaux dans le système nerveux central.
histoire

La présence d'une substance dans le sang qui contracte les vaisseaux sanguins a été supposée par Carl Ludwig dès le milieu du 19ème siècle . Dans les années 1930, Vittorio Erspamer isolé une substance de la muqueuse du tractus gastro - intestinal qui provoque les muscles lisses à contrat. Il l'appelait "Enteramin". En 1948, Maurice Rapport , Arda Green et Irvine Page ont isolé une substance contractant les vaisseaux sanguins et l'ont nommée « sérotonine ». La structure de cette substance, proposée par Maurice Rapport, a été confirmée par synthèse chimique en 1951 . Peu de temps après, Vittorio Erspamer a pu montrer que l'entéromine qu'il a trouvée et la sérotonine de Rapports sont identiques. En 1953, Irvine Page et Betty Twarog ont fait une autre découverte importante avec la détection de la sérotonine dans le cerveau.
Après la découverte de la sérotonine, les récepteurs responsables de ses effets ont été intensivement étudiés. John Gaddum a introduit une première distinction entre les récepteurs "D" et "M". Cependant, ce n'est qu'avec la mise en place des méthodes de biologie moléculaire dans les années 1990 qu'il est devenu évident qu'il existe au moins 14 récepteurs différents de la sérotonine chez l'homme qui sont responsables des divers effets de la sérotonine.
Occurrence

La sérotonine est répandue dans la nature. Même les organismes unicellulaires tels que les amibes peuvent produire de la sérotonine. Les plantes et les champignons supérieurs sont également considérés comme des producteurs . Dans les poils urticants de l' ortie , la sérotonine est en partie responsable de son effet bien connu. Les aliments végétaux les plus riches en sérotonine comprennent les noix , qui peuvent contenir plus de 300 µg/g de sérotonine. Mais les plantains , les ananas , les bananes , les kiwis , les prunes , les tomates , le cacao et issus de produits manufacturés comme le chocolat contiennent plus de 1 ug/g de sérotonine. La teneur inhabituellement élevée en sérotonine, en particulier dans les noix, s'explique par un mécanisme de dégradation spécifique de l' ammoniac qui se forme. Les dérivés de la sérotonine sont parfois trouvés comme ingrédient mineur dans les drogues psychoactives à base de plantes , telles que. B. DMT , 5-MeO-DMT et bufotenin en Yopo , un intoxicant psychoactif de la plante YOPO . Pour d'autres dérivés de la sérotonine, tels que la féruloylsérotonine et la 4-cumaroylsérotonine , une fonction de phytoalexine pour protéger contre les micro-organismes est supposée.
Dans le règne animal, la sérotonine peut être trouvée dans presque toutes les espèces . C'est l'un des neurotransmetteurs phylogénétiquement les plus anciens et, comme ses récepteurs, on le trouve déjà dans le système nerveux comme de simples représentants comme le nématode C. elegans . On pense que le système sérotoninergique, composé de la sérotonine et de ses récepteurs, est originaire du Précambrien il y a plus de 700 millions d'années.
| Fluide corporel | Concentration (nmol/l) |
|---|---|
| Liquide cérébro-spinal | <4 |
| Plasma pauvre en plaquettes | 4-15 |
| Plasma riche en plaquettes | 1000-2500 |
| Sérum sanguin | 300-900 |
| Le sang total | 1200 |
| urine | 900-1300 |
Dans l'organisme humain, la plus grande quantité de sérotonine se trouve dans le tractus gastro-intestinal . C'est là qu'environ 95% de la quantité totale de sérotonine du corps, estimée à 10 mg, est stockée. Environ 90 % de la sérotonine du tractus gastro-intestinal est stockée dans les cellules entérochromaffines , les 10 % restants se trouvent dans les cellules nerveuses (neurones) du système nerveux intestinal . La sérotonine dans le sang est distribuée presque exclusivement aux thrombocytes (plaquettes sanguines). Cette sérotonine est produite par les cellules entérochromaffines du tractus gastro-intestinal et absorbée par les plaquettes après avoir été libérée dans le sang. De plus, les basophiles et les mastocytes peuvent, au moins chez les rongeurs , stocker et libérer de la sérotonine. Dans le système nerveux central, la sérotonine se trouve particulièrement dans les neurones des noyaux du raphé . Une production, un stockage et une libération pathologiquement accrus de sérotonine peuvent souvent être observés dans les tumeurs neuroendocrines du tractus gastro-intestinal, les carcinoïdes , et sont responsables des symptômes caractéristiques qui les accompagnent.
chimie
Propriétés chimiques
Comme la tryptamine , la sérotonine appartient au groupe des indolamines ou tryptamines . La sérotonine est une base faible en raison de son groupe amino aliphatique primaire . Sa constante d'acidité pK S de 10,4 est comparable à celle de la tryptamine. Par conséquent, dans des conditions physiologiques, la sérotonine est majoritairement protonée . Sous sa forme protonée, la sérotonine est capable de fluorescence . Cette propriété est également utilisée pour le prouver. Le maximum d'absorption est de 309 nm et le maximum d'émission est de 336 nm.
synthèse
De nombreuses voies ont été décrites pour la production synthétique de sérotonine. Les stratégies de base de la synthèse de la sérotonine comprennent, en particulier, l'addition de la β- composant éthylamine au corps indole , l' hydroxylation de la tryptamine et la synthèse d'un squelette indole à partir de divers systèmes précurseurs possibles.
Les voies de synthèse basées sur l'introduction du composant β- éthylamine partent du 5-hydroxyindole , dont le groupe hydroxyle est protégé soit de préférence par un groupe benzyle , soit, plus rarement, par un groupe méthyle . Le premier est scindé par hydrogénolyse , le second de préférence avec du tribromure de bore . La première synthèse en laboratoire, réalisée par Hamlin et Fischer en 1951, utilise la réaction de Mannich pour produire la gramine correspondante dans une première étape de synthèse. Celui-ci est ensuite converti en un allongement de chaîne avec du cyanure dans un alcool aqueux et une hydrolyse subséquente en 5-benzyloxyindole-3-acétamide. Après réduction de l' amide et clivage ultérieur de l' éther , la sérotonine peut être isolée.
Selon une publication de Merrill E. Speeter et de ses collaborateurs presque en même temps , l' iodure de 3-(5-benzyloxy) indolyl magnésium est d'abord produit en tant que réactif de Grignard , puis mis à réagir avec du chloroacétonitrile pour former le 3-acétonitrile indole correspondant. Le nitrile est réduit et l'éther est clivé. Une variante avec des rendements améliorés, qui est liée au procédé ci-dessus, décrit la production de sérotonine [ 11 C] marquée radioactivement pour les examens de tomographie par émission de positons . Dans ce processus, la 5-méthoxygramine est convertie en composé d'ammonium quaternaire sur N 2 et substituée par du cyanure d'hydrogène [ 11 C] pour donner le 5-méthoxy-3-acétonitrile indole nucléophile . Ceci est suivi d'un clivage à l'éther et enfin d'une réduction. Une méthode, limitée à deux étapes de réaction, consiste en l'addition de nitroéthylène au 5-benzyloxyindole avec hydrogénation subséquente. Le nitrovinylindole, qui se présente comme intermédiaire, est alternativement accessible via une condensation aldolique de l'indole-3-carbaldéhyde avec le nitrométhane . Il existe également la voie éprouvée via l' acylation de Friedel-Crafts avec le chlorure d'oxalyle . Le chlorure de 5-benzyloxy-3-indole-glyoxylyle ainsi obtenu se combine avec la dibenzylamine pour former l'amide qui est réduit et débenzylé.
Une autre stratégie de synthèse est basée sur l' hydroxylation de la tryptamine en sérotonine. Après que la fonction amine a été protégée pour former la N- méthoxycarbonyltryptamine, celle-ci est réduite en l' indoline correspondante avec du triéthylsilane . L'oxydation de celui-ci au moyen de peroxyde d'hydrogène en présence de tungstate de sodium dihydraté forme le produit intermédiaire 1-hydroxy- N- méthoxycarbonyltryptamine. L'hydroxylation nucléophile régiosélective en position 5 réussit avec 85 % d'acide formique . Les étapes finales d'hydrolyse telles que la déprotection alcaline fournissent la sérotonine.
Un autre procédé de fabrication est basé sur une synthèse d'indole comme étape finale. Le 2,5-diméthoxybenzaldéhyde est soumis à la réaction de Knoevenagel avec du cyanoacétate et de l' acide cyanhydrique est ajouté à l' accepteur de Michael formé . Le composé succinonitrile est converti par hydrogénation et clivage d'éther en 1,4-diamino-2-(2,5-dihydroxyphényl)butane, qui est ensuite converti par oxydation en le produit final avec du ferricyanure . Cette dernière étape est susceptible d'avoir lieu via la quinone , qui se condense intramoléculairement en imine et s'aromatise en indole.
En dehors des voies mentionnées ci-dessus, la structure d'une tryptoline -1-one a été décrite, dont l'ouverture du cycle produit de la sérotonine. Il existe également la structure d'un composé bicyclique initialement aliphatique , qui est ensuite aromatisé en indole.
Biochimie et pharmacocinétique
enregistrement
Après administration orale, environ 75 % de la sérotonine est absorbée dans la circulation sanguine et ensuite excrétée dans l' urine après métabolisme . Des valeurs similaires sont trouvées pour l'absorption de la sérotonine provenant d'aliments tels que les bananes.
biosynthèse
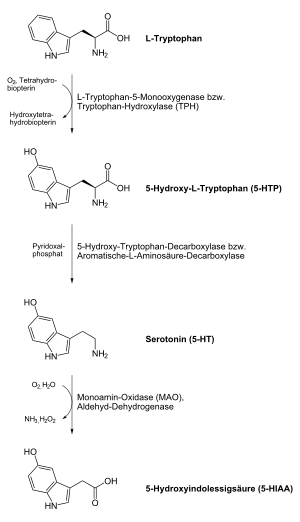
Chez l'homme et l'animal, la sérotonine est formée à partir de l' acide aminé L- tryptophane dans une réaction en deux étapes avec la participation des enzymes tryptophane hydroxylase et L- acide aminé décarboxylase aromatique . Dans la première étape, l'acide aminé non protéinogène 5-hydroxytryptophane (5-HTP) est produit comme intermédiaire . La deuxième étape est la décarboxylation du produit final sérotonine. Le lieu de production le plus important sont les cellules entérochromaffines de la muqueuse intestinale . De là, la sérotonine produite est transportée via les plaquettes sanguines. Cependant , il n' est pas possible de franchir la barrière hémato-encéphalique , de sorte que la sérotonine doit également être produite dans le système nerveux central . L'importance de la production neuronale de sérotonine est démontrée par la présence d'une deuxième tryptophane hydroxylase paralogue dans le cerveau, issue de la première isoforme par duplication de gènes avant même le développement des vertébrés .
La biosynthèse de la sérotonine chez les plantes diffère dans l'ordre de ses étapes de celle chez les animaux. Avec la participation de la tryptophane décarboxylase, le L- tryptophane est décarboxylé en un produit intermédiaire tryptamine dans la première étape . Dans la deuxième étape, l' hydroxylation a lieu à l'aide de la tryptamine-5-hydroxylase jusqu'au produit final sérotonine.
Démantèlement
Après sa libération dans la fente synaptique , la sérotonine des cellules nerveuses est activement réabsorbée et réutilisée à l'aide du transporteur de sérotonine (SERT), une protéine de transport . La sérotonine produite à partir des cellules entérochromaffines se fixe rapidement après sa libération via la même protéine de transport dans les cellules épithéliales de la muqueuse intestinale et dans les plaquettes . La dégradation de la sérotonine sera principalement l'enzyme monoamine oxydase (MAO) de type A et à un degré bien moindre que la MAO de type B. Le produit 5-hydroxy-indolyl-acétaldéhyde de l' aldéhyde déshydrogénase en outre l' acide 5-hydroxyindoleacétique (5- HIES) démonté. L'acide 5-hydroxyindolylacétique, qui peut être détecté dans l'urine, est le principal produit excréteur de la sérotonine.
Un autre conduit de la voie métabolique de la sérotonine au pinéale - hormone mélatonine , dans lequel , après une acétylation du groupe amino de la sérotonine avec la participation de la sérotonine N-acétyltransférase et l' acétyl coenzyme A , et après la méthylation à l'aide de acetylserotonin-O-méthyltransférase , et la S-Adenosylméthionine mélatonine est formée. Cette voie métabolique est régulée de manière décisive en contrôlant l' activité enzymatique de l'acétyltransférase à la lumière du jour.
Les fonctions

Dans l'organisme humain, la sérotonine a un large éventail d'effets, notamment sur le système cardiovasculaire, le tractus gastro-intestinal et le système nerveux. Au niveau moléculaire, les fonctions de la sérotonine sont médiées par au moins 14 récepteurs différents de la sérotonine ( récepteurs 5-HT), qui sont regroupés en 7 familles : 5-HT 1 à 5-HT 7 . Les récepteurs 5-HT 3 sont constitués de canaux ioniques , tous les autres récepteurs 5-HT connus sont des récepteurs couplés aux protéines G . Grâce à ce grand nombre de récepteurs de la sérotonine, qui sont également distribués en fonction du tissu, du type et de l'état cellulaire, l'organisme est capable de réagir à différentes concentrations de sérotonine et de démarrer diverses voies de transduction du signal . Celles-ci sont la cause principale des fonctions souvent contradictoires de la sérotonine dans l'organisme. De plus, la sérotonine est capable de contrôler les processus de transduction du signal de manière intracellulaire via une modification des protéines appelée sérotonylation .
Système cardiovasculaire
Les effets de la sérotonine sur le cœur et le système circulatoire sont complexes et comprennent à la fois la contraction ( contraction ) et la relaxation ( relaxation ) du muscle lisse des vaisseaux sanguins. Alors que dans les poumons et les reins humains , l'effet vasoconstricteur est au premier plan, dans les muscles squelettiques, l'effet vasodilatateur domine. Une injection de sérotonine dans le sang provoque un changement triphasique de la pression artérielle. Après une chute initiale de la pression artérielle, la pression artérielle augmente au bout de quelques secondes et se termine finalement par une hypotension de longue durée .
Les récepteurs 5-HT 1B , 5-HT 2A , 5-HT 2B et 5-HT 7 sont principalement responsables de ces effets . Selon le vaisseau sanguin, ils conduisent à une contraction directe (via 5-HT 1B , 5-HT 2A et 5-HT 2B ) ou à une relaxation des vaisseaux sanguins (via 5-HT 7 ). Alternativement, les vaisseaux sanguins peuvent être relâchés indirectement via l'implication de l' endothélium (via 5-HT 1B et 5-HT 2B ) et la libération de substances messagères qui dilatent les vaisseaux sanguins, telles que l'oxyde nitrique (NO).
En plus de ces effets directs sur les vaisseaux sanguins, la sérotonine est capable de contrôler la pression artérielle et le tonus des vaisseaux sanguins de manière complexe via le système nerveux central.
La coagulation du sang
La sérotonine a des effets directs et indirects sur la coagulation du sang . Les thrombocytes , également appelés plaquettes sanguines, dont l' agrégation est importante pour la coagulation du sang, servent non seulement à stocker et à libérer la sérotonine, mais portent également eux-mêmes les récepteurs de la sérotonine de type 5-HT 2A . Grâce à cela, la sérotonine entraîne une vidange des granules des plaquettes et renforce l'agrégation plaquettaire provoquée par d'autres substances messagères telles que l' adénosine diphosphate ou la thrombine et favorise ainsi la coagulation du sang. Dans les vaisseaux sanguins plus petits, il contribue également à la cicatrisation des plaies par vasoconstriction et donc par une diminution du flux sanguin .
Système digestif
La sérotonine a diverses fonctions motrices et sensorielles dans le tractus gastro-intestinal . D'une part, le système digestif réagit à la sérotonine, qui est libérée par les cellules entérochromaffines, d'autre part, la sérotonine fonctionne comme un neurotransmetteur dans le système nerveux intestinal. Les récepteurs de la sérotonine 5-HT 3 et 5-HT 4 sont particulièrement impliqués dans la médiation de l'effet de la sérotonine dans le tractus gastro-intestinal .
La sérotonine, qui est libérée dans la lamina propria de la muqueuse intestinale, active divers récepteurs de la sérotonine pour activer les neurones primaires du système nerveux intestinal. Ces neurones transmettent leurs stimuli d'une part par l' intermédiaire d' excitants moteur neurones avec le neurotransmetteur acetylcholine et d'autre part par l' intermédiaire de moteurs d' inhibition des neurones avec l'émetteur de l' oxyde nitrique . Sous l'interaction des deux motoneurones, la sérotonine entraîne une vague coordonnée descendante de contraction et de relaxation des muscles intestinaux, également connue sous le nom de péristaltisme .
Dans sa fonction sensorielle, la sérotonine libérée entraîne également des nausées et des vomissements sous forme de réflexe après une transmission de signal impliquant le nerf vague . Avec l'implication des nerfs spinaux , les plaintes et la douleur sont transmises du tractus gastro-intestinal au cerveau.
En tant que source de sérotonine dans le tractus gastro-intestinal, les cellules entérochromaffines sont de la plus haute importance. Ils répondent à l'augmentation de la pression intestinale en libérant de la sérotonine, qui stimule le péristaltisme. Les arômes peuvent également activer la libération de sérotonine par les cellules entérochromaffines et ainsi stimuler le mouvement de l'intestin, la motilité intestinale , le plomb. Un effet secondaire de nombreux médicaments cytostatiques utilisés en chimiothérapie anticancéreuse , les vomissements cytostatiques, peut s'expliquer par une libération massive de sérotonine par les cellules entérochromaffines.
œil
Dans l'œil humain, la sérotonine régule la pression intraoculaire en activant divers récepteurs de la sérotonine via des nerfs qui, entre autres, utilisent la sérotonine comme neurotransmetteur. Les mécanismes possibles sont le contrôle de la production d'humeur aqueuse dans l'œil et l'ouverture ou la fermeture de la pupille contractant le muscle Musculus sphincter pupillae . Un effet secondaire des inhibiteurs dits sélectifs de la recapture de la sérotonine (ISRS), la survenue accrue de glaucome , peut également s'expliquer par un effet de la sérotonine sur la pression intraoculaire.
Système nerveux central
La sérotonine, qui est localisée dans le système nerveux central dans les corps cellulaires, les voies nerveuses sérotoninergiques somatiques dans les noyaux du raphé , dont les axones rayonnent dans toutes les parties du cerveau, affecte directement ou indirectement presque toutes les fonctions cérébrales. Les fonctions les plus importantes de la sérotonine dans le cerveau, qui ne peuvent pas traverser la barrière hémato-encéphalique et doivent donc être formées sur place, comprennent le contrôle ou l'influence de la perception, le sommeil, la régulation de la température, la technologie des capteurs, la perception de la douleur et le traitement de la douleur, des Appétit, comportement sexuel et sécrétion d'hormones. La sérotonine agit d'une part comme un neurotransmetteur dans l' espace synaptique , d'autre part, elle est libérée de manière diffuse via les terminaisons nerveuses libres et agit comme un neuromodulateur.
humeur
L'un des effets les plus connus de la sérotonine sur le système nerveux central est ses effets sur l'humeur. Il nous procure un sentiment de sérénité, de paix intérieure et de contentement. Il supprime toute une gamme d'états émotionnels différents, en particulier les sentiments de peur, d'agressivité, de chagrin et la sensation de faim. D'un point de vue neurochimique, les humeurs dépressives peuvent souvent être attribuées à un déficit en sérotonine ou en son précurseur, l'acide aminé tryptophane . Un surdosage , par ex. B. Les inhibiteurs de la recapture de la sérotonine ou une combinaison incorrecte de plusieurs médicaments peuvent entraîner des troubles physiques graves, qui peuvent également être mortels, et des hallucinations ( syndrome sérotoninergique ).
En stimulant certaines régions du cortex cérébral responsables de la régulation émotionnelle, la sérotonine conduit essentiellement à une inhibition de l'impulsivité et des comportements agressifs . En particulier, les récepteurs de la sérotonine des types 5-HT 1A et 5-HT 1B ont un effet inhibiteur. À l'inverse, de faibles niveaux de sérotonine entraînent une augmentation de l'impulsivité et de l'agressivité. L' activation des récepteurs 5-HT 2A est responsable des effets euphorisants et hallucinogènes des agonistes de la sérotonine comme le LSD .
En plus de la dopamine , de l' ocytocine et des endorphines , la sérotonine est communément appelée "l'hormone du bonheur" en raison de ses effets sur l'humeur. La consommation d'aliments riches en tryptophane, comme le chocolat ou les bananes , entraîne d'une part un effet d'amélioration de l'humeur en raison du tryptophane qu'ils contiennent, car - contrairement à la sérotonine - il peut traverser la barrière hémato-encéphalique . De plus, les glucides ingérés provoquent également une augmentation de la production et de la libération de neurotransmetteurs (y compris la sérotonine) dans le cerveau, ce qui entraîne cet effet.
Rythme veille-sommeil
Un rôle possible de la sérotonine dans la régulation du rythme veille-sommeil est connu depuis les années 1950. Pendant longtemps, les découvertes sur la modulation du rythme veille-sommeil par la sérotonine étaient en partie contradictoires. Autant que nous le sachions aujourd'hui, la sérotonine favorise essentiellement l'état de veille. Les neurones contenant de la sérotonine des noyaux du raphé, qui sont connectés au noyau suprachiasmaticus (SCN) de l' hypothalamus , siège de l'horloge principale des mammifères, sont actifs pendant l'état de veille. En revanche, ils réduisent leur activité pendant le sommeil profond , et cessent pratiquement de le faire pendant le sommeil paradoxal . Dans le même temps, le noyau suprachiasmatique contrôle, entre autres, la production et la libération de l'hormone mélatonine par la glande pinéale, qui est impliquée dans la synchronisation du sommeil .
appétit
La sérotonine est un neurotransmetteur dont la libération dans le cerveau est indirectement liée à la nourriture. Un facteur est la concentration de tryptophane libre dans le plasma sanguin. Les aliments riches en glucides et en protéines entraînent une augmentation de l'absorption du tryptophane dans le cerveau via la libération d' insuline , qui est associée à une augmentation de la synthèse de la sérotonine.
La sérotonine est particulièrement associée à un effet coupe-faim. Les personnes en surpoids ont des niveaux réduits de tryptophane dans le plasma sanguin et des niveaux de sérotonine dans le cerveau. Les médicaments qui - comme les inhibiteurs sélectifs de la recapture de la sérotonine - augmentent la concentration de sérotonine dans le cerveau entraînent une perte d'appétit comme effet secondaire. Une activation sélective des récepteurs de la sérotonine du sous-type 5-HT 1A , qui contrôlent principalement la libération de sérotonine en tant qu'autorécepteurs , entraîne une augmentation de l'appétit en inhibant la libération de sérotonine par les terminaisons nerveuses. L'effet réducteur réel de l'appétit de la sérotonine est notamment dû aux récepteurs de la sérotonine 5-HT 1B ou 5-HT 2C .
la douleur
La sérotonine, qui est libérée par les cellules nerveuses lésées, par exemple, est un activateur direct d'un stimulus douloureux. L'effet de la sérotonine sur l'augmentation ou l'affaiblissement des stimuli douloureux via les neurones sérotoninergiques descendants de la corne dorsale de la moelle épinière est plus important .
Comportement sexuel
La sérotonine, qui est libérée dans l' hypothalamus au moment de l' éjaculation , a principalement un effet inhibiteur sur le comportement et les fonctions sexuels. La sérotonine agit comme un adversaire de la dopamine . Des médicaments tels que les inhibiteurs sélectifs de la recapture de la sérotonine , qui augmentent la concentration de sérotonine dans le cerveau, peuvent entraîner, en plus d'une diminution des pulsions sexuelles chez l'homme, notamment une restriction de la capacité d' érection ou une inhibition de l'éjaculation. Dans l'expérience avec des souris, la production de sérotonine perturbée conduit à un comportement sexuel bisexuel, qui peut être réduit à un comportement hétérosexuel grâce à l'utilisation de la sérotonine. Une étude de 2015 va cependant à l'encontre de ces données, car les souris présentant une production de sérotonine altérée et la présence simultanée d'animaux mâles et femelles dans l'expérience ont toujours préféré les femelles.
Régulation de la température
La sérotonine est impliquée dans la régulation de la température corporelle dans le système nerveux central. Selon la zone cérébrale concernée et les récepteurs impliqués, la sérotonine entraîne une augmentation ( hyperthermie ) ou une diminution de la température corporelle ( hypothermie ). L'effet hypothermique de la sérotonine est notamment associé à l'activation des récepteurs de la sérotonine du sous-type 5-HT 7 .
Physiopathologie
Tumeurs neuroendocrines
La sérotonine joue un rôle commun dans les tumeurs neuroendocrines , c'est-à-dire dans les tumeurs bénignes ou malignes présentant des caractéristiques des cellules nerveuses ( neurones ) et des glandes productrices d'hormones ( endocrines ) , un rôle central. Le carcinoïde , terme collectif désignant les tumeurs neuroendocrines du tractus gastro-intestinal, se caractérise par la surproduction d'hormones tissulaires, notamment de sérotonine. Contrairement à la plupart des autres tumeurs, les symptômes caractéristiques du carcinoïde ne sont pas dus à un déplacement de tissu sain, mais en particulier aux effets de l'augmentation du taux de sérotonine. Une diarrhée persistante et des crampes abdominales sont les premiers signes d'une augmentation liée aux carcinoïdes des taux de sérotonine dans le tractus gastro-intestinal. Avec une production accrue de sérotonine en dehors du tractus gastro-intestinal, par exemple après une métastase , des effets systémiques de la sérotonine tels que le syndrome de flush peuvent être observés. Si le taux de sérotonine augmente sur une plus longue période de temps en raison du carcinoïde, une fibrose , en particulier des valves tricuspide et pulmonaire du cœur, survient en raison de l' effet hypertrophique de la sérotonine .
Hypertension pulmonaire
Les perturbations du système sérotoninergique sont considérées comme une cause possible du développement de la rare hypertension artérielle pulmonaire . Les médicaments qui inhibent le transporteur de la sérotonine et augmentent la concentration de sérotonine libre peuvent favoriser le développement de l'hypertension pulmonaire. Un polymorphisme du gène du transporteur de la sérotonine et une mutation du récepteur de la sérotonine 5-HT 2B se sont avérés être d'autres causes possibles d'hypertension pulmonaire.
migraine
Avec d'autres neurotransmetteurs, la sérotonine joue un rôle central dans la physiopathologie des migraines . Des fluctuations caractéristiques du taux de sérotonine peuvent être observées avant une migraine et pendant une crise de migraine. Un faible niveau de sérotonine dans les zones cérébrales concernées est associé à la propagation de stimuli douloureux dits trigéminovasculaires en tant que cause des migraines.
dépression
En 1969, Alec Coppen , Izyaslav Lapin et Gregory Oxenkrug ont simultanément émis l' hypothèse qu'un manque de sérotonine était la cause de la dépression. Il est basé sur des observations antérieures que la concentration du produit de dégradation de la sérotonine acide 5-hydroxyindolylacétique dans le liquide cérébral est réduite chez les patients déprimés. Cependant, il n'y a pas de corrélation claire entre la concentration d'acide 5-hydroxyindolylacétique et la gravité de la dépression, puisque la concentration du métabolite n'est qu'une mesure indirecte de la concentration de sérotonine. Les observations après un déficit en sérotonine d'origine pharmacologique ou l'utilisation d'inhibiteurs de la recapture de la sérotonine soutiennent l'hypothèse de dépression sérotoninergique. Après l'observation que la capacité d'absorption de la sérotonine dans les plaquettes sanguines et dans le cerveau est réduite chez les patients déprimés, le transporteur de la sérotonine et un polymorphisme génétique de la région promotrice de son gène (5-HTTLPR) ont été suspectés comme facteur de vulnérabilité à la survenue de dépression. Les résultats des études scientifiques sur l'implication de la sérotonine étant en partie contradictoires, l'hypothèse sérotoninergique de la dépression n'est pas incontestée.
Comme en particulier la manière biochimique selon laquelle une augmentation du taux de sérotonine dans le cerveau est censée conduire à une amélioration des symptômes dépressifs reste incertaine, des hypothèses alternatives sont désormais également en cours de discussion.
pharmacologie
La sérotonine elle-même n'a aucune application thérapeutique. En revanche, les substances médicinales qui influencent la libération, l'effet, la recapture et la dégradation de la sérotonine sont utilisées de diverses manières pour le traitement et la prévention des maladies. En termes de quantité, le plus grand domaine d'application des substances médicinales ayant un effet sur le système sérotoninergique est la maladie mentale. D'autres substances psychotropes sans effet médicinal agissent également sur les récepteurs de la sérotonine. Certains aliments et compléments alimentaires ont également des effets sur le système sérotoninergique du cerveau.
Antidépresseurs
Dans le traitement de la dépression , les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) tels que la fluoxétine , la fluvoxamine , la paroxétine , la sertraline et le citalopram sont très importants. Ils sont des inhibiteurs du transporteur de la sérotonine et entraînent une augmentation de la concentration et un séjour prolongé de la sérotonine dans la fente synaptique . L'effet des antidépresseurs tricycliques plus anciens repose - au moins en partie - sur une inhibition du transporteur de la sérotonine. Les inhibiteurs de la MAO tels que la tranylcypromine et le moclobémide, qui sont également utilisés comme antidépresseurs , doivent leur efficacité à une inhibition de l'enzyme de dégradation de la sérotonine, la monoamine oxydase.
Neuroleptiques
Les propriétés cliniques de nombreux neuroleptiques atypiques, qui diffèrent des neuroleptiques classiques , s'expliquent par une inhibition supplémentaire des récepteurs de la sérotonine du sous-type 5-HT 2A ( hypothèse dopamine-sérotonine ) qui va au-delà de l' inhibition des récepteurs de la dopamine . Les neuroleptiques atypiques tels que la clozapine , l' olanzapine et la rispéridone ont un effet essentiellement amélioré sur les symptômes négatifs de la schizophrénie et une fréquence réduite des effets secondaires moteurs extrapyramidaux et de la dyskinésie tardive . Le rapport de l'affinité d'un neuroleptique pour les récepteurs 5-HT 2A à son affinité pour les récepteurs D 2 , également appelé indice de Meltzer , est utilisé dans ce contexte pour prédire les propriétés neuroleptiques atypiques.
L'utilisation de la réserpine , un médicament qui conduit à un soi-disant « épuisement » des neurotransmetteurs et donc, entre autres, à une concentration réduite de sérotonine dans le trou synaptique, est considérée comme une étape importante dans le développement de la psychiatrie moderne. Aujourd'hui, la réserpine n'a qu'une importance historique.
Hypnotiques (somnifères)
En raison des effets de la sérotonine sur le sommeil, les précurseurs de la sérotonine tryptophane et 5-hydroxytryptophane sont utilisés, entre autres, comme doux aides de sommeil . Ce sont des promédicaments qui, après avoir été absorbés dans l'organisme, peuvent traverser la barrière hémato-encéphalique et sont métabolisés en sérotonine dans le cerveau, entre autres. Les deux substances sont tombées en discrédit dans les années 1990 en raison d'une contamination par la neurotoxine tryptamine-4,5-dione et de l'apparition du syndrome éosinophilie-myalgie, parfois mortel .
Tranquillisants
La buspirone , un agoniste partiel du récepteur 5-HT 1A , est également utilisée comme médicament psychotrope utilisé pour traiter l' application du trouble d'anxiété généralisée . Dans son effet, la buspirone diffère des autres anxiolytiques ( anxiolytiques ), qui ne ciblent pas principalement le système sérotoninergique, mais plutôt les récepteurs du neurotransmetteur acide γ-aminobutyrique (GABA).
Coupe-faim
L'effet coupe-faim de la sérotonine a été exploité de diverses manières pour les coupe-faim . Beaucoup de ces médicaments, tels que la lorcaserine et la fenfluramine , présentent un effet stimulant direct sur le récepteur 5-HT 2C , qui est associé à un effet coupe-faim. Les effets secondaires graves des coupe-faim précédemment utilisés Aminorex et fenfluramine, qui incluent des anomalies des valves cardiaques et une hypertension pulmonaire , sont également associés à un effet sur le système sérotoninergique, en particulier l'activation des récepteurs 5-HT 2B .
Un autre mécanisme d'action de certains coupe-faim comme la sibutramine est l'augmentation de la concentration de sérotonine au niveau de ses récepteurs en inhibant le transporteur de la sérotonine.
Thérapeutique de la migraine
Dans le traitement des crises de migraine aiguës , en particulier les agonistes des récepteurs 5-HT 1B/1D du groupe des triptans tels que le sumatriptan sont utilisés. En prophylaxie de la migraine, en revanche, des antagonistes de la sérotonine tels que le méthysergide et le pizotifène ont été utilisés , au moins jusqu'à l'avancée triomphale des bêta-bloquants .
Médicaments antihypertenseurs (médicaments antihypertenseurs)
L' antagoniste 5-HT 2A kétansérine et l' agoniste 5-HT 1A urapidil sont utilisés comme agents antihypertenseurs pour le traitement de l'hypertension artérielle. Cependant, leur effet antihypertenseur ne s'explique pas principalement par une interaction avec les récepteurs de la sérotonine, mais plutôt par une interaction supplémentaire avec les récepteurs adrénergiques .
Anticoagulants
La 5-HT 2A antagoniste sarpogrelate est comme inhibiteurs de l' agrégation des plaquettes utilisées. En tant que tel, l'ingrédient actif est utilisé pour traiter les accidents vasculaires cérébraux, les crises cardiaques et d'autres troubles circulatoires. Son effet est attribué à un blocage des récepteurs 5-HT 2A à la surface des plaquettes et à une inhibition associée de l'augmentation de l'agrégation plaquettaire induite par la sérotonine.
Antiémétiques
Comme antiémétiques pour le traitement des nausées et des vomissements sont Setrone comme ondansétron , granisétron , tropisetron et palonosétron utilisé. Ils montrent leur plus grande efficacité dans le traitement des vomissements aigus après chimiothérapie des maladies tumorales avec des cytostatiques modérément ou fortement nauséabonds comme le cisplatine . La thérapie combinée du palonosétron avec le glucocorticoïde dexaméthasone est également prometteuse dans les vomissements retardés de médicaments cytostatiques. Ils sont également utilisés dans le traitement des nausées et vomissements postopératoires .
Les sétrons doivent leur efficacité à une inhibition de l'effet de la sérotonine , le 5-HT 3 récepteurs, qui se trouvent dans la densité particulièrement élevée à la fois dans le système nerveux intestinal et dans le centre du vomissement de la tige du cerveau . L'effet antinauséeux du métoclopramide repose également au moins en partie sur un effet antagoniste sur ces récepteurs. L' alosetron antagoniste des récepteurs 5-HT 3 est également utilisé dans le traitement du syndrome du côlon irritable .
Procinétique
L' effet stimulant du péristaltisme intestinal de la prokinétique est basé sur une stimulation analogue à la sérotonine des récepteurs 5-HT 4 . Les médicaments ayant un effet procinétique basé sur l'activation des récepteurs 5-HT 4 , tels que le cisapride et le métoclopramide, sont utilisés pour traiter divers troubles gastro-intestinaux, notamment les douleurs abdominales, la constipation, les flatulences et les vomissements. L' agoniste des récepteurs 5-HT 4 tegaserod a été approuvé aux États-Unis pour le traitement du syndrome du côlon irritable, mais a été retiré du marché après une courte période en raison de problèmes de sécurité.
L'utilisation thérapeutique d'arômes, qui stimulent les cellules entérochromaffines à libérer de la sérotonine, a été postulée comme une option pour le développement de nouveaux médicaments.
Entactogènes et empathogènes
Comme entactogènes ( adjectif entactogènes, « touchant l'intérieur », de grec en , « à l' intérieur », latin Tactus « touché ») et empathogens ( empátho , grec ancien ἐμπάθω , « à sympathiser », comparer l' empathie , les gènes de grec ancien γένεσις , Génesis , « Origine ») sont des substances psychoactives , sous l'influence desquelles ses propres émotions sont perçues plus intensément. Le terme entactogène a été introduit par le chimiste américain David E. Nichols dans les années 1980. A cette époque, ces substances étaient également utilisées dans la psychothérapie psycholytique controversée , car le patient devient plus conscient de son propre psychisme et ainsi l'accès à son subconscient est plus facile. Les deux termes sont utilisés comme synonymes. De nombreux entactogènes, tels que B. La 3,4-méthylènedioxyamphétamine (MDA), la 3,4-méthylènedioxy- N -méthylamphétamine ( MDMA ), la 3,4-méthylènedioxy- N -méthylcathinone (bk-MDMA, MDMC) agissent comme libérateurs (excrétion) de la monoamine endogène Neurotransmetteurs sérotonine et noradrénaline , qui conduisent à un niveau inhabituellement élevé de ces substances messagères dans le cerveau.
Psychédéliques et hallucinogènes
En tant que psychédélique (composé du grec ancien ψυχη psyche soul " et δῆλος Délos , manifeste, apparemment ') les substances psychotropes sont appelées de puissants agonistes des récepteurs de la sérotonine 5-HT 2A / 2C sont efficaces. Le terme est né en 1956 d'une correspondance entre le psychiatre Humphry Osmond et l'écrivain Aldous Huxley . Le Duden définit le psychédélique comme suit : « Changer la conscience ; évoquant un état d'esprit euphorique, proche de la transe ». Le package insert pour le psychédélique Delysid (LSD), qui est entré sur le marché en 1949, a indiqué la possibilité de l' utiliser comme un psycholytic et psychotomimetic . Indication d'extrait de texte : « (a) En psychothérapie analytique pour favoriser la relaxation mentale en libérant du matériel refoulé. (b) Des études expérimentales de la nature de la psychose: En prenant Delysid, le psychiatre lui - même est en mesure de comprendre de gain dans le monde des idées et les perceptions des patients psychiatriques « La. intoxication avec les états psychédéliques est appelé voyage , le terme générique clinique de psychédélisme est appelé hallucinogènes ; les applications médicales possibles sont discutées. Les psychédéliques incluent :
- tryptamines hallucinogènes : par ex. B. Psilocybine , Diméthyltryptamine (DMT), 5-MeO-DMT , AMT , 4-HO-DIPT etc.
- phényléthylamines hallucinogènes : par ex. B. Mescaline , 2C-B , 2C-I , 25I-NBOMe , DOB , DOM , TMA , Bromo-DragonFLY etc.
- ergolines hallucinogènes : ex. B. LSD , 1P-LSD , AL-LAD , ETH-LAD , LSH , Ergin (LSA) etc.
Les champignons contenant de la psilocybine contiennent de la psilocybine et de la psilocine
Diméthyltryptamine (DMT), un tryptamine naturel - alcaloïde
Cactus contenant de la mescaline ( peyotl )
DDN - Buvard
Preuve individuelle
- ↑ a b c Entrée sur la sérotonine. Dans : Römpp Online . Georg Thieme Verlag, consulté le 1er juin 2014.
- ↑ a b A. Chattopadhyay, R. Rukmini, S. Mukherjee : Photophysique d'un neurotransmetteur : Ionisation et propriétés spectroscopiques de la sérotonine . Dans : Biophys J . ruban 71 , 1996, p. 1952-1960 .
- ↑ a b c d e f Entrée sur la sérotonine dans la base de données ChemIDplus de la United States National Library of Medicine (NLM), consultée le 17 août 2021.
- ↑ a b c fiche technique Chlorhydrate de sérotonine de Sigma-Aldrich , consulté le 8 mai 2017 ( PDF ).
- ↑ C. Ludwig, A. Schmidt : Le comportement des gaz qui circulent avec le sang à travers le muscle irritable des mammifères . Dans : Travaux de l'Institut physiologique de Leipzig . 1868, p. 1-61 (en ligne ).
- ^ MM Rapport, AA Green, IH Page : vasoconstricteur sérique, sérotonine ; isolement et caractérisation . Dans : Journal de chimie biologique . ruban 176 , non. 3 , décembre 1948, p. 1243-1251 , PMID 18100415 (anglais).
- ↑ MM Rapport : Vasoconstricteur sérique (sérotonine) la présence de créatinine dans le complexe ; une proposition de structure du principe vasoconstricteur . Dans : Journal de chimie biologique . ruban 180 , non. 3 , octobre 1949, p. 961-969 , PMID 18139191 (anglais).
- ↑ a b K. E. Hamlin, FE Fischer: La synthèse de la 5-hydroxytryptamine . Dans : J. Am. Chimie Soc. ruban 73 , non. 10 , 1951, p. 5007-5008 , doi : 10.1021 / ja01154a551 .
- ↑ V. Erspamer, B. Asero : Identification de l'entéroamine, l'hormone spécifique du système cellulaire entérochromaffine, en tant que 5-hydroxytryptamine . Dans : Nature . ruban 169 , non. 4306 , mai 1952, p. 800-801 , PMID 14941051 (anglais).
- ↑ BM Twarog, IH Page : Teneur en sérotonine de certains tissus et urines de mammifères et méthode pour sa détermination . Dans : American Journal of Physiology . ruban 175 , non. 1 , octobre 1953, p. 157-161 , PMID 13114371 (anglais).
- ↑ JH Gaddum, ZP Picarelli : Deux types de récepteurs à la tryptamine . Dans : British Journal of Pharmacology and Chemotherapy . ruban 12 , non. 3 , septembre 1957, p. 323-328 , PMID 13460238 , PMC 1509685 (texte intégral gratuit) - (anglais).
- ↑ SJ Peroutka : Les récepteurs 5-hydroxytryptamine chez les vertébrés et les invertébrés : pourquoi y en a-t-il autant ? Dans : Neurochimie Internationale . ruban 25 , non. 6 , décembre 1994, p. 533-536 , PMID 7894329 (anglais).
- ↑ a b J. M. Feldman, EM Lee : Teneur en sérotonine des aliments : effet sur l'excrétion urinaire de l'acide 5-hydroxyindoleacétique . Dans : American Journal of Clinical Nutrition . ruban 42 , non. 4 , octobre 1985, p. 639-643 , PMID 2413754 (anglais).
- ↑ K. McGowan, A. Kane, N. Asarkof, J. Wicks, V. Guerina, J. Kellum, S. Baron, AR Gintzler, M. Donowitz : Entamoeba histolytica cause la sécrétion intestinale : rôle de la sérotonine . Dans : Sciences . ruban 221 , non. 4612 , août 1983, p. 762-764 , PMID 6308760 (anglais).
- ↑ a b K. Kang, S. Kang, K. Lee, M. Park, K. Retour: Enzymatic caractéristiques de la sérotonine enzymes biosynthétiques et la biosynthèse de la sérotonine dans les plantes . Dans : Signalisation et comportement des plantes . ruban 3 , non. 6 , juin 2008, p. 389-390 , PMID 19704574 , PMC 2634310 (texte intégral gratuit) - (anglais).
- ↑ B. Muszyńska, K. Sułkowska-Ziaja, H. Ekiert : Composés d'indole dans les fructifications de certaines espèces de Macromycètes sélectionnées et dans leurs mycéliums cultivés in vitro . Dans : Pharmacie . ruban 64 , non. 7 , juillet 2009, p. 479-480 , PMID 19694188 (anglais).
- ↑ T. Herraiz : Tétrahydro-bêta-carbolines, alcaloïdes neuroactifs potentiels, dans le chocolat et le cacao . Dans : Journal de chimie agricole et alimentaire . ruban 48 , non. 10 , octobre 2000, p. 4900-4904 , doi : 10.1021 / jf000508l , PMID 11052752 (anglais).
- ↑ P. Schröder, C. Abele, P. Gohr, U. Stuhlfauth-Roisch, W. Grosse : Dernières nouvelles sur l'enzymologie de la biosynthèse de la sérotonine dans les graines de noix . Dans : Avancées de la médecine expérimentale et de la biologie . ruban 467 , 1999, p. 637-644 , PMID 10721112 (anglais).
- ^ David B. Repke, M. Torres Constantino : Anadenanthera : plante visionnaire de l'Amérique du Sud antique . Haworth Herbal Press, New York 2006, ISBN 0-7890-2642-2 , La chimie du genre Anadenanthera, pp. 95-142 .
- ^ E. Tanaka, C. Tanaka, N. Mori, Y. Kuwahara, M. Tsuda: Les amides phénylpropanoïdes de la sérotonine s'accumulent dans le bambou malade du balai de sorcière . Dans : Phytochimie . ruban 64 , non. 5 , novembre 2003, p. 965-969 , PMID 14561512 .
- ↑ DL Chase, MR Koelle : Neurotransmetteurs aminés biogéniques chez C. elegans . Dans : WormBook . 2007, p. 1-15 , doi : 10.1895 / wormbook.1.132.1 , PMID 18050501 (anglais).
- ↑ SJ Peroutka, TA Howell : L'évolution moléculaire des récepteurs couplés aux protéines G : focus sur les récepteurs 5-hydroxytryptamine . Dans : Neuropharmacologie . ruban 33 , non. 3-4 , 1994, p. 319-324 , PMID 7984268 .
- ↑ a b c d e J. Chauveau, V. Fert, AM Morel, MA Delaage: Rapid et dosage immuno-enzymatique spécifique de la sérotonine . Dans : Clin. Chem. Band 37 , non. 7 , juillet 1991, p. 1178-1184 , PMID 1855288 .
- ↑ a b E. Flachaire, C. Beney, A. Berthier, J. Salandre, C. Quincy, B. Renaud: Détermination des valeurs de référence pour la concentration de sérotonine dans les plaquettes de nouveau - nés en bonne santé, les enfants, les adultes et les sujets âgés de HPLC avec détection électrochimique . Dans : Clin. Chem. Band 36 , non. 12 octobre 1990, p. 2117-2120 , PMID 2253357 .
- ↑ DY Kim, M. Camilleri: sérotoninergique: un médiateur de la connexion cerveau-intestin . Dans : Am. J. Gastroentérol. ruban 95 , non. 10 , octobre 2000, p. 2698-2709 , doi : 10.1111 / j.1572-0241.2000.03177.x , PMID 11051338 .
- ↑ EP Benditt, RL Wong, M. Arase, E. Roeper : 5-Hydroxytryptamine dans les mastocytes . Dans : Proc. Soc. Exp. Biol. Med. Band 90 , non. 1 , octobre 1955, p. 303-304 , PMID 13273431 .
- ↑ H. Tamir, TC Theoharides, MD Gershon, PW Askenase : Pools de stockage de sérotonine dans la leucémie basophile et les mastocytes : caractérisation de deux types de protéines de liaison à la sérotonine et analyse radioautographique de la distribution intracellulaire de la [3H] sérotonine . Dans : J. Cell Biol. Volume 93 , non. 3 , juin 1982, p. 638-647 , PMID 7118996 , PMC 2112151 (texte intégral gratuit).
- ↑ a b I. M. Modlin, M. Kidd, I. Latich, MN Zikusoka, MD Shapiro : État actuel des carcinoïdes gastro-intestinaux . Dans : Gastro - entérologie . ruban 128 , non. 6 , mai 2005, p. 1717-1751 , PMID 15887161 .
- ^ A. Ek, B. Witkop : La synthèse des métabolites labiles de l'hydroxytryptophane . Dans : J. Am. Chimie Soc. ruban 76 , non. 22 , 1954, p. 5579-5588 , doi : 10.1021 / ja01651a001 .
- ↑ R. Majiama, M. Kotake : Expériences de synthèse dans le groupe indole, VI. : Une nouvelle synthèse de -indolyl-alkylamines . Dans : Chem.Ber. ruban 58 , 1925, p. 2042-2046 , doi : 10.1002/cber.19250580917 .
- ↑ ME Speeter, RV Heinzelmann, DI Weisblatt: La synthèse du principe vasoconstricteur du sérum sanguin sérotonine créatinine sulfate . Dans : J. Am. Chimie Soc. ruban 73 , non. 11 , 1951, p. 5514-5515 , doi : 10.1021 / ja01155a580 .
- ↑ KH Matzke, GJ Meyer, A. Osterholz, G. Coates, G. Firnau : Synthèse de la 5-hydroxytryptamine marquée au 11 C pour la mesure de la fonction des cellules endothéliales pulmonaires . Dans : International Journal of Radiation Applications and Instrumentation. Partie A. Rayonnements appliqués et isotopes . ruban 42 , non. 4 , 1991, p. 401-404 , doi : 10.1016 / 0883-2889 (91) 90145-Q .
- ↑ WE Noland, RA Hovden: Une nouvelle synthèse de la sérotonine . Dans : J. Org. Chem. Band 24 , non. 6 , 1959, p. 894-895 , doi : 10.1021 / jo01088a632 .
- ↑ EHP Young: La synthèse de la 5-hydroxytryptamine (serotonine) et tryptamines connexes . Dans : J. Chem.Soc. 1958, p. 3493-3496 , doi : 10.1039 / JR9580003493 .
- ↑ ME Speeter, WC Anthony: L'ACTION DE oxalyle SUR INDOLES: UNE NOUVELLE APPROCHE tryptamine . Dans : J. Am. Chimie Soc. ruban 76 , non. 23 , 1954, p. 6208-6210 , doi : 10.1021 / ja01652a113 .
- ↑ M. Somei, F. Yamada, T. Kurauchi et al : La chimie des indoles. CIII. Des synthèses simples de sérotonine, N-méthylsérotonine, bufoténine, 5-méthoxy-N-méthyltryptamine, acide bufobutanoïque, N-(indol-3-yl) méthyl-5-méthoxy-N-méthyltryptamine et lespédamine basées sur la chimie du 1-hydroxyindole . Dans : Chem. Pharm. Bull. Volume 49 , non. 1 , janvier 2001, p. 87-96 , PMID 11201232 .
- ↑ John Harley-Mason, AH Jackson: Hydroxytryptamines. Partie I. Bufoténine, 6-hydroxybufoténine et sérotonine . Dans : J. Chem.Soc. 1954, p. 1165-1171 , doi : 10.1039 / JR9540001165 .
- ^ RA Abramovitch, D. Shapiro : Tryptamines, carbolines et composés apparentés. Partie II Une synthèse pratique de tryptamines et de -carbolines . Dans : J. Chem.Soc. 1956, p. 4589 , doi : 10.1039 / JR9560004589 .
- ↑ G. Revial, I. Jabin, S. Lim, M. Pfau : Aromatisation de 1,6,7,7a-Tetrahydro-2H-indol-2-ones par un nouveau procédé. Préparation de l'intermédiaire clé de méthyle 1-benzyl-5-méthoxy-1H-indole-3-acétate et des synthèses de sérotonine, mélatonine et bufoténine . Dans : J. Org. Chem. Band 67 , non. 7 , 2002, p. 2252-2256 , doi : 10.1021 / jo0110597 .
- ^ A. Feldstein, H. Hoagland, KK Wong, MR Oktem, H. Freeman : activité MAO en relation avec la dépression . Dans : Am J Psychiatry . ruban 120 , juin 1964, p. 1192-1194 , PMID 14154756 .
- ^ A. Helander, T. Wikström, C. Löwenmo, G. Jacobsson, O. Beck: Excrétion urinaire de l'acide 5-hydroxyindole-3-acétique et du 5-hydroxytryptophol après charge orale avec de la sérotonine . Dans : Life Sci. ruban 50 , non. 17 , 1992, p. 1207-1213 , PMID 1373788 .
- ↑ Découvrez EGGNOG 4.5.1: Une base de données de groupes orthologues et annotation fonctionnelle. Dans : lait de poule.embl.de. Consulté le 23 septembre 2018 .
- ↑ DC Klein: arylalkylamine N-acétyltransférase: "le Timezyme" . Dans : J. Biol. Chem. Volume 282 , non. 7 , février 2007, p. 4233-4237 , doi : 10.1074 / jbc.R600036200 , PMID 17164235 .
- ↑ MJ Millan, P. Marin, J. Bockaert, CM la Cour : Signalisation aux récepteurs de la sérotonine couplés aux protéines G : avancées récentes et orientations de recherche futures . Dans : Tendances des sciences pharmacologiques . ruban 29 , non. 9 , septembre 2008, p. 454-464 , doi : 10.1016 / j.tips.2008.06.007 , PMID 18676031 (anglais).
- ↑ Diego J. Walther, Jens-Uwe Peter, Sandra Winter, Markus Höltje, Nils Paulmann, Maik Grohmann, Jakob Vowinckel, Victor Alamo-Bethencourt, Claudia S. Wilhelm, Gudrun Ahnert-Hilger, Michael Bader : la sérotonylation des petites GTPases est un voie de transduction du signal qui déclenche la libération d'alpha-granule plaquettaire . Dans : Cellule . ruban 115 , non. 7 , décembre 2003, p. 851-862 , doi : 10.1016 / S0092-8674 (03) 01014-6 , PMID 14697203 (anglais).
- ^ PR Saxena, A. Lawang: Une comparaison des effets cardiovasculaires et musculaires lisses de la 5-hydroxytryptamine et de la 5-carboxamidotryptamine, un agoniste sélectif des récepteurs 5-HT1 . Dans : Archives Internationales de Pharmacodynamie et de Thérapie . ruban 277 , non. 2 , octobre 1985, p. 235-252 , PMID 2933009 (anglais).
- ↑ C. Ullmer, K. Schmuck, HO Kalkman, H. Lübbert : Expression des ARNm des récepteurs de la sérotonine dans les vaisseaux sanguins . Dans : Lettres FEBS . ruban 370 , non. 3 , août 1995, p. 215-221 , doi : 10.1016 / 0014-5793 (95) 00828-W , PMID 7656980 (anglais).
- ↑ SW Watts, ML Cohen: Vascular récepteurs 5-HT: pharmacologie et de la pathophysiologie de 5-HT 1B , 5-HT 1D , 5-HT 1F , 5-HT 2B et 5-HT 7 récepteurs . Dans : Neurotransmissions . ruban 15 , 1999, p. 3-15 (anglais).
- ^ AG Ramage, CM Villalón: 5-hydroxytryptamine et régulation cardiovasculaire . Dans : Tendances des sciences pharmacologiques . ruban 29 , non. 9 , septembre 2008, p. 472-481 , PMID 19086344 (anglais).
- ^ Josef T. Prchal, Marshall A. Lichtman, William A. Williams, Ernest Beutler, Kenneth Kaushansky , Thomas J. Kipps, Uri Seligsohn : hématologie Williams . McGraw-Hill, New York 2006, ISBN 0-07-143591-3 (anglais).
- ↑ MD Gershon : article de synthèse : récepteurs et transporteurs de la sérotonine - rôles dans la motilité gastro-intestinale normale et anormale . Dans : Aliments. Pharmacol. Là. 20 Suppl 7, novembre 2004, p. 3-14 , doi : 10.1111 / j.1365-2036.2004.02180.x , PMID 15521849 .
- ↑ a b M. M. Costedio, N. Hyman, GM Mawe: Serotonin et son rôle dans la fonction et dans les troubles du côlon gastro - intestinaux . Dans : Dis. Colon rectum . ruban 50 , non. 3 , mars 2007, p. 376-388 , doi : 10.1007 / s10350-006-0763-3 , PMID 17195902 .
- ↑ E. Bülbring, A. Crema : La libération de 5-hydroxytryptamine en relation avec la pression exercée sur la muqueuse intestinale . Dans : J. Physiol. (Londres.) . ruban 146 , non. 1 , avril 1959, p. 18-28 , PMID 13655213 , PMC 1356887 (texte intégral gratuit).
- ↑ MD Gershon : Article de synthèse : rôles joués par la 5-hydroxytryptamine dans la physiologie de l'intestin . Dans : Aliments. Pharmacol. Là. 13 Suppl 2, mai 1999, p. 15-30 , PMID 10429737 .
- ↑ a b T. Braun, P. Voland, L. Kunz, C. Prinz, M. Gratzl: cellules Enterochromaffin de l'intestin humain: capteurs pour les épices et odorants . Dans : Gastro - entérologie . ruban 132 , non. 5 , mai 2007, p. 1890-1901 , doi : 10.1053 / j.gastro.2007.02.036 , PMID 17484882 .
- ↑ M. Minami, T. Endo, M. Hirafuji et al. : Aspects pharmacologiques des vomissements induits par les médicaments anticancéreux en mettant l'accent sur la libération de sérotonine et l'activité du nerf vagal . Dans : Pharmacol Ther . ruban 99 , non. 2 , août 2003, p. 149-165 , PMID 12888110 .
- ^ A b C. Costagliola, F. Parmeggiani, F. Semeraro, A. Sebastiani : Inhibiteurs sélectifs de la recapture de la sérotonine : un examen de ses effets sur la pression intraoculaire . Dans : Curr Neuropharmacol . ruban 6 , non. 4 , décembre 2008, p. 293-310 , doi : 10.2174 / 157015908787386104 , PMID 19587851 , PMC 2701282 (texte intégral gratuit).
- ↑ NA Sharif : Agonistes des récepteurs de la sérotonine-2 en tant que nouveaux agents hypotenseurs oculaires et leurs mécanismes d'action cellulaire et moléculaire . Dans : Curr Drug Targets . ruban 11 , non. 8 , août 2010, p. 978-993 , PMID 20426763 .
- ↑ L. Descarries, MA Audet, G. Doucet, S. Garcia, S. Oleskevich, P. Séguéla, JJ Soghomonian, KC Watkins : Morphologie des neurones centraux à sérotonine. Brève revue des aspects quantifiés de leur distribution et des relations ultrastructurales . Dans : Annales de l'Académie des sciences de New York . ruban 600 , 1990, p. 81-92 , PMID 2252339 (anglais).
- ^ RJ Nelson, BC Trainor : Mécanismes neuronaux d'agression . Dans : Nature Reviews Neuroscience . ruban 8 , non. 7 , juillet 2007, p. 536-546 , doi : 10.1038 / nrn2174 , PMID 17585306 (Anglais, pdf ( Memento du 11 février 2014 dans Internet Archive )). Mécanismes neuronaux d'agression ( Memento de l' original daté du 11 février 2014 dans Internet Archive ) Info : Le lien d' archive a été inséré automatiquement et n'a pas encore été vérifié. Veuillez vérifier le lien d'origine et d'archive conformément aux instructions , puis supprimez cet avis.
- ↑ DE Nichols : Hallucinogènes . Dans : Pharmacologie & Thérapeutique . ruban 101 , non. 2 , février 2004, p. 131-181 , doi : 10.1016 / j.pharmthera.2003.11.002 , PMID 14761703 (anglais).
- ↑ M. Jouvet: Le sommeil et la sérotonine: une histoire inachevée . Dans : Neuropsychopharmacologie . ruban 21 , 2 Suppl, août 1999, pp. 24S-27S , doi : 10.1016 / S0893-133X (99) 00009-3 , PMID 10432485 (anglais).
- ↑ JM Monti : Le rôle des neurones sérotoninergiques et non sérotoninergiques du noyau du raphé dorsal, et de leurs récepteurs, dans la régulation de l'éveil et du sommeil paradoxal (REM) . Dans: sommeil Med Rev . ruban 14 , non. 5 , octobre 2010, p. 319-327 , doi : 10.1016 / j.smrv.2009.10.003 , PMID 20153670 .
- ↑ JM Monti, H. Jantos : Les rôles de la dopamine et de la sérotonine, et de leurs récepteurs, dans la régulation du sommeil et de l'éveil . Dans : Prog. Brain Res. Band 172 , 2008, p. 625-646 , doi : 10.1016 / S0079-6123 (08) 00929-1 , PMID 18772053 .
- ^ LP Morin : La sérotonine et la régulation de la rythmicité circadienne des mammifères . Dans : Anne. Med. Band 31 , non. 1 , février 1999, p. 12-33 , PMID 10219711 .
- ↑ DP Cardinali et al : Sérotonine et sommeil : aspects moléculaires, fonctionnels et cliniques . Ed. : JM Monti. Birkhäuser Basel, 2008, ISBN 3-7643-8560-X , Contrôle circadien par les récepteurs de la sérotonine et de la mélatonine : pertinence clinique.
- ↑ RJ Wurtman, JJ Wurtman : Sérotonine cérébrale, envie de glucides, obésité et dépression . Dans : Recherche sur l'obésité . 3 Suppl 4, novembre 1995, p. 477S-480S , PMID 8697046 (anglais).
- ^ SE Ohia, CA Opere : Obésité : épidémiologie, physiopathologie et prévention . Ed. : Harry G. Preuss, Debasis Bagchi. Taylor & Francis, Washington, DC 2007, ISBN 0-8493-3802-6 , Rôle des neurotransmetteurs dans la régulation de l'obésité, pp. 71-80 (anglais).
- ↑ EM Hull, JW Muschamp, S. Sato : Dopamine et sérotonine : influences sur le comportement sexuel masculin . Dans : Physiologie & Comportement . ruban 83 , non. 2 , novembre 2004, p. 291-307 , doi : 10.1016 / j.physbeh.2004.08.018 , PMID 15488546 (anglais).
- ↑ MD Waldinger, B. Olivier : Dysfonctionnement sexuel induit par les inhibiteurs sélectifs de la recapture de la sérotonine : considérations cliniques et de recherche . Dans : Psychopharmacologie clinique internationale . 13 Suppl 6, juillet 1998, p. S27-33 , PMID 9728672 (anglais).
- ↑ Yan Liu, Yun'ai Jiang et al : Régulation moléculaire de la préférence sexuelle révélée par des études génétiques de la 5-HT dans le cerveau de souris mâles. Dans : Nature. Volume 472, 2011, p. 95, doi : 10.1038 / nature09822 .
- ↑ Mariana Angoa-Pérez, Nieves Herrera-Mundo et al.: La signalisation cérébrale de la sérotonine ne détermine pas la préférence sexuelle chez les souris mâles. Dans : PLOS ONE. Tome 10, 2015, article e0118603, doi : 10.1371 / journal.pone.0118603 .
- ^ RD Myers : Sérotonine et thermorégulation : vues anciennes et nouvelles . Dans : Journal de Physiologie (Paris) . ruban 77 , non. 2-3 , 1981, p. 505-513 , PMID 6793718 (anglais).
- ↑ PB Hedlund, JG Sutcliffe : Avancées fonctionnelles, moléculaires et pharmacologiques dans la recherche sur les récepteurs 5-HT7 . Dans : Tendances des sciences pharmacologiques . ruban 25 , non. 9 , septembre 2004, p. 481-486 , PMID 15559250 (anglais).
- ↑ M. Druce, A. Rockall, AB Grossman : Fibrose et syndrome carcinoïde : de la causalité à la thérapie future . Dans : Nature Reviews Endocrinologie . ruban 5 , non. 5 , mai 2009, p. 276-283 , doi : 10.1038 / nrendo.2009.51 , PMID 19444261 .
- ^ MR Maclean, Y. Dempsie: L'hypothèse de la sérotonine de l'hypertension pulmonaire revisitée . Dans : Adv. Exp. Med. Biol. Band 661 , 2010, p. 309-322 , doi : 10.1007 / 978-1-60761-500-2_20 , PMID 20204739 .
- ↑ S. Eddahibi, N. Morrell, MP d'Ortho, R. Naeije, p Adnot : pathobiologie de l'hypertension artérielle pulmonaire . Dans : Eur. Respir. J. Bande 20 , non. 6 , décembre 2002, p. 1559-1572 , PMID 12503718 .
- ↑ JM Esteve, JM Launay, O. Kellermann, L. Maroteaux : Fonctions de la sérotonine dans le remodelage vasculaire pulmonaire hypoxique . Dans : Cell Biochem. Biophys. ruban 47 , non. 1 , 2007, p. 33-44 , PMID 17406058 .
- ↑ E. Hamel : Sérotonine et migraine : biologie et implications cliniques . Dans : Céphalalgie . ruban 27 , non. 11 novembre 2007, p. 1293-1300 , doi : 10.1111 / j.1468-2982.2007.01476.x , PMID 17970989 .
- ^ AJ Coppen : Aspects biochimiques de la dépression . Dans : Int Psychiatry Clin . ruban 6 , non. 2 , 1969, p. 53-81 , PMID 5817856 .
- ^ IP Lapin, GF Oxenkrug: Intensification des processus sérotoninergiques centraux en tant que déterminant possible de l'effet thymoleptique . Dans : Lancet . ruban 1 , non. 7586 , janvier 1969, p. 132-136 , PMID 4178247 .
- ↑ SJ Dencker, U. Malm, BE Roos, B. Werdinius: Métabolites acides monoamines du liquide céphalo-rachidien dans la dépression mentale et la manie . Dans : J. Neurochem. ruban 13 , non. 12 décembre 1966, p. 1545-1548 , PMID 5962034 .
- ↑ J. Mendels, A. Frazer, RG Fitzgerald, TA Ramsey, JW Stokes : métabolites d'amines biogènes dans le liquide céphalo-rachidien des patients déprimés et maniaques . Dans : Sciences . ruban 175 , non. 28 mars 1972, p. 1380-1382 , PMID 5059569 .
- ^ JJ Mann : Rôle du système sérotoninergique dans la pathogenèse de la dépression majeure et du comportement suicidaire . Dans : Neuropsychopharmacologie . ruban 21 , 2 Suppl, août 1999, pp. 99S – 105S , doi : 10.1016 / S0893-133X (99) 00040-8 , PMID 10432495 .
- ↑ B. Shopsin, E. Friedman, S. Gershon : inversion de la parachlorophénylalanine des effets de la tranylcypromine chez les patients déprimés . Dans : Arch. général . Psychiatrie . ruban 33 , non. 7 , juillet 1976, p. 811-819 , PMID 133650 .
- ^ JR Lacasse, J. Léo : Sérotonine et dépression : un décalage entre les publicités et la littérature scientifique . Dans : Bande PLoS Med. 2 , non. 12 décembre 2005, article e392 , doi : 10.1371 / journal.pmed.0020392 , PMID 16268734 , PMC 1277931 (texte intégral gratuit).
- ^ HY Meltzer : Études cliniques sur le mécanisme d'action de la clozapine : l'hypothèse dopamine-sérotonine de la schizophrénie . Dans : Psychopharmacologie . 99 Suppl, 1989, p. S18-27 , PMID 2682729 (anglais).
- ↑ G. Curzon : Comment agissent la réserpine et la chlorpromazine : l'impact des découvertes clés sur l'histoire de la psychopharmacologie . Dans : Trends Pharmacol. Sci. ruban 11 , non. 2 , février 1990, p. 61-63 , PMID 2180160 .
- ↑ EH Turner, JM Loftis, AD Blackwell : Sérotonine à la carte : supplémentation avec le précurseur de la sérotonine 5-hydroxytryptophane . Dans : Pharmacol. Là. ruban 109 , non. 3 , mars 2006, p. 325-338 , doi : 10.1016 / j.pharmthera.2005.06.004 , PMID 16023217 .
- ↑ HE Baies: Lorcaserin et adiposopathy: 5-HT2c agonisme comme traitement pour les « gras malades » et les maladies métaboliques . Dans : Expert Rev Cardiovasc Ther . ruban 7 , non. 11 , novembre 2009, p. 1429-1445 , doi : 10.1586 / erc.09.123 , PMID 19900026 .
- ↑ G. Curzon, EL Gibson, AO Oluyomi : La suppression de l'appétit par les médicaments couramment utilisés dépend des récepteurs 5-HT mais pas de la disponibilité de la 5-HT . Dans : Trends Pharmacol. Sci. ruban 18 , non. 1 , janvier 1997, p. 21-25 , PMID 9114726 .
- ^ PA van Zwieten, GJ Blauw, P. van Brummelen: profil pharmacologique des médicaments antihypertenseurs avec récepteur de la sérotonine et activité alpha-adrénergique . Dans : Drogues . 40 Suppl 4, 1990, p. 1-8 ; discussion 28-30 , PMID 1982649 (anglais).
- ↑ T. Nagatomo, M. Rashid, H. Abul Muntasir, T. Komiyama : Fonctions du récepteur 5-HT2A et de ses antagonistes dans le système cardiovasculaire . Dans : Pharmacologie & Thérapeutique . ruban 104 , non. 1 , octobre 2004, p. 59-81 , doi : 10.1016 / j.pharmthera.2004.08.005 , PMID 15500909 (anglais).
- ^ A. Billio, E. Morello, MJ Clarke: Antagonistes des récepteurs de la sérotonine pour la chimiothérapie hautement émétisante chez l'adulte . Dans : Cochrane Database Syst Rév . Non. 1 , 2010, p. CD006272 , doi : 10.1002 / 14651858.CD006272.pub2 , PMID 20091591 .
- ↑ CC Apfel, P. Kranke, S. Piper et al. : Nausées et vomissements en phase postopératoire. Recommandations d'experts et fondées sur des preuves sur la prophylaxie et le traitement . Dans : Anesthésiste . ruban 56 , non. 11 novembre 2007, p. 1170-1180 , doi : 10.1007/s00101-007-1210-0 , PMID 17726590 .
- ↑ A. Rex, B. Bert, H. Fink : Pharmacologie des antagonistes 5-HT 3 . Dans : Pharm notre temps . ruban 36 , non. 5 , 2007, p. 342-353 , doi : 10.1002 / pauz.200700230 , PMID 17722161 .
- ↑ EA Mayer, S. Bradesi: alosetron et le syndrome du côlon irritable . Dans : Expert Opin Pharmacother . ruban 4 , non. 11 , novembre 2003, p. 2089-2098 , doi : 10.1517 / 14656566.4.11.2089 , PMID 14596662 .
- ^ DE Nichols: Différences entre le mécanisme d'action de Mdma, Mbdb et les hallucinogènes classiques. Identification d'une nouvelle classe thérapeutique : les entactogènes. Dans : Journal des drogues psychoactives. Volume 18, n° 4, 1986, pp. 305-313 (anglais ; en ligne sur scribd.com ; doi : 10.1080 / 02791072.1986.10472362 ).
- ^ RB Rothman, MH Baumann : Actions thérapeutiques et défavorables des substrats de transporteur de sérotonine. Dans : Pharm.Ther. Volume 95, 2002, p. 73-88. PMID 12163129 .
- ↑ DE Nichols: hallucinogènes. Dans : Pharmacologie & thérapeutique. Volume 101, numéro 2, février 2004, pp. 131-181, doi: 10.1016 / j.pharmthera.2003.11.002 . PMID 14761703 (Révision).
- ↑ Thomas S. Ray, Olivier Jacques Manzoni : psychédéliques et réceptorome humain. Dans : PLoS ONE. Tome 5, 2010, page E9019, doi : 10.1371 / journal.pone.0009019 .
- ^ A. Huxley, C. Palmer, M. Horowitz : Moksha : Écritures sur les psychédéliques et l'expérience visionnaire (1931-1963). Stonehill, New York 1977, ISBN 0-88373-042-1 , page 107. (À DR. HUMPHRY OSMOND [smith 744]) archive.org
- ↑ Page d'accueil : Duden - psychédélique, plus rarement psychédélique - orthographe, sens, définition, origine. Dans : duden.de. Consulté le 28 février 2016 .
- ↑ Albert Hofmann : LSD - mon enfant à problèmes. La découverte du médicament miracle. Stuttgart 1993, page 55.
- ↑ CS Grob, AL Danforth, GS Chopra, M. Hagerty, CR McKay, AL Halberstadt, GR Greer : étude pilote sur le traitement à la psilocybine de l'anxiété chez les patients atteints d'un cancer à un stade avancé. In : Archives de psychiatrie générale. Volume 68, numéro 1, janvier 2011, pp. 71-78, doi : 10.1001 / archgenpsychiatry.2010.116 . PMID 20819978 .
- ↑ KW Tupper, E. Wood, R. Yensen, MW Johnson : Médecine psychédélique : un paradigme thérapeutique ré-émergent. Dans : JAMC : Journal de l'Association médicale canadienne = journal de l'Association médicale canadienne. Volume 187, numéro 14, octobre 2015, pp. 1054-1059, doi : 10.1503 / cmaj.141124 . PMID 26350908 , PMC 4592297 (texte intégral gratuit) (Examen)
- ^ Avancées thérapeutiques en psychopharmacologie. Volume 4, numéro 4, août 2014, pp. 156-169, doi: 10.1177 / 2045125314527985 . PMID 25083275 , PMC 4104707 (texte intégral gratuit) (révision).
Littérature
- Julie G. Hensler : Neurochimie de base : aspects moléculaires, cellulaires et médicaux . Eds. : George J. Siegel, R. Wayne Albers, Brady Scott, Donald D. Price. Elsevier Academic, Amsterdam 2006, ISBN 0-12-088397-X , Serotonin, pp. 227-248 .
- Elaine Sanders-Bush, Steven E. Mayer : Goodman & Gilman's La base pharmacologique de la thérapeutique . Rédacteurs : Joel G. Hardman, Lee E. Limbird, Alfred Goodman Gilman. 10e édition. McGraw-Hill, 2001, ISBN 0-07-135469-7 , 5-Hydroxytryptamine (sérotonine): Agonistes et antagonistes des récepteurs, p. 269-290 .
- Paul M. Vanhoutte, PR Saxena, Rodolfo Paoletti, Nicoletta Brunello : Sérotonine : de la biologie cellulaire à la pharmacologie et à la thérapeutique . Kluwer Academic Publishers, Boston 1993, ISBN 0-7923-2518-4 .
liens web
- Birgit Hertwig : Sérotonine. Dans : Édition Laborjournal du 12 décembre 2009, consulté le 18 septembre 2018 .
- La biochimie de la peur . Dans : taz - le quotidien du 23 mai 2008. Article informatif sur la nouvelle étude, consulté le 25 mars 2012.