Affaires réglementaires
Une approbation de médicament est une approbation délivrée officiellement qui est requise pour pouvoir offrir, vendre ou délivrer un médicament prêt à l'emploi fabriqué industriellement . L'approbation d'un médicament n'est jamais accordée que pour une indication spécifique (c'est-à-dire un domaine d'application). L'utilisation d'un médicament approuvé en dehors de l'indication approuvée est appelée utilisation hors AMM .
Objet de la procédure
Le but d'une procédure d'autorisation pour les substances et préparations en tant que produits pharmaceutiques est la prévention des risques et la défense contre les risques pour la santé qui pourraient découler de produits pharmaceutiques dangereux ou inefficaces. Dans le cadre du processus d'approbation , les documents déposés par l' entreprise pharmaceutique sur la qualité pharmaceutique, l'efficacité thérapeutique et la sécurité du médicament sont donc contrôlés par les autorités du médicament ; les informations contenues dans les documents sont vérifiées par des inspections sur place.
Effets de l'approbation
L'agrément délivré atteste que le médicament est commercialisable et susceptible d'être mis sur le marché, c'est-à-dire qu'il peut être proposé en pharmacie par exemple. Pour les médecins, l'approbation est la preuve que le médicament a été testé pour un rapport bénéfice/risque positif dans l'indication indiquée . Cependant, l'approbation accordée a également d'autres effets.
En règle générale, l'approbation du médicament est une condition préalable à la capacité d'approvisionnement en droit social. Dans de nombreux pays, il existe également d'autres procédures d'approbation de droit social qui sont indépendantes de l'approbation des médicaments et représentent une condition préalable supplémentaire au remboursement des frais de médicaments par les caisses d'assurance-maladie . Ces réglementations diffèrent d'un pays à l'autre, elles incluent souvent des fixations de prix contraignantes et peuvent retarder l'accès au marché de plusieurs mois.
De plus, dans certains pays, il existe des réglementations spéciales en matière de responsabilité pour les médicaments approuvés. En Allemagne, il existe une responsabilité stricte spéciale sur la base du § 84 AMG, selon laquelle la société pharmaceutique doit payer des dommages-intérêts en cas de dommages causés par des médicaments qui ont été utilisés comme prévu. Cela s'applique à la fois aux erreurs de fabrication et de développement. Contrairement à la responsabilité en vertu du Code civil allemand , la partie lésée n'a pas à prouver le lien de causalité entre la demande et les dommages subis. Cette responsabilité ne s'applique pas à l'utilisation non conforme . Contrairement à l'Allemagne, l'Autriche n'a introduit aucune responsabilité stricte spéciale dans sa loi sur les médicaments.
Un agrément valable est également nécessaire dans l'UE pour la délivrance d'un certificat complémentaire de protection conformément au règlement (CEE) n° 469/2009 (remplace n° 1768/92). Un tel certificat peut prolonger la durée d'un brevet sur le médicament jusqu'à 5 ans.
Obligation de passer par la procédure d'admission
Dans les différents systèmes juridiques, il existe des dispositions différentes selon lesquelles les médicaments sont soumis à l'obligation de la procédure d'autorisation. Dans l'Union européenne, en vertu de l'article 2 de la directive 2001/83/CE , le droit pharmaceutique européen applicable à ces médicaments dans les États membres mis sur le marché doit être et sont soit préparés industriellement, soit un procédé industriel est utilisé pour leur préparation en vue de leur application . La loi pharmaceutique allemande détermine l'exigence d'autorisation pour les produits pharmaceutiques finis , la loi autrichienne utilise le terme spécialité médicinale de manière analogue. Il faut entendre par là des médicaments préalablement fabriqués et présentés sous le même nom dans un emballage destiné à être distribué au consommateur ou à l'utilisateur. En Suisse, l'exigence d'autorisation s'applique aux médicaments prêts à l'emploi.
En général, cela repose sur une conception globale des médicaments , qui comprend également les vaccins , de nombreux produits sanguins et les diagnostics in vivo , par exemple . Cependant, il y a des problèmes avec la délimitation des produits dans des cas individuels .
Les médicaments soumis à autorisation constituent la majorité des médicaments utilisés aujourd'hui. Cependant, il existe un certain nombre d'exceptions qui ne relèvent toujours pas de l'exigence d'autorisation. Dans l'Union européenne, les médicaments homéopathiques et les médicaments traditionnels à base de plantes peuvent être mis sur le marché selon une procédure d'approbation simplifiée (appelée « enregistrement » en Allemagne), à condition qu'ils répondent aux exigences réglementaires pertinentes. Dans cette procédure simplifiée, seules la qualité et la sécurité doivent être prouvées ; Dans le cas des médicaments homéopathiques enregistrés, aucune indication ne peut être donnée ; dans le cas des médicaments à base de plantes d'usage traditionnel, il doit être fait référence à l'usage traditionnel dans la formulation de l'indication. De même, la Suisse prévoit une procédure d'agrément simplifiée pour les médecines complémentaires. Les médicaments de prescription et de défense fabriqués en pharmacie ainsi que les médicaments expérimentaux pour les études cliniques ne sont pas soumis à autorisation . Sous certaines conditions, des médicaments qui n'ont pas (encore) été approuvés peuvent être mis à la disposition des patients dans le cadre d'un usage compassionnel .
harmonisation
Depuis 1990, dans le cadre de l' International Council for Harmonization (ICH), les directives de tests de médicaments essentiels pour la vérification de la qualité, de la sécurité et de l'efficacité ainsi que les formats des documents d'approbation ont été harmonisés. L'ICH est soutenu par les autorités et les représentants de l'industrie d'Europe, des États-Unis et du Japon. L'objectif de l'harmonisation était que les études non cliniques et cliniques d'une région soient reconnues dans les autres régions, afin qu'elles n'aient pas à être réalisées plus d'une fois. Cependant, les différentes autorités sont indépendantes dans leur évaluation des demandes d'approbation, il arrive donc souvent que certains médicaments ne soient pas approuvés dans toutes les régions.
Critères d'admission
Le critère d'approbation le plus important est la pondération du rapport bénéfice/risque ; L'autorisation n'est justifiée que si les bénéfices du médicament l'emportent sur les risques. Si le rapport bénéfice-risque du médicament devient défavorable après l'approbation, le médicament doit être retiré du marché. Une autorisation de mise sur le marché n'est jamais accordée que pour un domaine d'application précis, une indication précise . L'utilisation d'un médicament approuvé en dehors de l'indication approuvée est appelée utilisation hors AMM .
Examen des documents d'approbation
L'objectif principal du processus d'approbation est l'examen des documents soumis par la société pharmaceutique, qui doivent prouver la qualité, l'efficacité et l'innocuité. L'autorité du médicament vérifie également s'il a été prouvé au cours des différentes phases de l'étude du médicament que la production, le contrôle de la qualité, les tests non cliniques et les tests cliniques (phase III) ont été effectués conformément aux directives de test de drogue prescrites et aux recommandations recommandées. directives internationales et qu'elles correspondent à l' état de l' art . Cependant, l'Autorité du médicament ne se limite pas à examiner les documents soumis par le demandeur, mais utilise plutôt des inspections sur place pour vérifier si les études ont été réalisées conformément aux règles de bonnes pratiques de travail (GxP).
Documents d'approbation requis
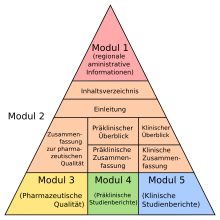
Avec la demande d'approbation, l'entreprise pharmaceutique doit soumettre un dossier complet sur le médicament dans un format défini, le Common Technical Document Format (CTD). Le dossier CTD contient tous les résultats pour la fabrication, la recherche et le développement du médicament en question en cinq modules . En détail, le dossier dans le module CTD 1 contient des informations spécifiques à la région et dans le module CTD 2 un aperçu et des résumés des modules suivants. Le module CTD 3 contient une partie qualité qui décrit comment le médicament peut être fabriqué dans une qualité pharmaceutique suffisante et comment cela est analysé et vérifié, le module CTD 4 les études pharmacologiques et toxicologiques non cliniques prescrites ; Le module CTD 5 comprend toutes les données des études cliniques .
Le format CTD a été développé dans l'ICH. Lors de l'introduction du CTD, l'objectif était de permettre le dépôt de dossiers largement identiques dans différentes régions. Le format est désormais obligatoire en Europe, en Amérique du Nord et au Japon. De nombreux candidats soumettent désormais leurs dossiers par voie électronique sous la forme d'un eCTD .
Afin de démontrer en permanence l'innocuité des médicaments, les sociétés pharmaceutiques doivent satisfaire à de nombreuses exigences légales, notamment : Une personne compétente doit être nommée, il doit y avoir un plan de gestion des risques et la disponibilité des agents responsables doit être assurée à tout moment.
Qualité pharmaceutique
La qualité pharmaceutique d'un médicament est la composition du médicament selon le type et la quantité de ses composants. La loi allemande sur les médicaments définit la qualité comme la nature d'un médicament, qui est déterminée par son identité, son contenu, sa pureté, d'autres propriétés chimiques, physiques, biologiques ou par le procédé de fabrication.
Pour l'approbation, il est nécessaire que le médicament soit d'une qualité appropriée conformément aux règles pharmaceutiques reconnues. Ces règles sont fixées , entre autres, dans les monographies de la pharmacopée . Les documents à fournir ne se limitent pas à la composition du médicament. L'ensemble du processus de fabrication et les contrôles des matières premières, des matériaux d'emballage, des produits intermédiaires et des produits finis ainsi que les études de durée de conservation réalisées doivent être documentés en détail.
Avant qu'un médicament soit approuvé, le fabricant doit obtenir une licence de fabrication. La production doit se dérouler selon les règles des Bonnes Pratiques de Fabrication ; celui-ci est inspecté par les autorités sur place. Si nécessaire, des échantillons du médicament peuvent être testés pour la qualité pharmaceutique dans les centres officiels de dépistage des drogues .
En américain, le terme chimie, fabrication et contrôles (CMC) est courant.
efficacité
L'efficacité d'un médicament est la somme des effets souhaités dans le domaine d'application prévu. Les effets souhaités peuvent être un traitement, une amélioration ou une prévention de la maladie. Une efficacité appropriée du médicament dans l'indication prévue est requise pour l'approbation. Cela ne doit pas être compris comme une garantie de succès pour chaque patient, mais comme une probabilité que des résultats thérapeutiques ou préventifs puissent être obtenus avec le médicament. Il existe plusieurs méthodes acceptables pour déterminer l'efficacité, qui diffèrent par leur niveau de preuve . Si possible, des essais contrôlés randomisés sur des critères cliniques tels que la morbidité, l'hospitalisation et la mortalité doivent être réalisés. Cependant, il existe des raisons reconnues par les autorités de délivrance des licences pour le fait que l'efficacité de la conception de l'étude et/ou des paramètres enregistrés n'est rendue probable qu'avec peu de preuves, par exemple à travers des comparaisons épidémiologiques ou l'enregistrement de marqueurs de substitution . Selon une décision de la Cour administrative fédérale allemande, le terme efficacité thérapeutique signifie la « causalité de l'utilisation du médicament pour le succès de la guérison. » Les études doivent avoir été effectués selon les règles de bonnes pratiques cliniques ; les autorités vérifient cela par des inspections sur place.
Un des problèmes de la preuve d'efficacité est qu'elle est souvent réalisée dans des études sur des groupes de patients qui ne correspondent pas aux patients en pratique clinique courante, par exemple en termes d'âge, de répartition par sexe et de gravité de la maladie. La question de la pertinence quotidienne de la preuve d'effectivité se pose donc au cas par cas.
Innocuité
Sous l'aspect de l'innocuité, la nocivité potentielle d'un médicament est principalement évaluée. Le terme d'innocuité est utilisé depuis longtemps dans le droit pharmaceutique allemand ; Au niveau international, on parle surtout de sécurité. Selon la loi allemande sur les médicaments , les médicaments sont discutables si, selon l'état actuel des connaissances scientifiques, il existe un soupçon justifié que, lorsqu'ils sont utilisés comme prévu, ils ont des effets nocifs qui vont au-delà de ce qui est justifiable selon les connaissances médicales. science.
Il n'y a pas de mesure absolue des effets secondaires acceptables ; la préoccupation ne doit être évaluée qu'en fonction de la gravité de la maladie à traiter. Lors de l'évaluation de l'innocuité d'un médicament, son efficacité doit également être prise en compte. Innocuité ne veut pas dire innocuité. Du pharmacologue Gustav Kuschinsky vient le dicton que les médicaments qui prétendent n'avoir aucun effet secondaire sont soupçonnés de ne pas avoir d'effet principal.
L'innocuité du médicament doit être démontrée dans des études non cliniques et cliniques . L'essai non clinique contient une détermination complète de la toxicité qui doit être effectuée dans le cadre d'expérimentations in vitro et animales appropriées . Dans les essais cliniques , tous les effets secondaires et événements indésirables graves chez les participants sont soigneusement documentés et évalués.
Le problème est que les effets secondaires dans les études cliniques ne peuvent être documentés que chez un nombre relativement restreint de patients ; En principe, les effets secondaires rares et très rares ne peuvent pas être identifiés. Il en va de même pour les effets à long terme en raison de la durée limitée des études. Cela signifie qu'au moment de l'admission, il ne peut s'agir que d'une évaluation préliminaire. Un profil d'innocuité complet ne peut être obtenu qu'avec une utilisation généralisée et une surveillance minutieuse de l'application par pharmacovigilance .
Rapport risque-bénéfice
Le rapport bénéfice-risque d'un médicament est le rapport entre l'efficacité du traitement d'une part et tous les risques possibles liés à la qualité, la sécurité ou l'efficacité du médicament d'autre part. Ce ratio est d'une importance capitale pour la décision d'approbation du médicament. Le terme rapport bénéfice-risque va plus loin que le terme « innocuité », puisqu'il faut tenir compte non seulement des risques pour le patient mais aussi pour la santé publique et l'environnement.
Il n'y a pas de norme généralement acceptée pour cette relation ; cela nécessite toujours une décision individuelle. Comme pour la sécurité, l'appréciation du rapport bénéfice/risque au moment de l'agrément ne peut être que provisoire. Le manque de généralisation du rapport bénéfice-risque dérivé des études d'approbation a été démontré par exemple pour les anti-inflammatoires non stéroïdiens .
Pour cette raison, le rapport bénéfice/risque doit être contrôlé en permanence en pharmacovigilance après approbation ; si la relation devient défavorable, le remède doit être retiré du marché. Bien que le concept de rapport bénéfice-risque soit utilisé dans l'évaluation des médicaments depuis de nombreuses années, il n'a été introduit dans divers articles des directives et règlements communautaires qu'en 2004 avec la réforme de la législation pharmaceutique de l'UE.
La preuve d'une efficacité supérieure aux risques est suffisante pour l'approbation en vertu de la loi sur les médicaments ; la supériorité par rapport aux autres médicaments n'est pas requise. Plus récemment, d'autres procédures d'évaluation pour l'évaluation des avantages ou des coûts-avantages des médicaments ont été introduites dans de nombreux pays, par exemple en Allemagne par l' Institute for Quality and Efficiency in Health Care (IQWiG) ou au Royaume-Uni par le National Institute pour la Santé et l'Excellence Clinique (NICE) . Ces procédures d'évaluation ne font pas partie de l'approbation du médicament. Ils servent à évaluer le remboursement des médicaments par les caisses d'assurance-maladie .
Résumé des Caractéristiques du Produit

Au cours du processus d'approbation, les informations essentielles sur le médicament, qui ont été justifiées par les résultats de l'étude et convenues dans le libellé entre le demandeur et l'autorité d'approbation, sont résumées dans le résumé des caractéristiques du produit . Ce document important contient toutes les informations essentielles telles que l'indication, la contre - indication , la posologie , les interactions et les effets secondaires y compris l'évaluation et la pesée. Même après approbation, ce résumé ne peut être modifié qu'avec l'approbation de l'autorité.
Processus d'admission
Les procédures d'approbation sont régies par les réglementations nationales et les accords internationaux. En outre, le contexte médical sur lequel se fonde l' approbation est continuellement développé grâce à l'évolution de la médecine consensuelle à la médecine factuelle .
Union européenne
Au cours de la mise en œuvre du marché intérieur européen , des procédures normalisées d'approbation de l'UE ont été introduites en 1995, de sorte que les différents obstacles bureaucratiques n'ont plus à être surmontés dans chaque pays de l'UE. A cet effet, le cadre juridique avec la directive 2001/83/CE pour la création d'un code communautaire des médicaments à usage humain et la directive 2001/82/CE pour la création d'un code communautaire des médicaments vétérinaires (à remplacer par le règlement ( EU) 2019/6 sur les médicaments vétérinaires à partir de 2022 ) dans la version actuelle harmonisée dans toute l'UE. Diverses procédures d'approbation de l'UE ont été élaborées, dont certaines reposent sur la coordination d'institutions décentralisées et d'autres sur la centralisation. Dans tous les cas, les autorités nationales ont encore un rôle clé à jouer.
Procédure centralisée
La procédure principale pour les médicaments innovants est la procédure centralisée basée sur le règlement (CE) n° 726/2004 . Cette procédure est obligatoire pour un certain nombre de médicaments. Ceux-ci comprennent des médicaments pour les thérapies avancées et les anticorps monoclonaux, ainsi que des médicaments humains contenant de nouveaux ingrédients actifs pour le traitement du sida , du diabète sucré , du cancer , des maladies neurodégénératives , des maladies auto-immunes et d'autres immunodéficiences et maladies virales . De même, les médicaments orphelins pour traiter les maladies rares et les médicaments vétérinaires pour améliorer les performances relèvent nécessairement de la procédure. L'accès à cette procédure est facultatif pour un certain nombre d'autres médicaments.
Dans la procédure centralisée, l'évaluation scientifique et la décision d'approbation sont institutionnellement séparées. La demande d'approbation doit être soumise à l' Agence européenne des médicaments (EMA). La procédure d'évaluation de la demande d'autorisation est effectuée par les comités scientifiques - dans le cas des médicaments à usage humain , le comité des médicaments à usage humain - de l'Agence européenne des médicaments ; Des représentants de haut rang des autorités pharmaceutiques nationales sont envoyés à ces comités par les États membres. Un rapporteur choisi parmi le comité scientifique responsable de l'Agence et un co-rapporteur, ainsi que des experts des autorités pharmaceutiques nationales, préparent un rapport d'évaluation du médicament, qui est adopté par le comité scientifique responsable de l'Agence européenne des médicaments dans les 210 jours au plus tard. Sur la base de ce rapport, la Commission européenne, après consultation des États membres au sein du Comité permanent, accorde l' approbation pour l'ensemble de l'Union européenne dans un délai de 67 jours . Les institutions nationales et européennes travaillent donc en étroite collaboration dans le cadre de la procédure centralisée. L'approbation accordée par l'UE est régulièrement adoptée dans l' Espace économique européen (EEE).
Le consommateur peut voir si un médicament a été autorisé de manière centralisée au moyen du numéro d'autorisation ; le numéro commence alors par l'identifiant "EU". Par exemple, l'un des numéros d' approbation pour Humira est EU/ 1 / 03 / 256 / 007 . Le deuxième chiffre indique s'il s'agit d'un médicament vétérinaire ou humain (1 = humain, 2 = vétérinaire). Le troisième chiffre indique l'année de la première approbation, ici 2003.
De 1995 à septembre 2007, environ 400 médicaments à usage humain et 75 médicaments vétérinaires ont été autorisés dans le cadre de la procédure centralisée. Un rapport d'évaluation public européen (EPAR) détaillé est publié pour chaque médicament nouvellement autorisé .
Procédures décentralisées (MRP et DCP)
Dans la procédure de reconnaissance mutuelle (MRP) et la procédure décentralisée similaire (DCP), une demande d'agrément est examinée par l'autorité d'un État membre (État membre de référence) et un rapport d'évaluation est établi. Les autorités des autres États membres concernés reconnaissent alors cette évaluation dans un processus coordonné. Le demandeur peut choisir pour quels États membres de l'UE et de l'EEE il souhaite demander une autorisation.
Dans la procédure de reconnaissance mutuelle, une autorisation nationale est d'abord demandée et accordée dans un pays de choix avant que des demandes identiques ne soient soumises dans les autres pays et que la procédure de reconnaissance ne soit lancée. Dans la procédure décentralisée introduite en 2005, il ne doit pas y avoir d'agrément national dans l'UE ; Ici, des candidatures identiques sont soumises simultanément dans tous les États et un État est sélectionné comme État membre de référence.
Si des États membres individuels rejettent l'évaluation de l'État membre de référence en raison d'un risque grave pour la santé publique, tous les États participants doivent s'efforcer dans un groupe de coordination de parvenir à un accord sur les mesures à prendre. Si les autorités du groupe de coordination ne parviennent pas à un accord, une procédure d'arbitrage s'ensuivra au sein du comité scientifique de l'Agence européenne des médicaments. Sur la base de l'évaluation du comité scientifique, la Commission européenne prend une décision finale dans la procédure d'arbitrage après consultation des États membres au sein du comité permanent.
Dans les procédures non centralisées, l'autorisation est toujours accordée par les autorités nationales.
Plusieurs centaines de procédures non centralisées sont réalisées annuellement ; un grand nombre d'entre eux sont des génériques .
Procédures nationales
Jusqu'en 1995, les procédures nationales étaient le seul moyen d'obtenir l'approbation d'un médicament dans l'UE. Ces procédures nationales ont perdu beaucoup de leur importance du fait des procédures européennes. Cependant, il existe de nombreux médicaments sur le marché qui ont été approuvés en utilisant de telles procédures. Aujourd'hui, une approbation purement nationale n'est possible que dans un État membre ; les demandes nationales d'agrément dans plus d'un pays membre ne sont plus recevables. Aujourd'hui, une telle approbation nationale est généralement le point de départ de la procédure de reconnaissance mutuelle. En Allemagne se trouvent l' Institut fédéral des médicaments et des dispositifs médicaux (BfArM) pour les médicaments "normaux", l' Institut Paul Ehrlich pour les produits sanguins et les vaccins , l' Institut Friedrich Loeffler pour les médicaments vétérinaires immunologiques contre les maladies animales exotiques et l' Office fédéral de la protection des consommateurs et Responsable de la sécurité sanitaire des médicaments vétérinaires . Dans le secteur pharmaceutique Autriche sont par l' Agence autrichienne pour la santé et la sécurité alimentaire secteur Médecine Autorité des Marchés Financiers (anciennement AGES PharmMed) approuvé et contrôlé.
la Suisse
La Suisse n'étant ni membre de l'Union européenne ni de l'Espace économique européen, la Suisse procède à toutes les autorisations de médicaments de manière autonome ; En principe, cependant, les approbations de pays ayant des contrôles des drogues comparables peuvent être prises en compte. La base légale est la loi sur les produits thérapeutiques , qui réglemente les médicaments ainsi que les dispositifs médicaux. Les détails sur l'approbation peuvent être trouvés dans l'ordonnance sur l'approbation des médicaments. L'organisme chargé de l'autorisation et de la surveillance des médicaments est Swissmedic . Le délai de traitement interne des demandes d'autorisation est de 200 jours, pour les demandes en procédure accélérée de 130 jours. Il existe une procédure d'approbation simplifiée pour certains médicaments, y compris ceux dont les principes actifs sont connus, les médicaments issus de la médecine complémentaire, les préparations hospitalières et les médicaments pour les maladies rares ou mettant en jeu le pronostic vital.
États Unis
Aux États-Unis, l'approbation des médicaments est un processus qui démarre beaucoup plus tôt qu'en Europe.
En principe, le processus aux USA commence par la demande d'approbation de la première étude clinique (Investigational New Drug application, IND) . Là, non seulement des résumés, mais des rapports d'étude complets sont soumis, contrairement au processus d'approbation des essais cliniques en Europe, qui peut ensuite être ajouté en continu dans une soumission continue au cours du développement clinique (soumission continue) . Dans ce cas , de nombreux documents ont déjà été évalués pour la demande d'approbation proprement dite, la New Drug Application , NDA . Une fois que la NDA a été acceptée par la Food and Drug Administration (FDA) comme étant complète et conforme aux exigences formelles, la demande sera examinée par la FDA dans un délai déterminé. Après avoir entendu un comité d' experts et la société pharmaceutique, la FDA décide si le médicament sera approuvé, si la demande est approuvable , ce qui signifie que la FDA accepte d'approuver le médicament sous certaines conditions à remplir par le demandeur, ou si le La demande est rejetée (non approuvable) .
Seulement 10 % de tous les développements de médicaments qui commencent des essais cliniques sur l'homme reçoivent l'approbation de la FDA.
Sous certaines conditions, selon la règle d'efficacité animale, la preuve de l' efficacité dans les expérimentations animales est suffisante .
Reconnaissance internationale des décisions d'approbation
Même si de nombreux critères d'approbation des médicaments ont été harmonisés dans de nombreux pays et que les laboratoires pharmaceutiques soumettent souvent des documents pratiquement identiques, les autorités arrivent à des décisions contradictoires dans des cas individuels. Cela est dû au fait que les autorités disposent d'une grande latitude en matière d'approbation et que les déclarations essentielles sur le médicament sont basées sur des déclarations de probabilité.
Dans l'Union européenne, il a fallu trois décennies aux autorités nationales pour développer une compréhension mutuelle suffisante pour permettre le succès du processus d'approbation de l'UE.
Les autorités européennes d'une part et la FDA d'autre part en sont loin. Par exemple, un médicament contenant du rimonabant a été approuvé dans l'Union européenne en 2006 , tandis que la FDA a rejeté une demande d'approbation pour le même médicament en 2007 en raison de problèmes de sécurité. À l'inverse, le médicament anticancéreux Mylotarg avec l'anticorps monoclonal gemtuzumab-ozogamicine a été approuvé aux États-Unis dès 2000, tandis que la demande d'approbation dans l'UE a été rejetée en 2008.
En conséquence, divers efforts visant à reconnaître mutuellement les approbations de médicaments au niveau international n'ont jusqu'à présent abouti qu'à un succès partiel. Des accords de reconnaissance mutuelle pour la reconnaissance mutuelle des inspections sur les bonnes pratiques de fabrication ont été conclus entre l'Union européenne, l'Australie, le Japon, le Canada, la Nouvelle-Zélande, la Suisse et les États-Unis. L'accord avec les États-Unis n'a pas encore été mis en œuvre, celui avec le Japon que partiellement.
Procédures et catégories spéciales
Itinéraires spéciaux pour un accès plus rapide
Le développement et l'approbation de médicaments sont un processus long et pluriannuel. Afin de ne pas retarder inutilement l'accès à des médicaments innovants pouvant sauver des vies, des procédures spéciales ont été introduites dans l'Union européenne et aux États-Unis, destinées à accélérer l'approbation dans des cas exceptionnels.
La procédure d' évaluation accélérée dans la procédure centralisée de l'UE et la procédure d' examen prioritaire à la FDA ont considérablement réduit les délais de traitement par rapport aux procédures habituelles. Cela peut accélérer l'approbation de plusieurs mois ; Dans l'UE, le délai de traitement au sein du comité scientifique est réduit de 210 à 150 jours. Les autorités vérifient au cas par cas si une demande est en cours de traitement dans ce processus. Aux États-Unis jusqu'en 2006, environ 10 à 15 médicaments étaient traités et approuvés chaque année dans le cadre de l' examen prioritaire ; dans l'UE, l' éculizumab a été le premier médicament approuvé dans le cadre du processus accéléré à l'été 2007.
L' approbation conditionnelle (autorisation de mise sur le marché conditionnelle) de la procédure centralisée de l'UE sur la base du règlement 507/2006/CE permet au cas individuel, en particulier dans les maladies mortelles d'apporter un médicament avant de terminer l'essai clinique complet sur le marché. Dans ce cas, le laboratoire pharmaceutique s'engage à remplir les conditions précisées par l'autorité dans un certain délai, par exemple à fournir des données complètes de phase III ; l'agrément conditionnel est valable un an, mais peut être prorogé annuellement après évaluation par l'autorité jusqu'à ce qu'un agrément régulier soit accordé. Contrairement à une autorisation d'urgence, dans le cas d'une autorisation conditionnelle, le titulaire de l'autorisation est généralement entièrement responsable du médicament et de sa sécurité. Cette procédure n'est également possible qu'après un examen au cas par cas. Le premier médicament avec approbation conditionnelle dans l'UE était Sutent (ingrédient actif : Sunitinib ) à l'été 2006 . Selon une étude, pour les médicaments bénéficiant d'une approbation conditionnelle dans l'UE au cours de la période 2006-2015, le délai moyen pour remplir les exigences était de quatre ans ; dans plus d'un tiers des procédures, il y avait des retards ou des incohérences à cet égard. Les auteurs concluent que l'approbation conditionnelle permet l'accès à des médicaments dont la valeur clinique n'a pas été pleinement établie sur une longue période de temps, avec des risques correspondants possibles pour les patients.
L' approbation accélérée aux États-Unis présente des similitudes avec l'approbation conditionnelle dans l'UE ; Ici aussi, une approbation provisoire est accordée, à la condition que des études cliniques soient menées et achevées dans lesquelles un bénéfice pour le patient est prouvé avec des critères d'évaluation cliniquement pertinents. L' approbation accélérée repose principalement sur des marqueurs de substitution lors de la prise de décision . Le problème est qu'aux États-Unis, les entreprises ne satisfont souvent pas aux exigences d'achèvement des études cliniques après approbation.
L' approbation dans des cas exceptionnels (dans des circonstances exceptionnelles) dans le cadre de la procédure centralisée de l'UE est remise en question lorsqu'aucune donnée complète ne peut être fournie sur l'efficacité et la sécurité d'un médicament à l'avenir, peut-être parce que leur détection n'est pas possible ou contraire à l'éthique ou la maladie à traiter est très rare. Les conditions sont réévaluées annuellement.
Avec PRIME (médicaments prioritaires) , l'EMA propose depuis 2016 aux fabricants de médicaments une procédure qui peut toujours être choisie lorsqu'il y a un manque d' approvisionnement dans une zone (« besoin médical non satisfait » ) , c'est- à- dire lorsqu'il y a une thérapie efficace est absente ou le nouvel agent offre un avantage thérapeutique. En particulier, les petites entreprises ou les institutions universitaires devraient être soutenues par des conseils réglementaires et scientifiques continus dès les toutes premières phases de développement. Plus de 60 médicaments ont été inclus dans le programme PRIME à ce jour (à partir de 2020).
Le concept d' Adaptive Pathways (en allemand sur les « moyens personnalisables » ; également connu sous le nom de Medicines Adaptive Pathways to Patients , MAPP) fait partie des efforts de l'EMA, pour permettre un accès plus rapide aux nouveaux médicaments grâce à plus de flexibilité dans le cadre juridique existant des patients. Le concept de voie adaptative repose sur trois principes : Premièrement, le développement itératif - cela signifie soit une approbation progressive, en commençant par une population de patients limitée qui peut être étendue à une population plus large, soit la confirmation d'un rapport risque-bénéfice équilibré. sur les premières données avec des marqueurs de substitution étudiés comme prédicteurs des principaux résultats cliniques ; d'autre part, sur la collecte de preuves sur les données de soins (« real life use ») afin de compléter les données des études cliniques ; troisièmement, l'implication précoce des patients et des comités d'examen dans la discussion sur le développement de médicaments. Le BfArM et l'EMA ont testé l'approche voie adaptative de 2014 à 2016 dans un projet pilote. Les critiques craignent l'abaissement des normes d'approbation au détriment des aspects d'approbation auparavant strictement réglementés d'efficacité et d'innocuité. Les voies adaptatives ne doivent dans un premier temps être utilisées que pour certains médicaments, par exemple s'il existe un besoin urgent dû à un manque d'alternatives thérapeutiques (besoin médical non satisfait) . Le suivi du projet comprend la collaboration avec les organismes d' évaluation des technologies de la santé et d'autres intervenants tels que les patients et les payeurs.
Procédures d'urgence
Le processus d'examen continu ("rolling review" = "en cours d'examen") est l'un des instruments réglementaires à la disposition de l' Agence européenne des médicaments (EMA) dans le processus d'approbation centralisé pour évaluer un médicament expérimental prometteur lors d'une urgence dans le domaine de la santé publique - par exemple B. une pandémie - pour accélérer. Les rapporteurs sont déjà nommés pendant que le développement est en cours et l'EMA gardera les données à l'étude dès qu'elles seront disponibles.
Pour les vaccins contre la grippe ( vaccins contre la grippe) destinés à être utilisés dans des situations de pandémie, des procédures spéciales sont également en place pour accélérer leur disponibilité. Cela inclut l'UE, la méthode du vaccin modèle (procédure de maquette) , avec un vaccin modèle déjà approuvé est adapté à la souche pandémique actuelle, une fois qu'elle a été identifiée. Une autre procédure est la " procédure d'urgence" . Il permet l'approbation rapide d'un nouveau vaccin antigrippal s'il est développé à la suite d'un rapport de pandémie. Pour les deux procédures, la durée de l'évaluation par le comité scientifique est de 70 jours au lieu des 210 jours habituels. Une troisième procédure concerne l'approbation des vaccins dérivés de vaccins déjà approuvés pour une utilisation contre la grippe saisonnière . Cependant, ceux-ci ont été modifiés afin qu'ils puissent être utilisés pour se protéger contre la grippe pandémique . Cette procédure est généralement pratiquée au niveau national car la plupart des vaccins contre la grippe saisonnière sont approuvés au niveau national.
Aux États-Unis, il est possible de délivrer une autorisation d'utilisation d'urgence (EUA) pour les produits pharmaceutiques . Les Autorisations d'Usage d'Urgence pour les "contre-mesures médicales" ( Medical countermeasures , MCMs), par la Food and Drug Administration sont prononcées (FDA) lorsque l'existence d'une urgence dans le domaine de la santé publique a été constatée, par exemple en cas de NRBC - Bedrohung ou pandémie. La base légale est la loi fédérale sur les aliments, les médicaments et les cosmétiques ( loi FD&C).
Médicaments orphelins
Les médicaments orphelins sont des médicaments utilisés pour traiter, prévenir ou diagnostiquer une maladie rare . Dans ce sens, les maladies rares touchent moins de 5 personnes sur 10 000 dans l'UE. Dans l'UE, les médicaments orphelins doivent être autorisés dans le cadre d'une procédure centralisée ; Le statut de médicament orphelin est attribué par la Commission européenne sur la base d'une recommandation du Comité des médicaments orphelins (COMP) de l'Agence européenne des médicaments. Cela a été fait pour 500 médicaments en septembre 2007; 36 d'entre eux ont été approuvés à ce jour. Pour les médicaments orphelins, les laboratoires pharmaceutiques bénéficient d'un soutien de l'Agence européenne des médicaments pour planifier les études nécessaires, ainsi que de remises sur les frais d'approbation et d'inspection et d'une exclusivité commerciale de dix ans.
Drogues génériques
Les génériques sont des médicaments essentiellement identiques qui contiennent le même médicament dans la même dose et la même forme posologique qu'un médicament de référence qui n'est plus breveté. Des conditions d'autorisation simplifiées s'appliquent à ces médicaments. À cette fin, la production et la qualité pharmaceutique doivent être documentées et la biodisponibilité et la bioéquivalence avec le médicament d' origine doivent être documentées. Pour les autres données non cliniques et cliniques, le demandeur peut se référer aux données du médicament de référence. Dans l'UE, cependant, indépendamment de la protection par brevet, cela n'est possible que huit ans après l'approbation du médicament de référence ; l'approbation elle-même n'est accordée que dix ans après l'approbation initiale. Pour les biosimilaires, des conditions spéciales s'appliquent.
Pour les médicaments dont les principes actifs sont déjà connus, il existe un autre type de demande avec des conditions d'approbation simplifiées au-delà de "l'usage médical général" ( usage bien établi) : Le demandeur n'a pas à soumettre de données issues de ses propres essais précliniques et cliniques s'il peut prouver que les principes actifs du médicament sont utilisés à des fins médicales générales dans l'UE depuis au moins dix ans. Une autre documentation scientifique pertinente, à partir de laquelle les effets et effets secondaires déjà connus peuvent être vus, remplace alors les propres études. Par exemple, pour les médicaments dont les principes actifs à base de plantes sont connus, les monographies élaborées par le comité des médicaments à base de plantes peuvent être utilisées.
Procédure après approbation
L'octroi d'une licence est une étape cruciale, mais cela ne met en aucun cas un terme aux activités de réglementation. Les documents d'enregistrement doivent être mis à jour en permanence et l'utilisation d'un médicament doit être surveillée en permanence. Dans le cas des nouveaux médicaments, l'approbation n'est accordée que pour une période limitée, généralement cinq ans. Avant l'expiration de cette période, l'agrément doit être renouvelé, généralement il est alors valable indéfiniment. Cependant, si un médicament approuvé n'est pas mis sur le marché dans un délai déterminé, ou s'il n'est pas sur le marché pendant une période plus longue, l'approbation expire généralement ( "sunset clause" ). Pour les pays de l'UE, ce délai ou délai est de trois ans.
Modifier les notifications
L'entreprise pharmaceutique a l' obligation d'informer les autorités compétentes de tous les changements affectant l'approbation qui a été accordée. Selon la mesure dans laquelle les modifications doivent être appliquées, certaines d'entre elles doivent être approuvées par les autorités. Les modifications simples qui ne nécessitent qu'une notification sont, par exemple, des modifications administratives chez le fabricant ou des modifications mineures dans le processus de fabrication. Les modifications de la dose , de la forme galénique ou du formulaire de demande , par exemple, nécessitent une approbation . Toute modification du résumé des caractéristiques du produit nécessite également une approbation.
Si l'approbation d'un médicament doit être étendue à une autre indication, cela nécessite une demande d'approbation distincte et complète.
Pharmacovigilance
L'entreprise pharmaceutique est obligée de recueillir et d'évaluer les résultats sur les effets indésirables des médicaments même après l'obtention de l'approbation. L'autorité de surveillance doit en être informée à des intervalles spécifiés et, en cas d'effets secondaires graves et inattendus, dans des délais courts. Une surveillance continue est importante car dans les essais cliniques avec seulement quelques milliers de patients, il n'est pas possible de détecter des effets secondaires rares ou très rares. Les effets secondaires qui surviennent très tardivement sont également difficiles à enregistrer dans les études d'approbation.
De nouvelles découvertes peuvent conduire à la restriction de l'autorisation, par exemple en modifiant le résumé des caractéristiques du produit. Si, lors de l'utilisation d'un médicament, il existe des preuves d'effets secondaires graves qui rendent le rapport bénéfice-risque défavorable, l'approbation peut également être complètement révoquée. Parmi les médicaments contenant de nouveaux principes actifs approuvés aux États-Unis entre 1975 et 1999, 2,9 % ont été retirés du marché en raison de carences. Au Royaume-Uni, il était de 3,8 % entre 1972 et 1994. La raison prédominante du retrait du marché sont les effets secondaires inacceptables. Dans certains cas, comme le clobutinol , l'approbation n'a été retirée en raison de problèmes de sécurité qu'après que le médicament ait été utilisé pendant des décennies.
Dans le domaine de la pharmacovigilance également, les autorités pharmaceutiques effectuent des inspections dans les entreprises pharmaceutiques pour vérifier si les mesures de surveillance prescrites sont correctement mises en œuvre.
Historique de l'approbation des médicaments
Des procédures d'approbation ont été introduites dans le monde entier après que la préparation pharmaceutique a été largement remplacée dans les pharmacies par la production industrielle et que divers scandales liés à la drogue ont ébranlé la confiance dans la sécurité des médicaments.
Depuis le début du XXe siècle, la production industrielle de produits pharmaceutiques a largement remplacé la préparation pharmaceutique. Cependant, peu de pays disposaient de procédures d'autorisation de mise sur le marché des médicaments dès la première moitié du XXe siècle, notamment la France, la Suède, la Norvège et surtout les États-Unis. Aux États-Unis, le Federal Food, Drug and Cosmetic Act de 1938 a rendu obligatoire l' approbation des nouveaux médicaments ; cette loi a été adoptée par le Congrès après la catastrophe du sulfanilamide . Cependant, à l'époque, les critères d'approbation se limitaient à la qualité et à la sécurité pharmaceutiques ; À ce moment-là, un médicament était considéré comme approuvé si l'autorité compétente, la Food and Drug Administration (FDA), ne s'y opposait pas dans un certain délai.
Le critère d'efficacité et la procédure d'approbation actuelle n'ont été introduits aux États-Unis qu'en 1962 par le Kefauver-Harris Drug Amendment , qui a été discuté en même temps que le scandale de la thalidomide était découvert . Les événements de l'époque ont eu un impact durable sur le processus législatif ; Le processus législatif initial du Congrès contre les prix excessifs des médicaments et la publicité déloyale des médicaments est devenu une loi sur la protection des consommateurs. Les critères d'admission restrictifs développés aux États-Unis à l'époque ont été adoptés par de nombreux autres pays dans les années qui ont suivi. À la fin des années 1980 et au début des années 1990, des procédures d'approbation accélérées ont été introduites aux États-Unis en réponse au besoin urgent de médicaments pour traiter le SIDA .
Toujours à la suite du scandale de la thalidomide, dans la Communauté économique européenne , la directive // CEE 65 65 du Conseil du 26 janvier 1965 relative au rapprochement des dispositions législatives, réglementaires et administratives relatives aux médicaments a été approuvée. Pour la première fois, cela prévoyait une autorisation de mise sur le marché des médicaments et exigeait la preuve de l'efficacité thérapeutique. La directive 75/319 / CEE suivante de 1975 était beaucoup plus détaillée dans les exigences d'approbation. En outre, un nouveau groupe d'experts européens a été créé par la directive instituée par le Comité des spécialités pharmaceutiques ( Comité anglais des spécialités pharmaceutiques, CPMP ), précurseur de l'actuel Comité à usage humain (CHMP). En 1987, la directive 87/22/CEE a défini la procédure de conciliation pour les médicaments innovants, ancêtre de la procédure centralisée actuelle, qui a été définie en 1993 avec la directive 2309/93/CEE et mise en œuvre à partir de 1995. Il a fallu attendre les réformes entrées en vigueur en 1995 pour que les procédures communautaires soient largement utilisées. Le cadre actuel a ensuite été créé lors de la révision de la législation pharmaceutique européenne de 2001 à 2004.
En République fédérale d'Allemagne, la transposition de la première directive CEE de 1965 dans le droit national a été un long processus qui n'a abouti qu'à l'entrée en vigueur de la deuxième loi sur les drogues de 1976 . Il a fallu attendre 1975 pour que l' Institut pour les médicaments pour l' approbation des médicaments a été fondée dans ce qui était alors le Bureau fédéral de la santé , après l'Office fédéral de la santé a été dissous en 1994 à la suite du scandale du sang-sida, il est devenu aujourd'hui l' Institut fédéral des médicaments et dispositifs médicaux . L'application des nouveaux instruments juridiques aux anciens produits pharmaceutiques dans la procédure de réautorisation a duré jusqu'à fin 2005 en Allemagne.
Littérature
- Martin Lorenz : La loi communautaire d'approbation des médicaments avec une attention particulière à la réforme de 2004/2005. Nomos-Verlags-Gesellschaft, Baden-Baden 2006, ISBN 3-8329-1912-0 .
liens web
- EudraLex - Volume 2 - Législation pharmaceutique sur les avis aux demandeurs et lignes directrices réglementaires pour les médicaments à usage humain
- Agence européenne des médicaments
- Institut fédéral des médicaments et dispositifs médicaux (BfArM)
- Base de données des médicaments agréés au BfArM
- Institut Paul Ehrlich
- Agence autrichienne pour la santé et la sécurité alimentaire
- Swissmedic (Institut suisse des produits thérapeutiques)
- Médicaments dans l'Union européenne (PDF)
Preuve individuelle
- ↑ Elizabeth Storz : Sécurité des médicaments. Dans : GIT Labor-Fachzeitschrift. Août 2008, p. 712-714.
- ↑ Section 4 (15) AMG.
- ^ Fabrication et contrôles de chimie (CMC). Directives pour l'industrie (GFI). Récupéré le 16 mars 2021 .
- ↑ Karl Feiden , Hermann Pabel: Dictionnaire de pharmacie. Volume 3 : Droit des médicaments et de la pharmacie. Maison d' édition scientifique, Stuttgart 1985, ISBN 3-8047-0670-3 .
- ↑ Directive 2001/83/CE , Annexe I, Partie I, Section 5.2.5.1.
- ↑ Robert Kemp et Vinay Prasad : Critères de substitution en oncologie : quand sont-ils acceptables pour les décisions réglementaires et cliniques, et sont-ils actuellement surexploités ? , BMC Medicine Volume 15, Article 134 (2017), consulté le 30 octobre 2019.
- ↑ STIKO : Méthodes de mise en œuvre et de prise en compte de la modélisation pour la prédiction des effets épidémiologiques et économiques des vaccinations pour la Commission permanente de vaccination , 16 mars 2016, consulté le 30 octobre 2019.
- ↑ FDA : Table of Surrogate Endpoints That Were the Basis of Drug Approval or Licensure , en ligne le 30 septembre 2019, consulté le 30 octobre 2019.
- ↑ BVerwG E Tome 84, pp. 215-224, arrêt du 14 octobre 1993 Az. 3 C 21.91.
- ↑ § 5 AMG.
- ↑ Dieter Hart : L'évaluation bénéfice/risque en droit pharmaceutique. Un élément de l'évaluation des technologies de la santé. Dans : Gazette fédérale de la santé . Volume 48, 204-14 (2005), PMID 15726462 . doi: 10.1007 / s00103-004-0977-2
- ^ P. Dieppe, C. Bartlett, P. Davey, L. Doyal, S. Ebrahim : Équilibrer les avantages et les inconvénients : l'exemple des anti-inflammatoires non stéroïdiens. Dans : BMJ . Volume 329 (7456), 2004, pp. 31-34, PMID 15231619 .
- ↑ Conseil consultatif scientifique de l'Institut Paul Ehrlich : Compte rendu de la réunion constitutive du 30 mai 2017 ( PDF ).
- ↑ Procédure centralisée sur le site de l'Institut fédéral des médicaments et des dispositifs médicaux, consulté le 10 Juin, à 2020.
- ↑ Volume 2A - Procédures d'AMM, Chapitre 2 - Reconnaissance mutuelle. ( PDF ) Dans : EudraLex - Volume 2 - Législation pharmaceutique sur les avis aux demandeurs et lignes directrices réglementaires pour les médicaments à usage humain .
- ↑ Statistiques sur les processus d'approbation non centralisés au niveau des chefs d'agences du médicament .
- ↑ Informations pour les entreprises pharmaceutiques , sur le site de la FDA.
- ↑ Opinion | La solution aux prix des médicaments . 9 septembre 2015 ( nytimes.com [consulté le 29 octobre 2018]).
- ↑ Coopération internationale dans le domaine pharmaceutique - Documents clés , Commission européenne. Consulté le 10 juin 2020.
- ↑ Évaluation accélérée dans le glossaire EMA, consulté le 10 juin 2020.
- ↑ NME Drug and New Biologic Approvals in 2006 , FDA Document Archive, consulté le 10 juin 2020.
- ↑ Nouvelle entité moléculaire (NME) Drug and New Biologic Approvals , site Web de la FDA, consulté le 10 juin 2020.
- ↑ L' EMEA conclut la première évaluation accélérée d'un médicament à usage humain , communiqué de presse de l'EMA du 27 avril 2007 ( PDF ).
- ↑ Autorisation de mise sur le marché conditionnelle dans le glossaire EMA, consulté le 10 juin 2020.
- ↑ Questions et réponses : Autorisation de mise sur le marché conditionnelle des vaccins COVID-19 dans l'UE. Commission européenne, 11 décembre 2020, consulté le 20 août 2021 .
- ↑ Questions et réponses : Autorisation de mise sur le marché conditionnelle pour les vaccins COVID-19 dans l'UE. Commission européenne, 11 décembre 2020, consulté le 20 août 2021 .
- ^ R. Banzi, C. Gerardi, V. Bertele, S. Garattini: Approbations de médicaments avec des profils bénéfice-risque incertains en Europe . Dans : Journal européen de médecine interne . ruban 26 , 2015, p. 572-584 , doi : 10.1016 / j.ejim.2015.08.008 .
- ^ CD Furberg, AA Levin, PA Gross, RS Shapiro, BL Strom : La FDA et la sécurité des médicaments : une proposition de changements radicaux. Dans : Arch Intern Med . Volume 166 (18), 2006, p. 1938-1942, PMID 17030825 .
- ↑ Circonstances exceptionnelles dans le glossaire EMA, consulté le 10 juin 2020.
- ↑ Agence européenne des médicaments : PRIME : médicaments prioritaires. Consulté le 12 juin 2020 .
- ↑ a b EMA : Adaptive paths : « L'approche des voies adaptatives fait partie des efforts de l'Agence européenne des médicaments (EMA) pour améliorer l'accès en temps opportun des patients aux nouveaux médicaments », consulté le 10 septembre 2017.
- ↑ Rapport final sur le résumé pilote des voies adaptatives du projet pilote du 28 juillet 2016, consulté le 10 septembre 2017.
- ^ PV Bonanno et al. : Cheminements adaptatifs : Prochaines étapes possibles pour les payeurs en vue de leur mise en œuvre potentielle . Dans : Frontières en pharmacologie . ruban 8 , 2017, doi : 10.3389 / fphar.2017.00497 , PMC 5572364 (texte intégral gratuit).
- ↑ HG Eichler et al. : Les voies d'adaptation des médicaments aux patients : pourquoi, quand et comment s'engager ? Dans : Pharmacologie Clinique et Thérapeutique . ruban 105 , non. 5 , 2018, doi : 10.1002 / cpt.1121 , PMC 6585618 (texte intégral gratuit).
- ^ Agence européenne des médicaments : Comment l'EMA accélère le soutien au développement et l'approbation des médicaments et des vaccins. Consulté le 12 juin 2020 .
- ↑ a b Agence européenne des médicaments (EMA) : Procédures d'autorisation. Consulté le 12 juin 2020 .
- ^ FDA : Autorisation d'utilisation d'urgence. Consulté le 27 juin 2020 .
- ↑ Agence européenne des médicaments pour les médicaments orphelins (médicaments pour les maladies rares) . ( Memento du 31 janvier 2017 dans Internet Archive ).
- ↑ Utilisation bien établie dans le glossaire EMA, consulté le 10 juin 2020.
- ↑ Directive 2001/83 / CE du Parlement européen et du Conseil du 6 Novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain mi l , article 24
- ↑ Règlement (CE) n ° 726/2004 , l' article 14.
- ↑ KE Lasser, PD Allen, SJ Woolhandler, DU Himmelstein, SM Wolfe, DH Bor : Calendrier des nouveaux avertissements et retraits de la boîte noire pour les médicaments sur ordonnance. Dans : JAMA . Volume 287 (17), 2002, p. 2215-2220, PMID 11980521 .
- ^ DB Jefferys, D. Leakey, JA Lewis, S. Payne, MD Rawlins : Nouvelles substances actives autorisées au Royaume-Uni entre 1972 et 1994. Dans : Br J Clin Pharmacol . Volume 45 (2), 1998, p. 151-156, PMID 9491828 .
- ↑ Jürgen Feick : Réglementation de l'accès au marché : Réglementation nationale, intégration européenne et harmonisation internationale dans l'approbation des médicaments. In : Roland Czada, Susanne Lütz (éd.) : La constitution politique des marchés. Westdeutscher Verlag, Wiesbaden 2000, ISBN 3-531-13415-9 , p. 228-249.
- ^ Jürgen Feick : Autorisation de mise sur le marché des produits pharmaceutiques dans l'Union européenne. Dans : Rejoindre les régulateurs européens. European Policy Forum, Londres 2008, ISBN 978-1-903850-29-9 , pp. 35-63.
- ↑ Reinhard Kurth : Le développement de l'Institut fédéral du médicament et des dispositifs médicaux (BfArM) face à la concurrence européenne croissante. Dans : Gazette fédérale de la santé. Volume 51 (3), 2008, p. 340-344, PMID 18369569 .