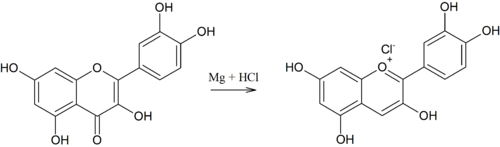Anthocyanidines
Les anthocyanidines représentent la partie colorante des anthocyanes (un groupe de pigments végétaux ) Les anthocyanines sont structurellement composées d'une anthocyanidine, de l' aglycone et de sucres liés par un glycoside . Le spectre des sucres naturellement formés donne une variété d'environ 250 anthocyanes.
l'histoire
Richard Willstätter , qui a reçu le prix Nobel de chimie en 1915 pour ses travaux pionniers systématiques dans ce domaine , a apporté une contribution significative à l'élucidation de la structure des anthocyanes . Il a réussi à isoler les anthocyanes d'extraits de plantes et à en libérer et identifier les anthocyanidines par des réactions de dégradation. En fin de compte, seules une dizaine d'anthocyanidines sont connues pour être des composés parents naturels.
structure
La liaison glycosidique dans les anthocyanes peut être coupée par catalyse acide et ainsi l'anthocyanidine peut être libérée. Les anthocyanidines ont de multiples hydroxy-2- phénylchroményliumsalze (sels de flavylium), en tant que contre- ion des sels de benzo pyrylium agissent dans la nature généralement des carboxylates de divers acides solubles dans l'eau dans des préparations de laboratoire souvent du chlorure . Les picrates étaient utilisés pour la cristallisation . De loin, le plus important de ce groupe de pigments végétaux est la cyanidine , suivie de la delphinidine et de la pélargonidine . Leurs éthers méthyliques peonidin , pétunidin et malvidin sont également fréquemment trouvés. La myrtilline est un glycoside de la delphinidine.
| Anthocyanidine | CAS (a) | Structure de base (R 3 = −OH) | R 1 , R 2 | - | R 5 | R 6 | R 7 | - | λ max (b) | - | pK S 1 (c) | pK S 2 | pK S 3 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Guibourtinidine (d) | 13544-54-2 |

|
−H, −H | −H | −H | −OH | 504 nm | .... | .... | .... | ||||
| Fisétinidine (d) | 2948-76-7 | −OH, −H | −H | −H | −OH | 520 nm | .... | .... | .... | |||||
| Robinetinidine (d) | 3020-09-5 | -OH, -OH | −H | −H | −OH | 532 nm | .... | .... | .... | |||||
| Pélargonidine (d) | 134-04-3 | −H, −H | −OH | −H | −OH | 523 nm | nb | .... | .... | |||||
| Cyanidine (d) | 528-58-5 | −OH, −H | −OH | −H | −OH | 538 nm | 2,98 ± 0,05 | 7,5 | .... | |||||
| Peonidin (paeonidin) | 134-01-0 | -OCH 3 , -H | −OH | −H | −OH | 536 nm | 2,09 ± 0,10 | 6,8 | .... | |||||
| Rosinidine | 4092-64-2 | -OCH 3 , -H | −OH | −H | −OCH 3 | .... | .... | .... | ||||||
| Delphinidine (d) | 528-53-0 | -OH, -OH | −OH | −H | −OH | 548 nm | 1,56 ± 0,20 | 5,85 | .... | |||||
| Pulchellidine | 19077-86-2 | -OH, -OH | −OCH 3 | −H | −OH | .... | .... | .... | ||||||
| Pétunidine | 1429-30-7 | -OCH 3 , -OH | −OH | −H | −OH | 547 nm | .... | .... | .... | |||||
| Europinidine | 19077-87-3 | -OCH 3 , -OH | −OCH 3 | −H | −OH | .... | .... | .... | ||||||
| Malvidin | 643-84-5 | -OCH 3 , -OCH 3 | −OH | −H | −OH | 546 nm | 1,76 ± 0,07 | 5,36 ± 0,04 | 8,39 ± 0,07 | |||||
| Capensinidine | 19077-85-1 | -OCH 3 , -OCH 3 | −OCH 3 | −H | −OH | .... | .... | .... | ||||||
| Hirsutidine | 4092-66-4 | -OCH 3 , -OCH 3 | −OH | −H | −OCH 3 | .... | .... | .... | ||||||
| Aurantinidine (d) (e) | 25041-66-1 | −H, −H | −OH | −OH | −OH | .... | .... | .... | ||||||
| Quercétagétinidine (d) (f) | 42529-06-6 | −OH, −H | −OH | −OH | −OH | 519 nm | .... | .... | .... | |||||
| 6-hydroxydelphinidine (d) | 178436-68-5 | -OH, -OH | −OH | −OH | −OH | .... | .... | .... | ||||||
|
(une) Numéros CAS des chlorures.
(b)Absorption UV dans le méthanol avec 0,1% HCl. Les anthocyanidines absorbent la lumière environ 10 nm plus longtemps que les anthocyanidines glycosides ( déplacement bathochrome ).
(c)Valeurs pK S de divers glycosides d'anthocyanidine
(ré) composés parents non substitués
(e) 6-hydroxypélargonidine
(F) 6-hydroxycyanidine
| ||||||||||||||
Les anthocyanidines ont toujours un substituant p-hydroxyphényle (cycle B) en position 2 et un groupe hydroxyle en position 3 . Les anthocyanidines naturelles les plus importantes sont hydroxy-substituées en position 5 et 7 du cycle A.
En plus du groupe des anthocyanidines, il existe également le petit groupe des 3-désoxyanthocyanidines (avec R 3 = H). Qui inclut
- Apigéninidine (3-désoxypélargonidine, gesnéridine)
- Lutéolinidine (3-désoxycyanidine) et, sous forme d'éther méthylique, diosmétinidine (3-désoxypeonidine)
- Tricétinidine (3-désoxydelphinidine)
- Columnidine
Les 3-déoxyanthocyanidines se comportent comme des anthocyanidines en termes de couleur et d' acidité .
Propriétés
Les anthocyanidines sont sensibles à la lumière, à l'air et à la température; à des pH inférieurs à 3, elles sont plus stables sous la forme de leurs sels de flavylium.
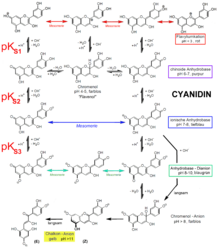
Les anthocyanidines absorbent la lumière dans le domaine visible entre 450 et 650 nm et apparaissent donc en rouge, violet ou bleu. La gamme de longueurs d'onde est influencée non seulement par la structure moléculaire mais également par le pH de la solution. Dans l' environnement acide , la couleur rouge prédomine, dans l'environnement alcalin , on trouve principalement des tons bleus et violets.
Dépendance au pH du changement de couleur
Les changements de couleur sont basés sur des réactions chimiques .
- À des pH inférieurs à 3, ils sont colorés en rouge et se présentent sous la forme de cations flavylium .
- Des pH compris entre 4 et 5 conduisent à des pseudobases carbinol incolores ("leuco bases", chroménol) par hydroxylation .
- À des pH compris entre 5 et 7, ils sont présents sous forme de flavénols à structure quinoïde et sont violets.
- A des pH compris entre 7 et 8, cette molécule est déprotonée en anion flavénolate , qui a une couleur bleue. Ici, les électrons Π de la molécule entière sont délocalisés sur la plus longue distance possible et peuvent donc être excités avec l'énergie lumineuse la plus faible possible.
- S'il n'y a pas de groupe glycoside en position 5, des valeurs de pH supérieures à 8 conduisent également à des dianions de flavénolate, mais dans l'environnement alcalin, l'ouverture hydrolytique du cycle pyrane entre en compétition . La molécule est convertie de manière irréversible en un anion chalcone jaune .
- Par rapport aux valeurs pK S des dihydroxybenzènes (pK S environ 9,5 et 11,7), les anthocyanidines sont plus de 1000 fois plus acides. Les sels de flavylium dans l'eau sont plus de 10 fois plus acides que l'acide formique (pK S 3,8).
la synthèse
En 1921, sur la base de l'analyse des schémas de substitution des flavonoïdes, Robert Robinson est arrivé à la conclusion que les flavonoïdes et donc les anthocyanidines doivent être composés biochimiquement d'une unité C6 et C6-C3. En 1953, Arthur Birch et FW Donovan ont élargi cette théorie: la biosynthèse des flavonoïdes doit commencer à partir d'un acide p-hydroxycinnamique et de trois unités acétate , un acide polycéto est formé comme intermédiaire .
Les anthocyanidines ne sont souvent pas produites synthétiquement directement, mais via des flavonoïdes similaires . Les flavones sont équivalentes redox avec les anthocyanidines, les flavanones avec les 3-désoxyanthocyanidines. De nombreuses méthodes sont connues pour réduire les flavones, flavanones et flavonols en anthocyanidines ou 3-désoxyanthocyanidines correspondantes.
Anthocyanidines
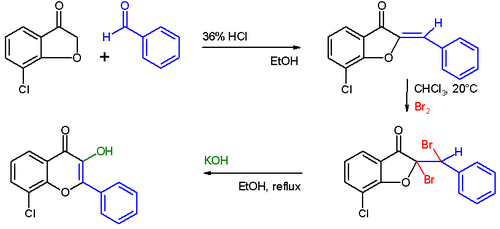
Les anthocyanidines sont accessibles en préparation par une condensation de Knoevenagel de salicylaldéhydes à substitution 3,5-diméthoxy avec des a-méthoxyacétophénones. Le produit primaire se tautomérise avec la fermeture du cycle pour former l'a- flavanol , qui sépare l'eau lorsque l'acide est ajouté et donne le sel de flavylium à substitution méthoxy ( annulation de Robinson ). Les groupes éther méthylique peuvent être séparés doucement avec de l'acide hydriodique .
Flavones
La condensation Allan-Robinson et sa variante intramoléculaire, le réarrangement Baker-Venkataraman , conduisent à des flavones par des réactions de condensation catalysées par une base .
Flavonols
Dès 1908, par hasard , Karl von Auwers découvrit une réaction d' expansion en anneau ( réaction d'Auwers ), qui conduit des coumarones aux flavonols .
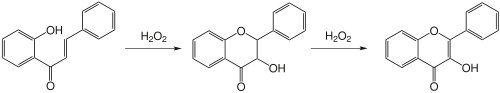
La réaction Algar-Flynn-Oyamada est une réaction de fermeture de cycle catalysée par une base avec du peroxyde d'hydrogène. Ici, les intermédiaires de flavone sont oxydés en flavonol .
réduction
Des méthodes classiques de réduction douce peuvent être utilisées pour réduire spécifiquement les flavones en 3-désoxyanthocyanidines ou les flavonols en anthocyanidines. Cependant, avec des méthodes de réduction drastiques (amalgame de sodium dans l'eau), les flavanones peuvent également être converties en sels de flavylium de couleur rouge.
Voir également
Revoir l'article
- H. Halbwirth: "La création et la pertinence physiologique de modèles d'hydroxylation divergents dans la voie des flavonoïdes", dans Int J Mol Sci. 2010 , 11, 595-621 ( PMC 2852856 (texte intégral gratuit)).
Preuve individuelle
- ↑ R. Willstätter, AE Everest: «Enquêtes sur les anthocyanes. I. À propos de la matière colorante du bleuet », Liebigs Ann. Chem. , 401 , 189-232 (1913) ( doi: 10,1002 / jlac, 19134010205 ).
- ↑ R. Willstätter, TJ Nolan: «Enquêtes sur les anthocyanes. II. À propos de la couleur de la rose », Liebigs Ann. Chem. , 408 , 1-14 (1915) ( doi: 10,1002 / jlac, 19154080102 ).
- ^ R. Willstätter, H. Mallison: «Enquêtes sur les anthocyanes. III. À propos de la couleur de l'airelle », Liebigs Ann. Chem. , 408 , 15-41 (1915) ( doi: 10,1002 / jlac, 19154080103 ).
- ^ R. Willstätter, EK Bolton: «Enquêtes sur les anthocyanes. IV. À propos de la couleur du pélargonium écarlate », Liebigs Ann. Chem. , 408 , 42-61 (1915) ( doi: 10,1002 / jlac, 19154080104 ).
- ^ R. Willstätter, W. Mieg: «Enquêtes sur les anthocyanes. V. À propos d'une anthocyane du delphinium », Liebigs Ann. Chem. , 408 , 61-82 (1915) ( doi: 10,1002 / jlac, 19154080105 ).
- ↑ R. Willstätter, EH Zollinger: «Enquêtes sur les anthocyanes. VI. À propos des colorants des raisins et des myrtilles », Liebigs Ann. Chem. , 408 , 83-109 (1915) ( doi: 10,1002 / jlac, 19154080106 ).
- ↑ R. Willstätter, K. Martin: «Enquêtes sur les anthocyanes. VII. À propos de la teinture d'Althaea rosea », Liebigs Ann. Chem. , 408 , 110-121 (1915) ( doi: 10,1002 / jlac, 19154080107 ).
- ^ R. Willstätter, W. Mieg: «Enquêtes sur les anthocyanes. VIII. À propos de la teinture de la mauve sauvage », Liebigs Ann. Chem. , 408 , 122-135 (1915) ( doi: 10,1002 / jlac, 19154080108 ).
- ↑ R. Willstätter, TJ Nolan: «Enquêtes sur les anthocyanes. IX. À propos de la teinture de la pivoine », Liebigs Ann. Chem. , 408 , 136-146 (1915) ( doi: 10,1002 / jlac, 19154080109 ).
- ^ R. Willstätter, H. Mallison: «Enquêtes sur les anthocyanes. X. À propos des variations des couleurs des fleurs », Liebigs Ann. Chem. , 408 , 147-162 (1915) ( doi: 10,1002 / jlac, 19154080110 ).
- ^ R. Willstätter, EK Bolton: «Enquêtes sur les anthocyanes. XI. À propos de l'anthocyane des espèces de Salvia à fleurs rouges », Liebigs Ann. Chem. , 412 , 113-136 (1917) ( doi: 10,1002 / jlac, 19174120202 ).
- ↑ Entrée sur les anthocyanidines . Dans: IUPAC Compendium of Chemical Terminology (le «Livre d'or») . doi : 10.1351 / goldbook.A00379 Version: 2.3.1.
- ↑ Données analytiques pour diverses anthocyanidines .
- ↑ Représentation comparative des spectres VIS .
- ^ H. Pyysalo, O. Mäkitie: "Etudes spectrométriques sur la dissociation acide de l'anthocyanine dans des solutions aqueuses" . Acta Chem Scand. , 1973 , 27 , 2681-2682 ( PDF ).
- ↑ Robert E. Asenstorfer, Patrick G. Iland, Max E. Tate, Graham P. Jones: "Équilibres de charge et pK a de malvidine-3-glucoside par électrophorèse", Analytical Biochemistry , 2003 , 318 , 291-299 ( doi: 10.1016 / S0003-2697 (03) 00249-5 ).
- ↑ Josh Hurwitz: Détermination des propriétés d'acide / alcali et de couleur de l'anthocyanine delphinidin-3-monoglucoside chez Hydrangea Macrophylla . Ed.: Université de Floride. ( weebly.com [PDF; 1 000 kB ; consulté le 20 février 2016]).
- ↑ pK S 3 = 8,06 pour l'apigéninidine déterminée par L. Costantino, G. Rastelli, M. Rossi et A. Albasini: «Mesure quantitative de la dissociation des protons et des constantes tautomériques de l'apigéninidine», J. Chem. Soc., Perkin Trans. 2 , 1995 , pages 227-234 ( doi: 10,1039 / P29950000227 ).
- ↑ Les substances naturelles comme indicateurs de pH .
- ↑ Les colorants jaunes absorbent en dessous de 400 nm, voir Quercétine , Chalcon à 350 nm.
- ↑ Structure chimique des anthocyanines - Dépendance au pH, p. 17 ( aperçu limité dans la recherche de livres Google).
- ↑ Y. Asahina, G. Nakagome, M. Inubuse: «À propos de la réduction des flavones et des dérivés de flavanone (V. Communication sur les glucosides de flavanone)», Ber. Allemand Chem. Ges. , 1929 , 62 , pages 3016-3021 ( doi: 10.1002 / cber.19290621112 ) et leurs références.
- ↑ TS Wheeler: Flavones In: Synthèses organiques . 32, 1952, page 72, doi : 10,15227 / orgsyn 032,0072 ; Coll. Vol.4, 1963, p. 478 ( PDF ).
- ^ K. Auwers, K. Müller: "Conversion de Benzal-Coumaranonen dans Flavonole", Ber. Allemand Chem. Ges. , 41 , 4233-4241 (1908) ( doi: 10,1002 / cber . 190804103137 ).
- ↑ K. c. Auwers, P. Pohl: «À propos de la conversion des coumaranones benzales en flavonols», Liebigs Ann. Chem. , 405 , 243-294 (1914) ( doi: 10,1002 / jlac, 19144050302 ).
- ↑ K. c. Auwers, P. Pohl: «Une synthèse des fisétines», Ber. Allemand Chem. Ges. , 48 , 85-90 (1915) ( doi: 10,1002 / cber.19150480114 ).
- ↑ K. c. Auwers: "Sur la formation de flavonols à partir de benzal-coumaranones", Ber. Allemand Chem. Ges. , 49 , 809-819 (1916) ( doi: 10,1002 / cber.19160490188 ).
- ↑ K. c. Auwers, E. Auffenberg: "À propos des coumaranones et des hydrindones", Ber. Allemand Chem. Ges. , 52 , 92-113 (1919) ( doi: 10,1002 / cber.19190520114 ).
- ↑ F. Tiemann , W. Will: «À propos de l'hespéridine, un glucoside des Aurantiacées, et de ses produits de clivage», Ber. Allemand Chem, Ges. , 14 , 946 à 974 (1881).