Glycolyse
La glycolyse ( , grec ancien γλυκύς glykys , doux 'et lyse , Résolution') se fait par des êtres vivants des monosaccharides phasés (sucres simples) tels que le D - glucose (dextrose), d'où le nom de glycolyse est dérivé. C'est le processus central dans la décomposition de tous les glucides chez tous les eucaryotes , y compris les animaux , les plantes et les champignons . Chez les bactéries et les archées, la glycolyse est également courante. Cependant, certaines espèces utilisent également d'autres voies métaboliques pour décomposer le glucose, par exemple la voie Entner-Doudoroff (voie ED). La glycolyse est un processus central du métabolisme énergétique et l'une des rares voies métaboliques que presque tous les organismes ont en commun, ce qui indique un développement très précoce.
Le démontage s'effectue en dix étapes individuelles. Cela crée deux molécules de pyruvate à partir d'une molécule de glucose . De plus, deux molécules d' adénosine triphosphate (ATP) adaptées au transfert d'énergie se forment et deux molécules de NAD + sont réduites en NADH.
La glycolyse est aussi appelée Embden-Meyerhof-Parnas-Weg ou EMP-Weg d' après ses découvreurs Gustav Embden , Otto Meyerhof et Jakub Karol Parnas . Le terme voie FDP , qui remonte au produit intermédiaire D - fructose-1,6-bisphosphate (obsolète : fructose diphosphate), n'est plus d'usage .
Histoire de découverte

Les études sur la dégradation du sucre remontent bien au XIXe siècle et ont commencé à l'origine par des recherches sur la fermentation alcoolique ou, plus tard, la fermentation lactique . Dans ces fermentations, les étapes de réaction jusqu'à la formation de pyruvate sont identiques. En 1837, les chercheurs Charles Cagniard-Latour , Theodor Schwann et Friedrich Traugott Kützing ont indépendamment démontré que la dégradation du glucose en éthanol, connue aujourd'hui sous le nom de fermentation alcoolique , est causée par des êtres vivants, à savoir des levures . Le fait que les processus métaboliques des cellules de levure vivantes soient responsables de la dégradation anaérobie des sucres était encore très controversé à l'époque. Les éminents chimistes Jöns Jakob Berzelius , Friedrich Wöhler et Justus von Liebig étaient parmi les adversaires les plus violents de ce point de vue. Liebig a postulé, par exemple, que la matière en décomposition transfère des « vibrations » au sucre à fermenter, qui se décompose ensuite en éthanol et en dioxyde de carbone.
A partir de 1857, le chercheur français Louis Pasteur se consacre également à la dégradation des sucres dans les cellules vivantes de levure . En 1860, il publia une confirmation des résultats de Cagniard-Latour, Kützing et Schwann et s'opposa ainsi à l'hypothèse de Liebig. Il a également observé que la consommation de glucose est plus élevée dans des conditions anaérobies que lorsque l'oxygène est disponible pour la levure. Cette observation est connue aujourd'hui sous le nom d'« effet Pasteur ».
A cette époque, la doctrine dominante était que seule une « force vitale » (vis vitalis) inhérente aux êtres vivants pouvait convertir le glucose en éthanol. En 1858, d'autre part, Moritz Traube a suggéré que seuls les processus chimiques étaient responsables de la dégradation des sucres dans les cellules de levure, plutôt que la « vivacité » en tant que telle. En 1897, Eduard Buchner découvrit enfin que la fermentation alcoolique est également possible dans un extrait de levure acellulaire. Il a montré que la voie métabolique peut avoir lieu même si les cellules ne sont plus intactes. C'est ce qu'on appelle in vitro . Il a appelé la préparation catalytiquement active « zymase » sans savoir que plusieurs enzymes sont impliquées dans la dégradation anaérobie du glucose. Même Marie de Mannasein a avancé la même année dans une publication des conclusions similaires à celles de Buchner. Cependant, son travail n'a pas réussi à convaincre les autres parce que ses preuves étaient insuffisantes.

L'élucidation des différentes étapes de la glycolyse a réussi dès le début du 20e siècle. Arthur Harden et William John Young (1878-1942), décisifs dans la résolution de la voie glycolytique, ont pu contribuer et ont publié leurs découvertes dans une série de publications de 1905. Entre autres choses, ils ont découvert que la levure isolée extrait le glucose lentement en éthanol et en dioxyde de carbone. , si aucun phosphate inorganique n'était présent dans les extraits. Avec l'ajout de phosphate, cependant, cette réaction de fermentation , qui a eu lieu in vitro , c'est-à-dire sans cellules vivantes, pourrait à nouveau se dérouler plus rapidement. Ils ont également réussi à isoler le fructose-1,6-bisphosphate et à démontrer qu'il s'agit d'un produit intermédiaire de la glycolyse. Ils ont également séparé l'extrait de levure acellulaire en deux fractions par dialyse . Les chercheurs ont appelé la fraction non dialysable, qui sont généralement des molécules et des protéines plus grosses, selon Buchner, comme "zymase". Elle était sensible à la chaleur. La fraction dialysable, quant à elle, est constituée d'ions et de petites molécules qui peuvent traverser la membrane de dialyse. Celui-ci était thermiquement stable et s'appelait "Cozymase". Seuls les deux ensemble pourraient induire une réaction de fermentation in vitro . Il s'est avéré que la zymase était un mélange d'enzymes, tandis que la coenzymase contenait les coenzymes nécessaires à ces enzymes .
En 1918, Otto Meyerhof a pu prouver que les mêmes coenzymes sont nécessaires dans la fermentation lactique dans les muscles que dans la fermentation alcoolique. En raison de la courte durée de vie de nombreux produits intermédiaires, une élucidation plus poussée de la voie métabolique s'est avérée difficile. Gustav Embden a proposé la première séquence de réaction biochimique pour la glycolyse en 1932. Deux ans plus tard, Karl Lohmann a pu prouver dans le laboratoire de Meyerhof que le vecteur énergétique universel adénosine triphosphate (ATP) est produit lors de la glycolyse. Le groupe de recherche de Meyerhof a contribué à la découverte d'environ un tiers des enzymes impliquées dans la glycolyse.
Enfin, à la fin des années 1930, les travaux d' Otto Warburg et de Hans von Euler-Chelpin clarifient les étapes de réaction chez la levure ; Embden, Meyerhof et Jakub Karol Parnas , quant à eux, ont travaillé avec des cellules musculaires. De plus, Carl et Gerty Cori , Carl Neuberg , Robert Robinson et Erwin Negel, qui ont travaillé sous Warburg, ont joué un rôle important dans l'élucidation de la glycolyse.
Toutes les étapes et enzymes impliquées dans la glycolyse sont connues depuis les années 1940. Des études plus détaillées des enzymes impliquées et de leur régulation ont ensuite suivi.
Signification pour la cellule
La glycolyse est le moyen le plus important de décomposer les glucides dans le métabolisme. La plupart de tous les hexoses et trioses sont cette seule voie métabolisée et préparée pour une dégradation ultérieure. La glycolyse occupe ainsi une place centrale dans le métabolisme catabolique . Les enzymes impliquées dans les réactions se produisent dans presque tous les êtres vivants, de sorte que la glycolyse est également universelle. La glycolyse a également d'autres fonctions importantes :
Production d'énergie dans des conditions anaérobies
Dans la glycolyse, l'énergie est obtenue et fournie sous forme de deux molécules d'ATP par molécule de D- glucose dégradé , qu'il y ait ou non de l' oxygène pour la chaîne respiratoire . La glycolyse produit environ un quinzième autant d'ATP par molécule de D- glucose que la décomposition oxydative complète en dioxyde de carbone et en eau dans le cycle de l' acide citrique et dans la chaîne respiratoire. Par conséquent, moins de glucose est métabolisé en conditions aérobies, ce qui avait déjà été observé chez la levure par Louis Pasteur en 1861 ( effet Pasteur ).
Étant donné que la glycolyse a également lieu dans des conditions anoxiques , cela ouvre des possibilités bénéfiques dans le métabolisme. Par exemple, des micro - organismes peuvent ainsi gagner de l'énergie dans un environnement anoxique. Chez les vertébrés , lorsque les muscles sont fortement sollicités, l'oxygène est parfois consommé plus qu'il n'en est transporté dans les cellules. Pour cette raison, la cellule doit puiser son énergie exclusivement dans la glycolyse à court terme. C'est souvent le cas avec des animaux plus gros tels que les alligators , les crocodiles , les éléphants , les rhinocéros , les baleines et les phoques , où l'oxygène ne peut pas être fourni assez rapidement pour la décomposition oxydative du glucose. Chez l'homme également, le glucose est converti en lactate dans les cellules musculaires qui se contractent rapidement au cours de la glycolyse et de la fermentation lactique . Un grand avantage de la glycolyse est le fait que l'ATP peut être rendu disponible 100 fois plus rapidement que par phosphorylation oxydative dans la chaîne respiratoire.
Les plantes tirent leur énergie soit de la photosynthèse, soit de la chaîne respiratoire. Cependant, il existe également des situations dans lesquelles la lumière et l'oxygène sont temporairement indisponibles, par exemple lors de l' imbibition lors de la germination des graines ou lorsque les racines sont temporairement inondées d'eau. Dans ces conditions, le métabolisme local est maintenu par la glycolyse.
Le glucose comme seul carburant
Les cellules du cerveau doivent tirer la majeure partie de leur énergie de la glycolyse, certaines cellules spécialisées tirent même leur énergie exclusivement de la glycolyse. Cela inclut, par exemple, les cellules de la médullaire rénale , également les érythrocytes , qui manquent des mitochondries et donc de la chaîne respiratoire, et des spermatozoïdes . Après tout, cela inclut également les cellules tumorales à croissance et à division rapides . Otto Warburg a découvert en 1930 que les cellules tumorales ont un taux de glycolyse beaucoup plus élevé que les cellules saines. Dans la tomographie par émission de positons , cela est utilisé pour visualiser le tissu tumoral.
Blocs de construction pour le matériel cellulaire
La glycolyse prépare non seulement le glucose à la dégradation oxydative, mais fournit également des précurseurs pour la biosynthèse d'autres composés. Ainsi pyruvate matière première pour la synthèse des acides gras et, pour certains acides aminés ( L - alanine , L - valine et L - leucine ). Le glycérol-3-phosphate , qui joue un rôle dans la synthèse des lipides , est formé de manière réductrice à partir du dihydroxyacétone phosphate . Le phosphoénolpyruvate est la matière première de la biosynthèse des acides aminés aromatiques L - phénylalanine , L - tryptophane et L - tyrosine , tandis que la L - sérine est formée à partir de 3-phosphoglycérate .
Fourniture de NADH
En plus de l'ATP, la glycolyse produit également l' agent réducteur NADH. Celui-ci est soit réoxydé dans la chaîne respiratoire pour un gain supplémentaire d'ATP, soit utilisé comme agent réducteur pour la synthèse d'autres molécules - au moins à des fins de régénération du NAD + dans les fermentations .
Étapes de réaction
Localisation cellulaire
La glycolyse a lieu dans le cytoplasme d' une cellule . Dans les organismes multicellulaires tels que les humains, la glycolyse est réalisée dans tous les types cellulaires (différenciés). Les plantes effectuent également une glycolyse dans les plastes .
Aperçu général

Glu-6-P = glucose-6-phosphate
Fru-6-P = fructose-6-phosphate
Fru-1,6-bP = fructose-1,6-bisphosphate
DHAP = dihydroxyacétone phosphate
GAP = glycéraldéhyde-3-phosphate
1 , 3-bPG = 1,3-bisphosphoglycérate
3-PG = 3-phosphoglycérate
2-PG = 2-phosphoglycérate
PEP = phosphoénolpyruvate
Pyr = pyruvate
La dégradation du glucose en pyruvate s'effectue de la même manière à la fois dans des conditions de carence en oxygène ( anaérobie ) et avec un apport suffisant en oxygène ( aérobie ). Contrairement à la chaîne respiratoire, aucun oxygène (O 2 ) n'est consommé.
La glycolyse peut être divisée en deux phases. La première phase est une phase préparatoire dans laquelle l'énergie est d'abord investie sous forme d'ATP. Il consiste en la séparation de l' hexose D- glucose en deux trioses phosphates : le dihydroxyacétone phosphate (DHAP) et le glycéraldéhyde-3-phosphate (GAP) (voir figure). Ici DHAP est en CAP pour la deuxième phase d' isomérisation . Cela prépare le sucre à la décomposition réelle.
Dans la deuxième phase, deux molécules de GAP sont converties en deux molécules de pyruvate (Pyr) via plusieurs étapes intermédiaires. Deux molécules de NADH et quatre molécules d'ATP sont formées dans le processus. Cette phase fournit de l'énergie sous forme de 4 ATP et 2 équivalents de réduction NADH.
Le bilan total de la glycolyse peut ainsi être formulé comme suit :
Phase préparatoire
La première étape de la glycolyse est la phosphorylation du D- glucose (Glc) en glucose-6-phosphate (G6P). Selon le type cellulaire, cette réaction est une hexokinase ou une glucokinase (hexokinase IV) catalyse , dans laquelle une molécule d'ATP est investie. Cela présente deux avantages : D'une part, la membrane cellulaire est perméable au glucose en raison des canaux de glucose (par exemple GLUT-1 ) qui y sont présents , mais pas au glucose-6-phosphate produit par la phosphorylation. En conséquence, il s'accumule dans la cellule. D'autre part, la phosphorylation du glucose réduit la concentration de glucose dans la cellule, tandis que la concentration de G6P augmente en sens inverse. La phosphorylation initiale a pour effet qu'il y a moins de glucose à l'intérieur de la cellule qu'à l'extérieur de la cellule. Étant donné que la concentration de glucose intracellulaire est donc en déséquilibre par rapport à la concentration extracellulaire, du glucose supplémentaire s'écoule le long de ce gradient de concentration résultant à travers les canaux de glucose de la cellule. De ce fait, l'absorption du glucose est favorisée.
Chez les bactéries, la phosphorylation dans la première étape de la glycolyse n'est pas catalysée par les hexo- ou les glucokinases mais par le système sucre- phosphotransférase dépendant du phosphoénolpyruvate (PEP) .
Le glucose-6-phosphate est ensuite converti en fructose-6-phosphate isomère (F6P) par la glucose-6-phosphate isomérase . L'enzyme préfère la liaison de l'anomère alpha de G6P, le produit de réaction est le α- D -fructose-6-phosphate. Dans des conditions standard, l'équilibre de la réaction d'isomérisation est du côté du G6P. Mais comme le F6P continue à réagir rapidement, il est retiré du système réactionnel, de sorte qu'aucun équilibre ne s'établit et que la réaction d'isomérisation se déroule en faveur du F6P.
 |
ATP ADP hexokinase ou glucokinase |
 |
Glucose -6-phosphate isomérase  |

|
| α- D - glucose | α- D - glucose-6-phosphate | α- D - fructose-6-phosphate |
Le fructose-6-phosphate est alors sous l'action de la première enzyme clé de la glycolyse, la phosphofructokinase 1 , phosphorylée avec une molécule d'ATP en fructose-1,6-bisphosphate (F1,6bP), par laquelle l'ADP est formé. L'enzyme préfère l'anomère bêta de F6P, alors que l'anomère alpha s'est formé dans la pré-réaction. Cependant, ce n'est pas un problème puisque les deux anomères sont en équilibre ( mutrotation ). Chez les bactéries anaérobies, certaines plantes, les eucaryotes primitifs et certaines archées, cette étape est catalysée par une phosphofructokinase dépendante du pyrophosphate (EC 2.7.1.90), dans laquelle le pyrophosphate (PP i , de l'anglais pyrophosphate, inorganique ) est utilisé à la place de l'ATP.
 |
ATP ADP phospho fructo kinase |

|
| β- D -fructose-6-phosphate | β- D - fructose-1,6-bisphosphate |
L'investissement renouvelé en énergie est bon marché et nécessaire pour deux raisons : D'une part, cette étape - en plus de la glucokinase et de la pyruvate kinase - rend la glycolyse irréversible dans des conditions physiologiques. D'autre part, l'énergie fournie ici permet le clivage de l'hexose à l'étape suivante et ainsi la formation de deux trioses phosphorylées pour une dégradation ultérieure, le dihydroxyacétone phosphate (DHAP) et le glycéraldéhyde-3-phosphate (GAP). Les atomes de carbone C1-C3 de F1,6bP se trouvent dans DHAP, tandis que les atomes C de GAP proviennent de l'unité C4-C6 de F1,6bP.
La réaction de clivage est très défavorable dans les conditions standards (ΔG 0 ' = +24 kJ/mol) et n'aurait pas lieu. En raison du métabolisme rapide des deux produits de réaction, cependant, il a lieu presque à l'équilibre dans des conditions physiologiques. Le phosphate de dihydroxyacétone est converti en D -glycéraldéhyde-3-phosphate par la triosephosphate isomérase (TIM) . Cette isomérisation stéréospécifique dans la direction du GAP est favorisée par le fait que le GAP est encore décomposé dans la glycolyse et ainsi la concentration dans la cellule est maintenue faible. Sans métabolisme supplémentaire, l'équilibre entre DHAP et GAP serait fortement du côté de la cétone, c'est-à-dire DHAP (22 : 1).
 |
Aldolase |
 |
Triose phosphate isomérase  |

|
| β- D -fructose-1,6-bisphosphate | Dihydroxy acétone phosphate |
D - glycérol aldéhyde 3-phosphate |
Phase d'amortissement
Chacune des deux molécules de glycéraldéhyde-3-phosphate résultantes est oxydée au début de la phase d'amortissement de la glycolyse par une glycéraldéhyde-3-phosphate déshydrogénase (GAPDH). Dans la réaction, le NAD + est réduit en NADH. L'oxydation du groupe aldéhyde (GAP) en groupe carboxy est énergétiquement très favorable. Il est utilisé pour lier le phosphate inorganique au groupe carboxy. Cela crée l' anhydride d'acide mixte 1,3-bisphosphoglycérate (1,3-BPG). L'équilibre de cette réaction est du côté de l'éduit GAP versus 1,3-BPG (10 : 1). Cependant, la conversion rapide du produit empêche l'établissement de l'équilibre et le 1,3-BPG se forme en permanence, et une concentration élevée de NAD + par rapport au NADH favorise la conversion dans un sens.
Une voie alternative dans les érythrocytes , du 1,3-bisphosphoglycérate au 3-phosphoglycérate, est le cycle de Rapoport-Luebering , qui passe par l' intermédiaire 2,3-bisphosphoglycérate et dont l'enzyme centrale est la bisphosphoglycérate mutase trifonctionnelle .
 |
NAD + NADH + Pi + H + glycéraldéhyde -3 phosphate déshydrogénase  |

|
| D -glycéraldéhyde-3-phosphate | D - 1,3-bisphosphoglycérate |
Dans l'étape suivante, la phosphoglycérate kinase génère une molécule d'ATP lors de la conversion du 1,3-bisphosphoglycérate en 3-phosphoglycérate en transférant un résidu phosphate à l'ADP. L'énergie libérée lors de l'oxydation précédente est ainsi conservée par accumulation d'ATP. La formation d'ATP à partir d'ADP qui a lieu ici est un exemple de phosphorylation de chaîne de substrat . Si la cellule a déjà beaucoup d'ATP (et donc peu d'ADP), la réaction se poursuit à ce stade jusqu'à ce que suffisamment d'ADP soit à nouveau disponible. Cette régulation par rétroaction est importante car l'ATP se décompose relativement rapidement lorsqu'il n'est pas utilisé. Cela empêche la surproduction d'ATP.
Le bilan énergétique de la glycolyse est équilibré dans cette étape : deux molécules d'ATP ont été utilisées et deux ont été récupérées
 |
Phospho glycérate kinase ADP ATP 
|

|
| D -1,3-bisphosphoglycérate | D - 3-phosphoglycérate |
Une phosphoglycérate mutase (PGM) indépendante du cofacteur catalyse ensuite la conversion du 3-phosphoglycérate en 2-phosphoglycérate. Au cours du processus, le groupe phosphate est temporairement transféré à un résidu d'acide aminé de l'enzyme. Dans les érythrocytes, cette réaction est catalysée par un PGM cofacteur-dépendant dans lequel le 2,3-bisphosphoglycérate est formé comme produit intermédiaire.
Le 2-phosphoglycérate est ensuite déshydraté en phosphoénolpyruvate (PEP) à l'aide d' énolase . C'est pourquoi l'enzyme est également appelée 2-phosphoglycérate déshydratase. Le PEP est un composé phosphorylé avec un potentiel de transfert de groupe très élevé . Ceci est utilisé dans la dernière étape de la glycolyse pour gagner une autre molécule d'ATP. Ici, une pyruvate kinase (PK) catalyse la conversion de PEP en pyruvate (= anion d'acide pyruvique) avec gain d'ATP. Cependant, cela ne conduit pas directement au pyruvate, mais plutôt à l'énolpyruvate à l'équilibre. A pH 7, l'équilibre est du côté de la forme cétonique. Cette étape est également régulée par l'ADP, c'est la troisième réaction irréversible au cours de la glycolyse.
 |
Phospho glycérate mutase 
|
 |
-H 2 O énolase  |
 |
ADP ATP pyruvate kinase |
|
| D -3-phosphoglycérate | D - 2-phosphoglycérate | Phosphoénolpyruvate | Pyruvate |
S'il y a un manque de phosphate, les plantes peuvent hydrolyser le PEP en pyruvate sans gagner d'ATP, qui a lieu dans les vacuoles . L'enzyme impliquée est une PEP phosphatase (EC 3.1.3.60), qui libère du phosphate inorganique et contrecarre ainsi la carence en phosphate.
Régénération du cofacteur NAD +
Dans la glycolyse, deux molécules de NAD + sont réduites en NADH par cycle. La plupart du temps, la concentration cellulaire en NAD + est très faible, de sorte qu'il s'épuiserait rapidement sans réoxydation. En conséquence, le NAD + doit être régénéré, sinon la glycolyse s'arrêtera. Comment cela se produit dépend de si les conditions sont anoxiques ou oxiques . De plus, cela influence le chemin de dégradation ultérieur du pyruvate.
Conditions oxiques
Dans des conditions oxiques, le pyruvate est décarboxylé par oxydation dans le complexe pyruvate déshydrogénase en acétyl-CoA . Cela crée une molécule de dioxyde de carbone et une molécule de NADH. L'acétyl-CoA entre alors dans le cycle de l' acide citrique dans lequel il est complètement oxydé en deux molécules de dioxyde de carbone. Des molécules de NADH supplémentaires sont formées au cours de ces étapes d'oxydation. Ceux-ci et ceux issus de la glycolyse sont finalement réoxydés au cours de la chaîne respiratoire avec la consommation d'oxygène, de sorte que le NAD + est à nouveau disponible pour la glycolyse et le cycle de l' acide citrique. Dans le même temps, d'autres molécules d'ATP sont formées au cours de ces étapes. Alors que les procaryotes peuvent produire au total 38 molécules d'ATP par molécule de glucose, l'équilibre chez les eucaryotes dépend de la façon dont le NADH formé dans le cytosol traverse la membrane mitochondriale ( navette malate-aspartate ou navette glycérol-3-phosphate ).
Chez les eucaryotes, le cycle de l'acide citrique se déroule dans la matrice de la mitochondrie , tandis que la glycolyse se déroule dans le cytosol. NAD + et NADH ne peuvent pas diffuser librement à travers la membrane interne de la mitochondrie, et des translocateurs spéciaux sont manquants . L'échange de NAD + et de NADH s'effectue donc soit par la navette malate-aspartate soit par la navette glycérol-3-phosphate.
Dans la littérature, la glycolyse et la décomposition subséquente du pyruvate en dioxyde de carbone par les processus du cycle de l'acide citrique et de la chaîne respiratoire sont parfois mal résumées comme de la glycolyse aérobie . Cependant, la glycolyse se termine par la formation de pyruvate et se déroule à la fois dans des conditions oxiques et anoxiques.
Conditions anoxiques
→ voir aussi des articles principaux fermentation alcoolique , fermentation acide lactique
Si l'oxygène n'est pas disponible ou seulement dans une mesure limitée, le pyruvate peut être converti davantage de manière réductrice, par exemple en fermentation lactique ou en fermentation alcoolique . En fermentation lactique, le pyruvate est réduit en L - lactate avec du NADH , en fermentation alcoolique il est décarboxylé et réduit en éthanol . Dans les deux cas, le NADH est oxydé en NAD + et est disponible pour d'autres cycles de glycolyse. Contrairement à la voie de dégradation aérobie, aucun ATP n'est formé dans ces étapes de fermentation .
En fermentation alcoolique, les levures forment de l'éthanol à partir du pyruvate en deux étapes réactionnelles qui sont catalysées par deux enzymes, la pyruvate décarboxylase (EC 4.1.1.1) et l' alcool déshydrogénase . Le NADH produit par glycolyse est oxydé en NAD + . Les bactéries, par exemple les bactéries lactiques, ainsi que les cellules musculaires chez l'homme, opèrent la fermentation lactique (voir également la figure à droite). Ici, le pyruvate est réduit en lactate par la lactate déshydrogénase à l' aide de NADH, de sorte que la glycolyse peut se poursuivre. Cette réaction est fortement exergonique aussi bien dans les conditions standards que dans les conditions physiologiques (ΔG 0 ′ = -25 kJ/mol ou ΔG = -14,8 kJ/mol).
La fermentation lactique (homofermentative) est parfois appelée glycolyse anaérobie . Cependant, cela est trompeur car la glycolyse se termine par la formation de pyruvate et se déroule à la fois dans des conditions oxiques et anoxiques.
Étant donné que la glycolyse a lieu dans le cytosol des cellules, elle peut également avoir lieu dans des cellules sans mitochondries. Ici, cependant, le NADH ne peut pas être oxydé en NAD + par le cycle de l' acide citrique et la chaîne respiratoire , mais sans consommation d'oxygène en réduisant le pyruvate en lactate, catalysé par la lactate déshydrogénase. Ainsi, lorsqu'une molécule de glucose est décomposée, seules deux molécules d'ATP sont produites dans les érythrocytes, qui répondent pourtant aux besoins de ces cellules.
Aspect énergétique
Position d'équilibre
| marcher | Réaction dans la glycolyse | G 0 ' [kJ/mol] | G [kJ / mol] |
|---|---|---|---|
| 1 | Glucose + ATP → glucose-6-P + ADP | -16,7 | −33,9 |
| 2 | Glucose-6-P fructose-6-P | +1.7 | -2.9 |
| 3 | Fructose-6-P + ATP → Fructose-1,6-bP + ADP | -14.2 | -18,8 |
| 4e | Fructose-1,6-bP DHAP + G-3-P | +23,9 | -0,2 |
| 5 | DHAP ⇌ GAP | +7,6 | +2,4 |
| 6e | GAP + P i + NAD + ⇌ 1,3-bis-P-glycérate + NADH + H + | +6.3 | -1,3 |
| 7e | 1,3-bis-P-glycérate + ADP ⇌ 3-P-glycérate + ATP | -18,9 | +0.1 |
| 8e | 3-phosphoglycérate ⇌ 2-phosphoglycérate | +4.4 | +0,8 |
| 9 | 2-P-glycérate PEP + H 2 O | +7,5 et +1,8, respectivement | +1,1 |
| dix | PEP + ADP → pyruvate + ATP | −31,7 | −23,0 |
La plupart des réactions de glycolyse sont énergétiquement défavorables dans des conditions standard à un pH de 7. L'évolution de l' enthalpie libre G 0 ' est souvent positive, de sorte que ces réactions sont endergoniques et n'auraient pas lieu (voir tableau des valeurs ΔG 0 '). La glycolyse se terminerait à la quatrième étape.
| Métabolite | Concentration [mM] |
|---|---|
| glucose | 5.0 |
| Glucose-6-P | 0,083 |
| Fructose-6-P | 0,014 |
| Fructose-1,6-bP | 0,031 |
| DHAP | 0,140 |
| Casquette | 0,019 |
| 1,3-bis-P-glycérate | 0,001 |
| 3-PG | 0,120 |
| 2-PG | 0,030 |
| DYNAMISME | 0,023 |
| Pyruvate | 0,051 |
| P je | 0,001 |
Par définition, la concentration molaire des réactifs correspond à 1 mol.l -1 dans de telles conditions . Cependant, cela ne peut pas être utilisé comme base de calcul, car les cellules vivantes ne peuvent pas générer ou maintenir des concentrations aussi élevées. Pour une évaluation significative, en revanche, il faudrait connaître les concentrations réelles de la substance. Si celle-ci est mesurée dans des conditions physiologiques , la variation de l'enthalpie libre G peut être recalculée (voir tableau valeurs ΔG, concentration en métabolites).
Les érythrocytes sont particulièrement adaptés au calcul de ces valeurs. Les érythrocytes tirent toute leur énergie de la glycolyse. Toutes les autres réactions cellulaires ont également lieu dans le cytoplasme, puisqu'elles n'ont ni mitochondries , ni noyau cellulaire, ni réticulum endoplasmique . Cela facilite également la séparation des composants de la cellule. Sans mitochondries, il n'y a pas de réactions de la chaîne respiratoire ou du cycle de l'acide citrique . Une quantification des coenzymes impliquées serait autrement considérablement plus difficile. Après tout, la voie des pentoses phosphates ne prend qu'une petite part dans le métabolisme des érythrocytes, il n'y a pas non plus de biosynthèse de protéines ou de lipides. Cela permet aux intermédiaires glycolytiques d'être facilement isolés et déterminés.
En 1965, les concentrations de la substance (à l' état d'équilibre ) des intermédiaires glycolytiques ont été déterminées à partir d'érythrocytes humains (voir tableau à droite). Il a été constaté que certains intermédiaires sont présents à de très faibles concentrations. Compte tenu de ces concentrations, la position d'équilibre des réactions correspondantes change de telle sorte que, dans des conditions physiologiques, toute la glycolyse est réversible à l'exception de trois réactions (ΔG environ 0 kJ · mol -1 ).
Dans ces réactions, la concentration molaire reste si faible car les produits générés sont rapidement convertis puis éliminés du système par des réactions irréversibles. Ces trois réactions irréversibles sont catalysées par les enzymes clés glucokinase ou hexokinase, phosphofructokinase 1 et pyruvate kinase. En raison de la conversion rapide et irréversible à l'aide de l'une des enzymes clés, les concentrations de substances des produits générés précédemment sont suffisamment réduites - la glycolyse peut se dérouler dans une direction.
Lors du calcul de la position d'équilibre dans des conditions physiologiques, des valeurs de ΔG faibles mais positives entraînent certaines réactions, par exemple l'isomérisation du 3-phosphoglycérate en 2-phosphoglycérate (ΔG = +1,1 kJ mol -1 ). À proprement parler, ces valeurs ne peuvent pas être entièrement correctes, car la réaction directe ne peut avoir lieu qu'avec des valeurs ΔG négatives. Cependant, étant donné que la glycolyse a lieu, on suppose que les erreurs de mesure dans la détermination des concentrations de substance sont responsables de cette contradiction.
Il y a deux conséquences à avoir trois points de contrôle. Premièrement, la glycolyse peut être régulée efficacement à ces points afin qu'elle puisse être activée ou désactivée rapidement en fonction de l'état énergétique de la cellule. Deuxièmement, l'équilibre actuel permet également la réaction inverse de la glycolyse, la gluconéogenèse . À l'exception de trois enzymes, toutes les enzymes de glycolyse sont utilisées.
Efficacité
Dans des conditions standard , la conversion du D- glucose en deux molécules de lactate libère 183,6 kJ/mol d'énergie (ΔG 0 '= −183,6 kJ/mol) :
Pour construire deux molécules d'ATP à partir de deux molécules d'ADP et de phosphate inorganique (P i ) chacune, 61,0 kJ/mol sont nécessaires :
Puisque la glycolyse couple ces deux réactions par phosphorylation de la chaîne du substrat, une énergie de 122,6 kJ/mol est libérée :
G 0 '= (−183,6 + 61) kJ mol −1 = −122,6 kJ mol −1
Dans des conditions standard, lorsque le glucose est décomposé en lactate par voie anaérobie, 33 % de l'énergie disponible est utilisée pour construire deux molécules d'ATP. Étant donné que dans des conditions physiologiques, environ 50 kJ mol -1 sont nécessaires pour l'accumulation d'ATP, le rendement énergétique est également un peu plus élevé, autour de 50 %.
régulation
La glycolyse est utilisée pour fournir de l'énergie, surtout si le pyruvate résultant est encore décomposé dans des conditions aérobies. Si, par contre, il existe un état énergétiquement favorable, le glucose est stocké et converti en d'autres métabolites au cours de l'anabolisme avec consommation d'énergie.
La régulation de la glycolyse est donc d'une importance cruciale. Par exemple, il ne doit pas se dérouler parallèlement à leur réaction inverse, la néoglucogenèse . Dans un tel cas, on parle d'un " processus inactif ", qui utilise insensé l'ATP et est donc improductif. À titre d'exception, il convient de mentionner la génération de chaleur chez les bourdons , qui génèrent de la chaleur par phosphorylation et déphosphorylation intentionnelles et contrarotatives du fructose-6-phosphate en fructose-1,6-bisphosphate et vice versa.
D'un point de vue biochimique, les réactions irréversibles sont contrôlées. Dans des conditions physiologiques, il existe trois réactions de la glycolyse qui sont irréversibles. Ils sont catalysés par l'hexo- ou la glucokinase, la phosphofructokinase-1 et la pyruvate kinase et sont donc la cible d'une régulation.
Hexo- et glucokinase
L'hexokinase est la première enzyme de la glycolyse dont l'activité est régulée. Il phosphoryle le glucose en glucose-6-phosphate (G6P) tout en consommant de l'ATP, mais peut également utiliser d'autres hexoses comme substrat. Le G6P est le produit final de la réaction de l'hexokinase et, en tant que tel, inhibe allostériquement l'enzyme .
L'isoenzyme de l'hexokinase, la glucokinase, présente dans le foie, n'est pas inhibée par le produit G6P. Contrairement à l'hexokinase, elle présente également une valeur K M plus élevée. Par conséquent, la glucokinase ne remplace l'hexokinase qu'à des concentrations de glucose très élevées. Dans ces conditions, le G6P est stocké sous forme de glycogène dans les étapes suivantes et n'est pas décomposé lors de la glycolyse, car le G6P est également détourné pour d'autres voies métaboliques. Le foie agit donc comme un homéostat du taux de sucre dans le sang , car il le maintient en accumulant ou en décomposant le glucose.
Une protéine régulatrice spécifique du foie peut se lier de manière réversible à la glucokinase et ainsi l'inhiber. La liaison de ce régulateur à la glucokinase a lieu dans le noyau cellulaire , de sorte que la glucokinase inhibée y reste inactive et ne peut pas être influencée par d'autres effecteurs cytosoliques. Cette liaison est alors renforcée si l'enzyme a été modifiée allostériquement par le fructose-6-phosphate. En revanche, le glucose provoque le détachement de cette protéine du foie. Lorsque la concentration de sucre dans le sang est élevée, le glucose domine de sorte que le régulateur peut se dissocier et le glucose est phosphorylé en glucose-6-phosphate. Cependant, si le taux de sucre dans le sang baisse trop (en dessous de 5 mmol·l -1 ), la glucokinase est inhibée - médiée par le fructose-6-phosphate. Le glucose n'est plus phosphorylé et peut à nouveau quitter le foie pour être disponible pour d'autres organes.
Enfin, la glucokinase est régulée au niveau de la transcription . L' hormone insuline influence la quantité de glucokinase dans le foie. Un trouble métabolique survient chez les patients atteints de diabète sucré, car ils ne peuvent pas produire suffisamment d'insuline. Ils ont des niveaux trop bas de glucokinase, ne tolèrent pas des niveaux élevés de sucre dans le sang et ont peu de glucokinase dans le foie.
Phosphofructokinase-1
Le principal point de contrôle de la glycolyse est la phosphorylation de Frc-6-P en Frc-1,6-bP par la phosphofructokinase-1 (PFK-1). Elle représente la première véritable étape spécifique de la glycolyse et est irréversible dans des conditions physiologiques. L'enzyme a deux sites de liaison pour l'ATP. En plus d'un site de liaison au substrat de haute affinité, le PFK-1 possède également un site de liaison régulateur. Ainsi, l'ATP peut servir à la fois de substrat et d'inhibition allostérique de PFK-1. Si les concentrations d'ATP sont suffisamment élevées, la valeur K M de l'enzyme est augmentée. Cela diminue l'activité du PFK-1, de sorte que la glycolyse est réduite. Néanmoins, les concentrations d'ATP dans une cellule ne fluctuent que légèrement, de sorte que l'ATP seul ne serait pas suffisant pour une régulation précise. L'activité du PFK-1 dépend donc également de la concentration en AMP et reflète l'apport énergétique à la cellule. L'AMP agit comme un activateur allostérique et non covalent. Si l'état énergétique de la cellule est élevé (concentration d'ATP élevée, concentration d'AMP faible), l'enzyme est inhibée, sinon l'activité du PFK-1 est augmentée pour produire plus d'ATP.
Même le citrate inhibe le PFK-1 allostérique. Le citrate est un métabolite clé du cycle de l'acide citrique , dont le but principal est de produire de l'énergie dans des conditions aérobies. Alternativement, diverses molécules précurseurs peuvent être extraites du cycle de l'acide citrique. S'il y a beaucoup de citrate, le cycle de l'acide citrique est saturé. Par conséquent, le citrate inhibe le PFK-1 au sens d'une inhibition du produit final, de sorte que la glycolyse alimente moins fortement le cycle de l'acide citrique.
L'activité de la phosphofructokinase-1 est également influencée par la valeur du pH . Un pH bas inhibe l'enzyme et ralentit la glycolyse. Cela se produit, par exemple, lorsque les muscles sont tendus et que beaucoup d'acide lactique est produit. Cela abaisse la valeur du pH dans les cellules.
Enfin, PFK-1 est activé allostériquement en concentrations micromolaires par le β- D -fructose-2,6-bisphosphate (F-2,6-bP). Le F-2,6-bP favorise la glycolyse tout en inhibant la fructose-1,6-bisphosphatase . C'est l'enzyme qui catalyse la réaction inverse de la néoglucogenèse à ce stade . Dans des conditions physiologiques, l'enzyme reste dans un état pratiquement inactif sans F-2,6-bP. Après liaison de F-2,6-bP à PFK-1, l'affinité des deux inhibiteurs ATP et citrate est également réduite.
Chez les bactéries, le fructose-2,6-bisphosphate n'est pas trouvé comme activateur de PFK-1.
Pyruvate kinase
La dernière étape de la glycolyse est irréversible et est catalysée par la pyruvate kinase (PK). Ceci est également régulé, mais contrairement aux deux autres enzymes d'une manière relativement subordonnée. Le fructose-1,6-bisphosphate et l'AMP stimulent la PK, tandis que l'ATP, l' acétyl-CoA et la L - alanine l' inhibent allostériquement. L'isoenzyme (forme L) qui prédomine dans le foie et les intestins peut, contrairement à la forme M qui se produit dans les muscles, également être phosphorylée par la protéine kinase A. L'activité de la protéine kinase A est médiée hormonalement par le glucagon . Sous la forme phosphorylée, cette isoenzyme est alors inhibée comparativement plus fortement par l'ATP et l'alanine que la PK non modifiée. Ceci est censé ralentir la dégradation du glucose dans le foie afin qu'il soit plus facilement disponible pour d'autres organes. La déphosphorylation est catalysée par une phosphatase .
Inhibiteurs
L'énolase est inhibée par le fluorure . L'acétate d'iode inhibe la glycéraldéhyde-3-phosphate déshydrogénase, qui oxyde la glycéraldéhyde-3-phosphate avec un phosphate inorganique et avec la participation de NAD + pour former du 1,3-bisphosphoglycérate. Il modifie un groupe SH de l'enzyme, cette inhibition peut donc être à nouveau levée en ajoutant des mercaptans .
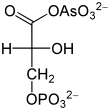
L'arséniate , HAsO 4 2− , est similaire au phosphate inorganique HPO 4 2− et est converti à sa place par la glycéraldéhyde-3-phosphate déshydrogénase. Cela crée du 1-arséno-3-phosphoglycérate à partir du glycéraldéhyde-3-phosphate (voir figure). Contrairement au 1,3-bisphosphoglycérate, ce composé d'arséniate, comme tout autre arséniate d'acyle, est très instable ; il se décompose en 3-phosphoglycérate. En conséquence, l'énergie d'oxydation ne peut plus être exploitée par la phosphorylation de la chaîne du substrat. Il n'y a plus d'étape dans la formation d'ATP dans la glycolyse, qui continue à avoir lieu, mais ne fournit plus d'ATP net. Comme l'arséniate n'est pas consommé, il fonctionne déjà en quantités catalytiques. Harden et Young ont démontré l'effet de l'arséniate sur la glycolyse au début du 20e siècle en utilisant des extraits de levure.
pathologie
En raison du rôle central de la glycolyse dans le métabolisme, les défauts se manifestent relativement rarement, car les cellules affectées meurent dans la plupart des cas. Par conséquent, seules quelques maladies et mutations de la glycolyse sont connues.
Les plus connus sont les défauts de la pyruvate kinase qui conduisent à une anémie hémolytique . Si la pyruvate kinase échoue, aucun ATP n'est produit dans la dernière étape de la glycolyse, de sorte que les cellules sanguines ne peuvent pas fournir suffisamment d'énergie pour faire fonctionner les pompes à ions dans la membrane cytoplasmique . Cela provoque le gonflement et l'éclatement des globules rouges. Si l'activité de la triose phosphate isomérase est réduite par une mutation, cela conduit à ce que l'on appelle le déficit en triose phosphate isomérase . Elle conduit à des dommages neurologiques et aussi à une anémie hémolytique, souvent aussi à la mort. Une carence en phosphofructokinase conduit à la maladie de Tarui , qui se traduit par une faiblesse musculaire dépendante de l' exercice avec des douleurs musculaires et une anémie hémolytique.
Entrée d'autres métabolites
En plus du D- glucose, d'autres métabolites peuvent également apparaître dans la glycolyse, à condition qu'ils puissent être convertis en l'un des produits intermédiaires qui s'y trouvent. Les pentoses et les tétroses sont généralement convertis en glycéraldéhyde-3-phosphate ou fructose-6-phosphate par la voie des pentoses phosphates et peuvent ensuite être convertis davantage.
Les voies de dégradation des di- ou polysaccharides conduisent également à la glycolyse. Par exemple, le saccharose est divisé en glucose et fructose. La façon dont le fructose est davantage converti est décrite ci-dessous. Lorsque le lactose est décomposé , du D- glucose et du D - galactose sont produits , ce dernier est également transformé en glucose et est décomposé en glycolyse.
Les monosaccharides individuels sont formés à partir de sucres multiples par des réactions enzymatiques qui, si nécessaire après isomérisation en glucose-6-phosphate ou fructose-6-phosphate, peuvent s'écouler directement dans la voie de dégradation glycolytique. Un exemple bien connu est la substance de stockage glycogène . Une glycogène phosphorylase le transforme en glucose -1-phosphate , qui est ensuite isomérisé en glucose-6-phosphate.
glycérine
La glycérine est produite lors de la décomposition des triglycérides et peut servir de précurseur à la glycolyse ou à la néoglucogenèse. Une glycérol kinase cytosolique phosphoryle le glycérol tout en consommant de l'ATP en glycérol-3-phosphate , qui est ensuite oxydé en dihydroxyacétone phosphate. Ceci est soit catalysé par une glycérol-3-phosphate déshydrogénase cytosolique (cGDH) soit par une isoenzyme dans la membrane de la mitochondrie (mGDH). Le premier réduit le NAD + , le second réduit l' ubiquinone .
Fructose
Lorsque le saccharose disaccharidique est décomposé, du glucose et du fructose sont libérés. Chez les animaux supérieurs, le fructose est phosphorylé en fructose-1-phosphate dans le foie , qui est catalysé par une fructokinase ( cétohexokinase , FK) avec consommation d'ATP. Ensuite, l' aldolase B (fructose-1-phosphate aldolase, ALD-B) divise le fructose-1-phosphate en phosphate de dihydroxyacétone (DHAP) et en glycéraldéhyde . Le DHAP et le glycéraldéhyde sont tous deux convertis en glycéraldéhyde-3-phosphate. Ces deux conversions sont catalysées par une triose phosphate isomérase (TPI) ou une triose kinase (TK) décrites ci-dessus avec consommation d'ATP. Si la fructokinase est absente, cela conduit à la fructosurie , une maladie héréditaire autosomique récessive, chez les animaux supérieurs .
Dans d'autres organes, l'hexokinase peut également prendre le relais de la fructokinase afin de phosphoryler le fructose. Leur affinité pour le glucose par rapport au fructose est beaucoup plus élevée (95% glucose, 5% fructose).
Mannequin
Le D - mannose est un composant de diverses glycoprotéines et polysaccharides . Afin de pouvoir entrer dans la glycolyse, le mannose est d'abord phosphorylé par une hexokinase en mannose-6-phosphate avec consommation d'ATP. Celui-ci est finalement isomérisé en fructose-6-phosphate , qui est catalysé par la mannose-6-phosphate isomérase (également phosphomannose isomérase , EC 5.3.1.8).
Sorbitol
Le sorbitol peut être oxydé en glucose ou en fructose par la voie polyol .
galactose
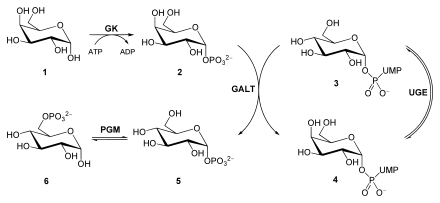
Lorsque le lactose est décomposé , le D- glucose et le D- galactose sont libérés. Afin de convertir le galactose en son épimère C4 glucose, le sucre est d'abord converti en galactose-1-phosphate par une galactokinase (GK) à l'aide d'ATP . Une galactose-1-phosphate uridyl transférase (GALT) catalyse désormais un échange de glucose lié à l' UDP avec le galactose. Cela produit du glucose-1-phosphate et de l' UDP-galactose . Alors que le glucose-1-phosphate est isomérisé en glucose-6- phosphate par une phosphoglucomutase (PGM), une UDP-glucose-4-épimérase (UGE) épimérise l' UDP-galactose en UDP-glucose .
Un défaut de la galactokinase se manifeste dans la galactosémie, une maladie métabolique .
Particularités des plantes vertes
Chez les plantes vertes, il existe des variations de glycolyse par rapport à celle des animaux. Ceux-ci sont décrits ci-dessous.
Glycolyse dans les plastes
On sait que chez les plantes la glycolyse s'effectue indépendamment les unes des autres non seulement dans le cytoplasme, mais aussi dans les plastes de la cellule. Cependant, il ne s'y déroule pas toujours complètement, car les enzymes de la phase d'amortissement font souvent défaut, par exemple l'énolase ou la phosphoglycérate mutase. Des translocateurs hautement spécifiques peuvent transporter des intermédiaires d'un compartiment cellulaire à un autre afin de compléter toutes les étapes de la réaction de glycolyse. Dans le cytosol de nombreuses algues vertes unicellulaires , les enzymes cytosoliques pour la glycolyse manquent, de sorte que cela se passe complètement dans les chloroplastes.
Les plantes vertes utilisent la glycolyse dans les plastes pour décomposer l'amidon en pyruvate dans l'obscurité ou dans les tissus non photosynthétiques avec un gain en ATP et NADH. Ils fournissent également diverses molécules précurseurs pour la construction d'autres produits, par exemple pour la synthèse d'acides gras.
Les isoenzymes sont nécessaires au fonctionnement parallèle de la glycolyse à la fois dans le cytoplasme et dans les plastes . Par exemple, il existe une pyruvate kinase située dans le cytoplasme et une autre qui catalyse la réaction analogue dans le plaste. Toutes les isoenzymes sont codées dans le génome de la plante. Les représentants des plastes sont traduits dans le cytoplasme de la cellule végétale puis transportés dans l' organite . On ne sait toujours pas si les isoenzymes résultent de la duplication d'un gène à partir d'un gène précurseur. Le transfert horizontal de gènes à partir du génome d'un symbiote procaryote ( théorie des endosymbiotes ) serait également possible .
Rôle du pyrophosphate
Une autre particularité est l'utilisation du pyrophosphate (PP i ) à la place de l'ATP comme donneur de phosphate dans les premières réactions glycolytiques. Cela a également été observé chez certaines bactéries. Normalement, le pyrophosphate est hydrolysé en deux molécules de phosphate par une pyrophosphatase (PPiase, EC 3.6.1.1). Le but de cette hydrolyse est de rendre les réactions biochimiques irréversibles dans des conditions physiologiques. On dit familièrement que cette hydrolyse « tire » la réaction de côté. L'explication en est que l'hydrolyse est exergonique, c'est-à-dire que de l'énergie est libérée au cours du processus :
La PPiase ne se produit pas dans le cytosol des plantes, de sorte qu'une concentration en pyrophosphate allant jusqu'à 0,3 mmol / l peut y apparaître. La phosphofructokinase dépendante du pyrophosphate (PFP, EC 2.7.1.90), découverte en 1979, utilise le pyrophosphate pour la phosphorylation du fructose-6-phosphate en fructose-1,6-bisphosphate. Cette réaction est également réversible et pourrait également être utilisée pour la voie inverse, la gluconéogenèse. Comme le PFK-1, le PFP est régulé par le fructose-2,6-bisphosphate.
Diversité métabolique du phosphoénolpyruvate
Les plantes utilisent le PEP de la glycolyse de différentes manières (voir figure à droite). L'utilisation des PEP est limitée dans la voie classique de dégradation glycolytique : une pyruvate kinase (PK) utilise le PEP comme substrat pour la formation directe de pyruvate. L'ATP est généré par phosphorylation de la chaîne du substrat. Chez les plantes, par ailleurs, la PEP sert également de substrat pour la PEP carboxykinase (PEPC), qui en particulier chez les plantes à métabolisme acide C 4 - ou Crassulacean est important. L'oxaloacétate , un intermédiaire du cycle de l' acide citrique, est formé à partir de PEP et d' hydrogénocarbonate . L'oxaloacétate est ensuite réduit en L - malate par une malate déshydrogénase cytosolique (MDH) . Le L- Malat est ensuite transporté vers divers organites. Dans la mitochondrie, il peut être décarboxylé en pyruvate par une enzyme malate (ME) dépendante du NAD + . Il s'agit d'une réaction de dérivation de la pyruvate kinase, dans laquelle aucun ATP n'est produit, mais est utile en cas de carence en phosphate. En effet, le phosphate lié au PEP est à nouveau libéré et est disponible pour la plante pour d'autres réactions. Ce contournement a été démontré dans les racines du pois .
Une enzyme malate plastidique dépendante du NADP peut produire du pyruvate à partir du malate L produit par PEPC et MDH . Le pyruvate y est nécessaire pour la synthèse des acides gras ou est ramené dans le cytosol. Ceci contourne également la réaction de la pyruvate kinase, ce qui est avantageux en cas de manque de phosphate.
S'il y a un manque de phosphate, une PEP phosphatase (PEPase, EC 3.1.3.60) peut également libérer du phosphate précieux. Ici, le PEP est transporté dans la vacuole , où il est hydrolysé en pyruvate par une PEPase. Le pyruvate et le phosphate sont ensuite ramenés dans le cytoplasme. S'il n'y a pas de carence en phosphate, la PEPase est inhibée par un P suffisamment élevée i concentration.
Enfin, il existe également un GADH cytosolique indépendant du phosphate (EC 1.2.1.9) qui oxyde le glycéraldéhyde directement en 3-phosphoglycérate. Seul le NADPH est produit, mais pas d'ATP.
régulation
Il existe des différences importantes entre la régulation des enzymes impliquées dans la glycolyse et celle des animaux. La PEP est un effecteur allostérique spécial qui, contrairement au processus chez les animaux, peut inhiber la PFK. En revanche, le fructose-1,6-bisphosphate ne peut pas activer la pyruvate kinase. Alors que le fructose-2,6-bisphosphate active le PFK chez les animaux, rien de tel ne se produit chez les plantes.
La glycolyse dans les plantes vertes est principalement régulée par les activités de la pyruvate kinase et de la PEP carboxykinase, et d'autre part par PFK-1 et PFP. En principe, c'est l'inverse avec les animaux.
Glycolyse chez les archées
Dans les archées dégradant le sucre, les glucides sont décomposés de différentes manières. Chez les aérobies hyperthermophiles et thermophiles, par exemple Thermoplasma acidophilum ( Euryarchaeota ) ou Sulfolobus solfataricus (maintenant reclassé en Saccharolobus solfataricus [en] , Crenarchaeota ), le glucose est converti en pyruvate via une variante de la voie d'Entner-Doudoroff (voie ED). En revanche, les anaérobies hyperthermophiles en fermentation utilisent des glucides dans une voie EMP modifiée, telle que :
- parmi les Euryarchaeota :
- Pyrococcus furiosus ,
- Archaeoglobus fulgidus [fr] (un sulfato-réducteur) et
- Représentants du genre Thermococcus [fr] ;
chez les Crenarchaeota :
Les métabolites qui s'y trouvent sont similaires à ceux de la glycolyse des eucaryotes et des bactéries, mais on utilise pour cela des enzymes qui n'ont aucune similitude avec celles des bactéries ou des eucaryotes. Les archées contiennent de l'ADP- au lieu de kinases dépendantes de l'ATP, par exemple la glucokinase (EC 2.7.1.147) ou la phosphofructokinase (EC 2.7.1.146). Contrairement aux bactéries, elles n'ont pas de système de transport du sucre dépendant du PEP. La dernière étape de la glycolyse, la conversion du PEP en pyruvate, peut également être réalisée par une pyruvate phosphate dikinase (PPDK, EC 2.7.9.1) en plus de la PK. Cette enzyme catalyse la conversion réversible du PEP, AMP et PP i de pyruvate, de l' ATP et P i , bien que la formation de pyruvate est préféré dans Thermoproteus tenax . T. tenax est un archéon hétérotrophe facultatif vivant en anaérobie du département Crenarchaeota . Le PPDK a également été détecté chez les bactéries et les eucaryotes.
Il existe une différence importante dans l'oxydation du glycéraldéhyde-3-phosphate. Ceci est soit oxydé directement à la 3-phosphoglycérate par une NAD (P) + -dépendante (GAPN) ou une ferrédoxine déshydrogénase dépendante (GAPOR), mais sans incorporation de phosphate inorganique. Par conséquent, dans cette étape, aucun ATP n'est formé par phosphorylation de la chaîne de substrat, de sorte que dans la plupart des archées, aucun ATP n'est formellement obtenu par cette glycolyse modifiée. La voie métabolique de la glycolyse la mieux étudiée chez les archées est celle de P. furiosus . Là, la réponse nette est :
Une autre différence importante est l'absence de régulation allostérique des enzymes clés avec les effecteurs, qui a été décrite ci-dessus pour les bactéries et les eucaryotes. Chez T. tenax, il y a au moins des indications que le GAPN est activé allostériquement par l'AMP, le glucose-1-phosphate, le fructose-6-phosphate, le fructose-1-phosphate, l'ADP et le ribose-5-phosphate, tandis que le NAD (P) H , NADP + et ATP inhibent l'enzyme. Une régulation au niveau de la transcription peut également avoir lieu, comme c'est le cas avec la GAPDH trouvée chez T. tenax .
évolution
La glycolyse est présente chez la plupart des bactéries et des eucaryotes, et sous une forme quelque peu modifiée chez les archées et les bactéries hyperthermophiles . Ceci suggère que la glycolyse s'est établie très tôt dans l' évolution et était déjà présente dans les premiers organismes. Par des comparaisons phylogénétiques avec des micro-organismes thermophiles et hyperthermophiles, on soupçonne que la voie EMP après la voie ED a émergé. De plus, la signification originale de la voie EMP n'était probablement pas dans la dégradation des glucides, mais c'était l'inverse en tant que gluconéogenèse pour accumuler du glucose. Cela soutient également la théorie selon laquelle les voies métaboliques pour la construction des glucides sont apparues plus tôt dans l'évolution que celles qui décomposent les glucides ; La gluconéogenèse « aujourd'hui » est plus répandue dans les organismes dans les trois domaines que la glycolyse.
Les enzymes de la branche inférieure de la glycolyse (phase d'amortissement) catalysent majoritairement des réactions réversibles et les plus hautement conservées. On les trouve également dans la voie phylogénétiquement plus ancienne de l'ED. Comme d'autres voies métaboliques, elles étaient probablement déjà présentes avant la séparation des trois domaines du vivant et font donc partie des enzymes les plus anciennes. En raison de leur importance essentielle, elles ne pouvaient être ni perdues ni remplacées par d'autres enzymes au fil du temps. La glycéraldéhyde-3-phosphate déshydrogénase est la plus conservée de toutes les enzymes glycolytiques ; seuls 3 % du domaine catalytique ont changé en 100 millions d'années.
La branche supérieure de la glycolyse (phase préparatoire) s'est probablement établie plus tard. Alors que les enzymes impliquées dans les bactéries et les eucaryotes présentent des homologies élevées, les enzymes trouvées dans les archées sont uniques. On se demande encore si les enzymes de la première partie de la glycolyse ont été perdues à l'origine dans les archées et n'ont été réintroduites que plus tard par transfert horizontal de gènes . Alternativement, des enzymes ayant des fonctions similaires auraient pu être utilisées pour la glycolyse d'origine, qui ont ensuite été soumises à des modifications majeures et à des changements de séquence. Dans les deux cas, cela pourrait expliquer pourquoi les enzymes glycolytiques des archées sont si différentes de celles des autres organismes.
Littérature
- Geoffrey Zubay : biochimie. Professionnel de McGraw-Hill. 4e édition. 1999, ISBN 3-89028-701-8 , pages 293 et suivantes.
- Donald Voet, Judith G. Voet : Biochimie. Wiley-VCH 1994, ISBN 3-527-29249-7 , pages 420 et suivantes.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer : Biochimie. 6 édition. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , p. 486ff.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducteur) : Biochimie. 4e édition mise à jour. Pearson Studium, 2008, ISBN 978-3-8273-7312-0 , p. 442 et suiv.
- Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). 4e édition. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2 , pp. 535-562.
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (premier) : Lehninger Biochemie. 4ème, entièrement révisé et exp. Édition. Springer, Berlin 2009, ISBN 978-3-540-68637-8 , p. 607-730.
- Ron S. Ronimus, Hugh W. Morgan : La distribution et la phylogénie des enzymes de la voie Embden-Meyerhof-Parnas des archées et des bactéries hyperthermophiles soutiennent une origine gluconéogène du métabolisme. Dans : Archaea 1 (3) 2003, pp. 199-221, PMID 15803666 , PMC 2685568 (texte intégral gratuit)
- WC Plaxton : L'organisation et la régulation de la glycolyse végétale. Dans : Annu Rev Plant Physiol Plant Mol Biol. 47 (1996), pp 185-214, PMID 15012287 , doi : 10.1146 / annurev.arplant.47.1.185
- T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork : Alignement des voies : application à l'analyse comparative des enzymes glycolytiques . Dans : Biochimie. J. . 343 Pt 1, octobre 1999, pp. 115-24. PMID 10493919 . PMC 1220531 (texte intégral gratuit).
Preuve individuelle
- ↑ C. Cagniard-Latour: Mémoire sur la fermentation vineuse. In : Annales de chimie et de physique . Volume 68, 1837, pages 206-222.
- ↑ Theodor Schwann : Communication préliminaire concernant des expériences sur la fermentation et la putréfaction. Dans : Annals of Physics and Chemistry . Tome 41, 1837, pp. 184-193.
- ↑ FT Kützing : Investigations microscopiques sur la levure et le vinaigre mère, ainsi que plusieurs autres structures végétales associées. Dans : Journ. Chimie pratique . 11 (1837), p. 385-409.
- ^ E. Racker : Histoire de l'effet Pasteur et de sa pathobiologie. Dans : Mol Cell Biochem. 5 (1-2) 1974, pp. 17-23, PMID 4279327 , doi : 10.1007 / BF01874168 .
- ↑ J. Liebig : À propos des phénomènes de fermentation, de putréfaction et de putréfaction et de leurs causes. Dans : Annales de pharmacie. (Heidelberg) 30 (1839), p. 250-287.
- ^ L. Pasteur : Mémoire sur la fermentation alcoolique. In : Annales de chimie et de physique. 58 (1860), p. 323-426.
- ↑ M. Traube Dans: Ann. Phys. Chem. (Poggendorff) 103 (1858), pages 331-344.
- ↑ E. Buchner : Fermentation alcoolique sans cellules de levure (communication préalable). Dans : Ber. Dt. Chem. Ges . 30 (1897), p. 117-124. (en ligne)
- ↑ Athel Cornish-Bowden : Nouvelle bouteille de bière dans un ancien Eduard Buchner et la croissance des connaissances biochimiques. ISBN 84-370-3328-4 , page 60.
- ^ A. Harden, WJ Young : Le ferment alcoolique du jus de levure. Dans : Proc. R. Soc. Londres. B 77 (519) 1906, pp. 405-420, doi : 10.1098 / rspb.1906.0029 .
- ^ A. Harden, WJ Young : Le ferment alcoolique du jus de levure. Partie III.-La fonction des phosphates dans la fermentation du glucose par le jus de levure. Dans : Proc. R. Soc. Londres. B 80 (540) 1908, pp. 405-420, doi : 10.1098/rspb.1908.0029 .
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (éd.), Werner Müller-Esterl (éd.) : Biochemie. Wiley-VCH 1992, ISBN 3-527-28242-4 , p. 421f.
- ^ N. Kresge, RD Simoni, RL Hill : Otto Fritz Meyerhof et l'élucidation de la voie glycolytique. Dans : J Biol Chem . 280 (4) 2005, p. E3, PMID 15665335 , PDF (accès gratuit au texte intégral , anglais)
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox : Lehninger Biochemie. 3e, entièrement révisé et exp. Édition. Springer, Berlin 2009, ISBN 978-3-540-41813-9 , pp. 584ff.
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (éd.), Werner Müller-Esterl (éd.) : Biochemie. Wiley-VCH, 1992, ISBN 3-527-28242-4 , page 444.
- ↑ Hans W. Heldt, Birgit Piechulla : Biochimie végétale. 4e édition. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , page 334.
- ^ Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). 4e édition. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2 , page 535.
- ↑ Hans W. Heldt, Birgit Piechulla : Biochimie végétale. 4e édition. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , page 334.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer : Biochimie. 6 édition. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , page 764.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin : Biochimie végétale. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , p. 145.
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducteur) : Biochemie. Étude Pearson. 4e édition mise à jour. 2008, ISBN 978-3-8273-7312-0 , page 448.
- ↑ a b c R. & nnbsp; S. Ronimus, H. & nnbsp; W. Morgan : La distribution et la phylogénie des enzymes de la voie Embden-Meyerhof-Parnas des archées et des bactéries hyperthermophiles soutiennent une origine gluconéogène du métabolisme. Dans : Archaea . 1 (3) 2003, pp. 199-221, PMID 15803666 , PMC 2685568 (texte intégral gratuit).
- ↑ a b Caroline Bowsher, Steer Martin W., Alyson K. Tobin: biochimie végétale. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , page 148.
- ↑ David Nelson, Michael Cox : Lehninger Biochemie. Springer, Berlin ; 4ème, entièrement révisé et exp. Édition. 2008, ISBN 978-3-540-68637-8 , page 713.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin : Biochimie végétale. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , page 150.
- ^ A b c d Reginald Garrett, Charles M. Grisham: Biochemistry. (Édition étudiante internationale). 4e édition. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , page 538.
- ^ Un b David L. Nelson, Michael M. Cox : Principes de Lehninger de biochimie. 5e édition. Palgrave Macmillan, 2008, ISBN 978-0-7167-7108-1 , page 553.
- ^ Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). 4e édition. Cengage Learning Services, Australie 2009, ISBN 978-0-495-11464-2 , page 539.
- ^ S. Minakami, H. Yoshikawa : Études sur la glycolyse des érythrocytes. II. Modifications de l'énergie libre et étapes limitantes de la vitesse de la glycolyse érythrocytaire. Dans : J. Biochem. Volume 59 (2) 1966, pages 139-144, PMID 4223318 .
- ↑ S. Minakami, H. Yoshikawa: considérations sur Thermodynamique érythrocytaire glycolyse. Dans : Biochimie. Biophys. Commun. Volume 18 (3) 1965, pages 345-349, PMID 14300746 , doi : 10.1016 / 0006-291X (65) 90711-4 .
- ^ Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). 4e édition. Cengage Learning Services, Australie 2009, ISBN 978-0-495-11464-2 , page 554.
- ↑ Athel Cornish-Bowden : Nouvelle bouteille de bière dans un ancien Eduard Buchner et la croissance des connaissances biochimiques. Universitat de Valencia, Valencia 1997, ISBN 84-370-3328-4 , page 148.
- ^ Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). 4e édition. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , page 537.
- ^ EA Newsholme et al. : Les activités de la fructose diphosphatase dans les muscles de vol du bourdon et le rôle de cette enzyme dans la génération de chaleur. Dans: Biochem J . 128 (1) 1972, pp. 89-97, PMID 4343671 , PMC 1173573 (texte intégral gratuit).
- ^ Un b Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). Services d'apprentissage Cengage; 4e édition. 2009, ISBN 978-0-495-11464-2 , p. 539f.
- ↑ a b c David Nelson, Michael Cox: Lehninger Biochemie. 4ème, entièrement révisé et exp. Édition. Springer, Berlin 2008, ISBN 978-3-540-68637-8 , p. 773ff.
- ^ Reginald Garrett, Charles M. Grisham : Biochimie. (Édition étudiante internationale). Services d'apprentissage Cengage. 4e édition. 2009, ISBN 978-0-495-11464-2 , p. 542f.
- ↑ Müller-Esterl, Werner . : Biochimie : une introduction pour les médecins et les naturalistes . 1ère édition. Elsevier, Spektrum, Akad Verl, Munich 2004, ISBN 3-8274-0534-3 , p. 496 f .
- ↑ a b c H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducteur) : Biochemie. Étude Pearson. 4e édition mise à jour, 2008, ISBN 978-3-8273-7312-0 , page 468.
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (traducteur) : Biochemie. Étude Pearson. 4e édition mise à jour, 2008, ISBN 978-3-8273-7312-0 , page 470.
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman : Biochimie BRS, biologie moléculaire et génétique. 5e édition. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , page 65.
- ^ A. Harden, WJ Young : Le ferment alcoolique du jus de levure. Partie VI.-L'influence des arséniates et des arsénites sur la fermentation des sucres par le jus de levure. Dans : Proc. R. Soc. Londres. B 83 (566) 1911, pp. 451-475, doi : 10.1098 / rspb.1911.0028 .
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman : Biochimie BRS, biologie moléculaire et génétique. 5e édition. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , page 123.
- ^ A b W. C. Plaxton : L'organisation et la régulation de la glycolyse végétale. Dans : Annu Rev Plant Physiol Plant Mol Biol. 47 (1996), pp 185-214, PMID 15012287 , doi : 10.1146/annurev.arplant.47.1.185 .
- ^ Rudolf K. Thauer, Kurt Jungermann, Karl Decker : Conservation de l'énergie dans les bactéries anaérobies chimiotrophes. Dans : Revues bactériologiques . Volume 41, n° 1, 1977, page 101.
- ^ B. Siebers, P. Beauty: Voies inhabituelles et enzymes du métabolisme central des glucides chez Archaea. Dans : Curr Opin Microbiol . 8 (6) 2005, pp. 695-705, PMID 16256419 , doi : 10.1016 / j.mib.2005.10.014 .
- ↑ M. Zaparty et al. : Le métabolisme central des glucides du crénarchaeote hyperthermophile Thermoproteus tenax : voies et éclairage sur leur régulation. Dans : Arch Microbiol . 190 (3) 2008, pp. 231-245, PMID 18491075 , doi : 10.1007 / s00203-008-0375-5 .
- ↑ C. & nnbsp; H. Verhees et & nnbsp; al. : Les caractéristiques uniques des voies glycolytiques chez Archaea. Dans: Biochem J . 375 (Pt & nnbsp; 2) 2003, pp. 231-246, PMID 12921536 , PMC 1223704 (texte intégral gratuit).
- ^ AH Romano, T. Conway : Évolution des voies métaboliques des glucides. Dans : Res. Microbiol. Volume 147 (6-7), 1996, pp. 448-455, PMID 9084754 ; doi : 10.1016 / 0923-2508 (96) 83998-2
- ↑ RS Ronimus, HW Morgan : La distribution et la phylogénie des enzymes de la voie Embden-Meyerhof-Parnas des archées et des bactéries hyperthermophiles soutiennent une origine gluconéogène du métabolisme. Dans : Archaea 1 (3) 2003, pp. 199-221, PMID 15803666 , PMC 2685568 (texte intégral gratuit).
liens web
- Glycolyse sur la page d'accueil d'Ulrich Helmich
- Jennifer McDowall / Interpro : Protéine du mois : Enzymes de la glycolyse. (angl.)