Hippocampe
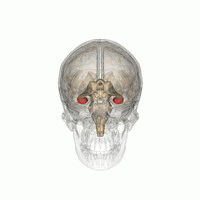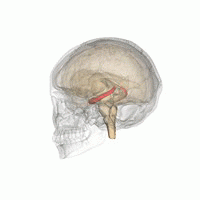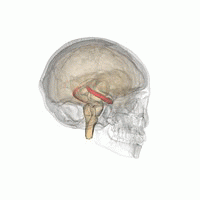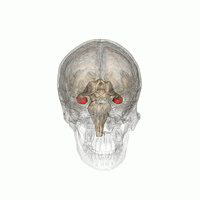
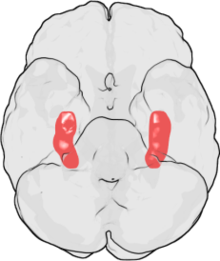
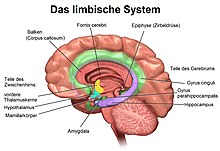
L' hippocampe ( pluriel hippocampe ) fait partie du cerveau , plus précisément: l' archicortex, qui survient pour la première fois chez les reptiles . Il est situé sur le bord interne du lobe temporal et est une station de commutation centrale du système limbique . Il y a un hippocampe par hémisphère .
Origine du mot

À partir de 1706, une partie du cerveau a été nommée d'après l' hippocampe ( hippocampe latin ). De son côté, l'hippocampe a été nommé sous forme latinisée depuis les années 1570 d' après le monstre marin Hippocampus de la mythologie grecque , dont la moitié avant est un cheval, la partie arrière un poisson. Le nom de cette créature mythique ( ancien grec ἱππόκαμπος hippokampos ) est composé d' hippopotames «cheval» et de kampos «monstre marin» .
Dans l'ensemble, l'hippocampe ressemble à un hippocampe sans tête (voir illustration).
anatomie
L'hippocampe est situé dans la partie médiale du télencéphale (cerveau terminal) et forme le soi-disant archicortex.
Plusieurs structures appartiennent à l'hippocampe, c'est pourquoi on parle d'une formation d'hippocampe ou formatio hippocampe:
- Gyrus denté
- Cornu ammonis (corne d'ammon, Hippocampus proprius )
- Subiculum
Cytoarchitectonique
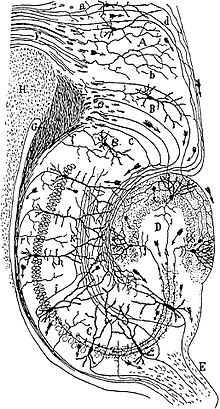
Le gyrus denté est le point d'entrée de l'hippocampe et ses corps de cellules nerveuses sont situés dans la bande de cellules granulaires (stratum granulare). Les cellules principales sont des cellules granulaires glutamatergiques excitatrices qui envoient leurs dendrites vers l' extérieur dans la couche moléculaire (stratum moleculare). En outre, il existe un certain nombre d' interneurones inhibiteurs GABAergiques différents , qui se différencient par leur morphologie, donc aussi par leurs entrées et sorties et aussi par des protéines caractéristiques. La couche moléculaire peut être divisée en couche moléculaire interne et externe. Dans les deux parties, il n'y a pratiquement pas de corps de cellules nerveuses, seulement des fibres nerveuses. Les entrées des deux couches diffèrent cependant et peuvent être visualisées avec des couleurs différentes (voir ci-dessous). Dans l'arc de la couche cellulaire granulaire se trouve le hile , également appelé lamina multiformis. Il contient quelques interneurones , mais surtout les axones des cellules granulaires, les fibres dites de mousse (note: mis à part leur nom, ces axones n'ont rien de commun avec les fibres de mousse du cervelet ).
L'hippocampe proprement dit ( Hippocampus proprius ), en tant que structure archicorticale, comporte également trois couches. Semblable au gyrus denté, les corps des cellules nerveuses se trouvent dans une couche, la couche cellulaire pyramidale ( stratum pyramidale ). Les cellules principales ici sont également des cellules pyramidales glutamatergiques , qui envoient des dendrites radialement à la fois vers l'intérieur et vers l'extérieur, et il existe une variété similaire d' interneurones . En tant que couches d'entrée, la large strate radiatum et la strate lacunosum -olekulare plus étroite sont fixées à l'extérieur de la couche cellulaire pyramidale , à l'intérieur de la strate oriens , qui contient les corps cellulaires des cellules du panier inhibiteur. Dans sa direction tangentielle, l'hippocampe proprius est divisé en régions CA1 à CA4 (de C ornu A mmonis), seules les régions CA1 et CA3 étant en fait importantes sur le plan anatomique et fonctionnel.
Le subiculum est la zone de transition entre l'hippocampe archicortical à trois couches et le néocortex à six couches . Il se situe entre la région CA1 et le cortex entorhinal .
liens
Dans la formation de l'hippocampe, les neurones excitateurs sont connectés en une chaîne. Le principal point d'entrée des afférences corticales est la couche moléculaire externe du gyrus denté. C'est là que les axones du cortex entorhinal arrivent en tant que soi-disant tractus perforé . Ils se connectent aux cellules granulaires qui sont également excitantes; mais aussi sur certaines des différentes classes d'interneurones inhibiteurs (inhibition directe). Dans le gyrus denté, d'autres interneurones, les cellules du panier et du chandelier, provoquent une inhibition inverse, i. Autrement dit, ils reçoivent des entrées de cellules granulaires et reviennent à leur somata ou à leur butte axonale. Dans la couche moléculaire interne, les cellules granulaires reçoivent des afférents rétrocouplés d'autres cellules granulaires et de la région CA4 de l'hippocampe proprius (fibres associatives), ainsi que des afférents commissuraux du gyrus denté de l'autre hémisphère.
Les cellules granulaires se projettent via les fibres de mousse dans la couche radiale interne de la région CA3 de l'hippocampe proprius sur les cellules pyramidales , qui à leur tour sont excitantes. Ici aussi, il y a des inhibitions avant et arrière dues aux interneurones. D'autres afférents sont échangés entre les régions CA3 des deux hémisphères; ils se terminent dans la strate externe radiatum . Les cellules pyramidales envoient des axones dans le fornix , qui quittent la formation hippocampique et atteignent divers noyaux du tronc cérébral (y compris les corps mamillaires , substantia nigra , locus caeruleus ).
Les branches des mêmes axones, les collatérales de Schaffer, relient la chaîne plus loin dans la région CA1, où elles se terminent à leur tour par des cellules pyramidales. De plus, les axones du cortex entorhinal atteignent la couche lacunosum-olékulare de la région CA1. Les axones des cellules pyramidales CA1 forment une autre partie du fornix et se projettent également dans le subiculum. Cette projection est l'entrée principale du subiculum. De plus, il reçoit des afférences du cortex perirhinalis et du cortex entorhinalis. À son tour, il se projette dans le cortex cérébral des deux côtés, ainsi que dans le noyau accumbens , l' amygdale , le cortex préfrontal et l' hypothalamus .
Par la projection du fornix dans les corps mamillaires, l'hippocampe est intégré dans le cercle de Papez , qui a été décrit par James W. Papez en 1937 et postulé comme la base neurale des émotions . Le cercle de Papez se referme à la formation de l'hippocampe via le thalamus , le gyrus cingulaire et le cortex entorhinal.
L'ensemble de la formation hippocampique reçoit également des afférents de voies neuromodulatrices. Les neurones cholinergiques du septum pellucidum envoient leurs axones ici, des neurones sérotoninergiques du raphé médial et des neurones contenant de la noradrénaline du locus caeruleus. Une projection dopaminergique très faible du tegmentum ventral est difficile à détecter histochimiquement.
Activité électrique
L'activité dans l'hippocampe est faible pendant la locomotion et le sommeil paradoxal . Dans les états de veille sans locomotion et sans sommeil paradoxal , en revanche, il existe souvent une activité synchrone de grands groupes de neurones qui façonnent le potentiel électrique extracellulaire ( potentiel de champ ) dans l'hippocampe. Les caractéristiques sont des courbes en dents de scie ( onde pointue anglaise ) avec des périodes de quelques 100 ms, sur lesquelles des paquets d'ondes courtes ( ondulation ) se superposent à ou peu de temps avant le maximum de la polarisation . Les abréviations synonymes pour cette combinaison sont SWR et SPW-R. La fréquence des ondulations, de 100 à plus de 200 Hz, varie d'une espèce à l'autre. Un événement d'ondulation se produit presque toujours dans CA1 et CA3 et principalement dans les deux hémisphères en même temps, les ondulations elles-mêmes ne sont pas synchrones.
Aspects fonctionnels
Les informations provenant de divers systèmes sensoriels convergent dans l'hippocampe, sont traitées et renvoyées au cortex à partir de là . Il est donc extrêmement important pour la consolidation de la mémoire , c'est-à-dire le transfert du contenu de la mémoire de la mémoire à court terme vers la mémoire à long terme . Les personnes qui ont les deux hippocampes enlevés ou détruits ne peuvent pas former de nouveaux souvenirs et ont donc une amnésie antérograde . Cependant, les vieux souvenirs sont pour la plupart préservés. L'hippocampe est ainsi vu comme une structure qui génère des souvenirs, tandis que le contenu de la mémoire est stocké à divers autres endroits du cortex cérébral .
Il a été prouvé que de nouvelles connexions entre les cellules nerveuses existantes ( plasticité synaptique ) se forment dans le cerveau adulte de l'hippocampe et que cette nouvelle formation est liée à l'acquisition de nouveaux contenus de mémoire. Le collatéral Schaffer, la connexion entre la région CA3 et CA1, est prédestiné à la recherche sur les processus d'apprentissage moléculaire. Voici les récepteurs spéciaux du glutamate ( NMDA ) qui sont impliqués dans la potentialisation à long terme .
Chez les animaux, l'hippocampe est d'une grande importance pour l'orientation spatiale. Les cellules pyramidales dans CA1 représentent chacune une zone d'un environnement et sont donc également appelées cellules de lieu . Au fur et à mesure que l'animal se déplace, différentes cellules deviennent actives les unes après les autres, les cellules des emplacements adjacents n'étant pas adjacentes. Différentes cellules d'endroit sont parfois responsables d'un endroit en fonction de la direction du mouvement ou de la destination. Les cellules de placement codent également des états abstraits, tels que B. dans quelle phase d'un processus comportemental complexe un animal se trouve actuellement ou si un certain affect est actuellement présent (faim, curiosité, peur). Il n'y a donc pas de carte topographiquement organisée dans le cerveau, mais la représentation cognitive, également appelée carte cognitive, contient des informations topologiques sur l'environnement vécu. Les soi-disant cellules de grille dans le cortex entorhinal contribuent à la performance cognitive de représentation des distances entre des emplacements définis . Les personnes atteintes d'hippocampes endommagées peuvent trouver leur chemin dans la vie de tous les jours, mais sont incapables de donner des directions.
L'hippocampe est également responsable de la coordination des différents contenus de la mémoire. Par exemple, il y a la «carte intérieure» que vous pouvez utiliser, par exemple B. possède d'une ville, à partir de nombreuses impressions qui ont également été acquises à différents moments dans le temps. Ceux-ci sont rassemblés dans l'hippocampe et on peut s'orienter de cette manière.
De plus, la formation hippocampique joue également un rôle important dans les émotions:
- Les personnes souffrant de dépression (unipolaire) présentent un volume réduit de la formation hippocampique.
- La formation hippocampique est unique dans sa vulnérabilité à de forts stresseurs émotionnels; Les modèles animaux montrent l'atrophie de l'hippocampe comme un effet du stress émotionnel chronique (causé par la mort des neurones de l'hippocampe et une réduction de la genèse neuronale dans le gyrus denté), et les personnes souffrant de traumatismes émotionnels graves (par exemple, vétérans du Vietnam ou victimes d'abus sexuels sur des enfants) montrent une réduction du volume de la formation hippocampique.
- Les personnes ayant une affectivité aplatie présentent des différences fonctionnelles dans la formation de l'hippocampe dans le traitement des stimuli émotionnels. En particulier, les études d'imagerie fonctionnelle qui étudient les corrélats neuronaux de l'émotion avec la musique rapportent des différences dans l'activité de la formation hippocampique en relation avec les émotions évoquées par la musique.
Aspects neuropathologiques
Chez l'homme, diverses maladies peuvent entraîner des modifications de l'hippocampe. Surtout, les processus de dégradation dans la démence peuvent endommager cette structure cérébrale. De plus, l'hippocampe joue un rôle important dans le développement des maladies épileptiques . L' épilepsie du lobe temporal est souvent associée à une sclérose temporale mésiale liée, au moyen de techniques d'imagerie ( l'imagerie par résonance magnétique peut être diagnostiquée). L' ablation unilatérale de la formation de l'hippocampe par chirurgie de l' épilepsie est un moyen de traiter les crises qui ne peuvent être contrôlées par des médicaments. La consommation excessive d'alcool à l' adolescence est soupçonnée de nuire à la formation de l'hippocampe sur le long terme, ce qui à l'âge adulte peut entraîner un oubli et un manque d'orientation spatiale.
Neurogenèse dans l'hippocampe
Le gyrus denté de l'hippocampe, avec le bulbe olfactif (ou la zone sous-ventriculaire), est l'une des deux structures du cerveau sain des mammifères qui forment de nouvelles cellules nerveuses tout au long de leur vie. Cette neurogenèse des cellules granulaires glutamatergiques a été découverte en 1965 par Altman et Das chez le rat et contredit le dogme qui existait depuis des décennies selon lequel les neurones du cerveau sont complets dès la naissance. Néanmoins, la neurogenèse de l'hippocampe n'a attiré l'attention scientifique que dans les années 1990, lorsque le marquage BrdU des cellules en division a été utilisé pour montrer que des influences telles que le stress , l'activation du récepteur NMDA , la marche et l'environnement riche, le taux de division des cellules et / ou leur taux de survie peut changer. Depuis, de nombreuses autres études ont montré que de nombreux neurotransmetteurs, facteurs de croissance , substances médicinales , médicaments et facteurs environnementaux (y compris l'apprentissage de l'apprentissage) peuvent influencer la neurogenèse. Comme seule une petite partie des cellules nouvellement formées se différencie en neurones, il est nécessaire de différencier les termes prolifération cellulaire ( mitose des cellules souches neuronales) et neurogenèse. En plus des rongeurs, la neurogenèse de l'hippocampe a également été trouvée chez d'autres mammifères au cours de cette période, y compris les humains en 1998.
La fonction de la neurogenèse hippocampique n'est toujours pas claire. Ce n'est que depuis 2002 qu'il a été possible de prévenir la prolifération cellulaire à l'aide de rayons X puissants et focalisés et ainsi de mener des expériences significatives. Cependant, les résultats de ces études ont jusqu'à présent été incohérents; Les animaux ainsi endommagés présentent des déficits (mais pas un échec complet) dans certains paradigmes d'apprentissage spatial, mais pas tous. En revanche, une amnésie antérograde progressive et incurable a été observée chez des adolescents traités par rayons X pour une tumeur cérébrale . Des études de simulation avec des réseaux de neurones artificiels indiquent différentes fonctions possibles de la neurogenèse: stabilisation de l'hippocampe contre les influences extérieures, évitement des interférences catastrophiques, oubli plus facile des schémas précédemment appris. Il convient de noter qu'une cellule nouvellement formée ne se différencie en neurone qu'au cours d'environ quatre semaines, c'est-à-dire longtemps après l'événement qui a déclenché la division. Il a été démontré que les nouveaux neurones affectent la capacité d'apprendre dans la période de quatre à 28 jours après la division.
Littérature
- Christine N. Smith, Larry R. Squire: l' activité du lobe temporal médial lors de la récupération de la mémoire sémantique est liée à l'âge de la mémoire . Dans: J. Neuroscience . enregistrer 29 , non. 4 , 29 janvier 2009, doi : 10.1523 / JNEUROSCI.4545-08.2009 , PMID 19176802 , PMC 2670190 (texte intégral gratuit) - (anglais, jneurosci.org [consulté le 1er novembre 2016] Review in Repository of Remembrance (Wissenschaft. de, 28 janvier 2009)).
liens web
- Gyorgy Buzsaki: Hippocampe . Dans: Scholarpedia . (Anglais, y compris les références)
gonfler
- ↑ Antonio Abellán, Ester Desfilis, Loreta Medina: l' expression combinatoire de Lef1, Lhx2, Lhx5, Lhx9, Lmo3, Lmo4 et Prox1 aide à identifier des subdivisions comparables dans la formation hippocampique en développement de la souris et du poulet . Dans: Frontiers in Neuroanatomy . enregistrer 8 , 2014, doi : 10.3389 / fnana.2014.00059 (anglais, texte intégral gratuit).
- ↑ hippocampus dictionary.com (anglais)
- ↑ Dictionnaire d'étymologie en ligne hippocampe (anglais)
- ↑ T. Koch, R. Berg: Manuel d'anatomie vétérinaire . 4e édition. enregistrer 3 . Fischer, Jena 1985, p. 422 .
- ↑ Kazu Nakazawa et al.: Récepteurs NMDA, cellules de lieu et mémoire spatiale hippocampique . Dans: Nature Reviews Neuroscience . enregistrer 5 , 2004, doi : 10.1038 / nrn1385 (anglais): "Citation de l'encadré 1: Les emplacements relatifs de ces champs réceptifs aux lieux changent dans différents environnements, sans relation topographique apparente avec la position des cellules "
- ↑ P. Videbech, B. Ravnkilde: Volume et dépression de l'hippocampe . Dans: Am. J. Psychiatrie . enregistrer 161 , 2004, p. 1957 1966 (anglais).
- ^ JL Warner-Schmidt, RS Duman: Neurogenèse hippocampique. Effets opposés du stress et du traitement antidépresseur . Dans: Hippocampus . enregistrer 16 , 2006, pp. 239 249 (anglais).
- ↑ MB Stein, et al.: Volume hippocampique chez les femmes victimes d'abus sexuels durant l'enfance . Dans: Psychol. Med. Band 27 , 1997, p. 951 959 (anglais).
- ^ JD Bremner: Le stress endommage-t - il le cerveau? Dans: Biol. Psychiatry . enregistrer 45 , 1999, p. 797 805 , doi : 10.1016 / s0006-3223 (99) 00009-8 (anglais, nih.gov ).
- ^ S. Koelsch, et al.: Une signature cardiaque de l'émotivité . Dans: Eur. J. Neurosci. enregistrer 26 , 2007, p. 3328 3338 (anglais).
- ^ Stefan Koelsch: Vers une base neurale d'émotions évoquées par la musique . Dans: Trends in Cognitive Sciences . enregistrer 14 , 2010, p. 131 137 , doi : 10.1016 / j.tics.2010.01.002 (anglais, sciencedirect.com ).
- ↑ Taffe et al.: Réduction durable de la neurogenèse de l'hippocampe par la consommation d'alcool chez les primates non humains adolescents . Dans: PNAS . enregistrer 107 , 2010, p. 11104 11109 (anglais).