Hydroxyde de calcium
| Structure en cristal | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| __ Ca 2+ __ OH - | |||||||||||||||||||
| Général | |||||||||||||||||||
| Nom de famille | Hydroxyde de calcium | ||||||||||||||||||
| Autres noms |
|
||||||||||||||||||
| Formule de ratio | Ca (OH) 2 | ||||||||||||||||||
| Brève description |
solide incolore et inodore |
||||||||||||||||||
| Identifiants externes / bases de données | |||||||||||||||||||
| |||||||||||||||||||
| Propriétés | |||||||||||||||||||
| Masse molaire | 74,10 g · mol -1 | ||||||||||||||||||
| État physique |
fermement |
||||||||||||||||||
| densité |
2,24 g cm -3 (20 ° C) |
||||||||||||||||||
| Point de fusion |
Se décompose à 550 °C |
||||||||||||||||||
| solubilité |
pauvre en eau (1,7 g l -1 à 20°C) |
||||||||||||||||||
| consignes de sécurité | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Suisse : 5 mg m -3 (mesuré en poussière inhalable ) |
||||||||||||||||||
| Données toxicologiques | |||||||||||||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | |||||||||||||||||||
L' hydroxyde de calcium (aussi: chaux hydratée , la chaux éteinte , (blanc) de la chaux hydratée , la chaux hydratée ) est l' hydroxyde de calcium .
Occurrence
L'hydroxyde de calcium est également présent naturellement sous forme de minéral portlandite .
Extraction et présentation
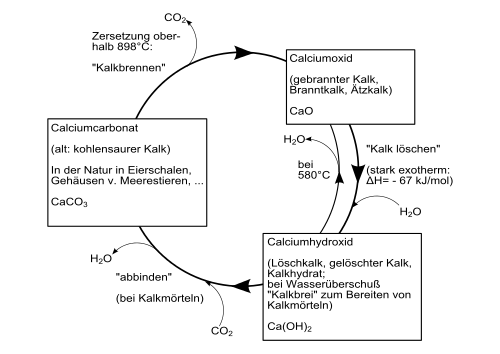
L'hydroxyde de calcium se forme avec un fort dégagement de chaleur ( réaction exothermique ) lorsque l'oxyde de calcium est mélangé à de l'eau. Ce processus est également appelé abattage à la chaux . Le développement de la chaleur est si fort qu'une partie de l'eau s'évapore également (familièrement appelée « fumée »).
Le schéma suivant donne un aperçu des processus de conversion entre les différents composés calciques ( cycle technique de la chaux ) :
Il est également possible de l'afficher en faisant réagir des solutions aqueuses de sels de calcium avec des solutions alcalines (par exemple du nitrate de calcium avec de la potasse ).
L'hydrure de calcium ou le calcium lui-même réagit violemment avec l'eau pour former de l'hydroxyde de calcium et de l' hydrogène .
Propriétés
L'hydroxyde de calcium est une poudre incolore qui ne se dissout que légèrement dans l'eau. La solubilité dépend de la température et diminue avec l'augmentation de la température : 1860 mg/l à 0°C ; 1650 mg/l à 20°C et 770 mg/l à 100°C. A 580°C il se décompose en produisant de l'oxyde de calcium et de l'eau. L'hydroxyde de calcium est constitué de cristaux trigonaux avec le polytype 2H de la structure cristalline du type iodure de cadmium ( groupe spatial P 3 m 1 (groupe spatial n°164) , a = 3,584, c = 4,896 Å ).
Bien que l'hydroxyde de calcium ne soit pas très soluble, il a une réaction fortement basique : le pH d'une solution saturée est de 11 à 12,6.
utiliser
Le but principal de l'hydroxyde de calcium est la préparation du mortier dans la construction. Il y est utilisé sous le nom de chaux blanche hydratée (DIN 1060). Les enduits à la chaux sont constitués de mélanges d'hydroxyde de calcium et de sable. Ce dernier peut également être ajouté sous forme de calcaire broyé . L'hydroxyde de calcium est également de plus en plus ajouté au mélange d'asphalte pour améliorer la durabilité de la couche d'asphalte finie.
L'hydroxyde de calcium se forme lorsque le ciment Portland durcit. Le ciment Portland est principalement utilisé pour fabriquer du béton armé . L'effet alcalin de l'hydroxyde de calcium dans le béton empêche l' acier d'armature de rouiller jusqu'à ce qu'il soit neutralisé par l'acide carbonique (ou d'autres composants acides de l'eau de pluie, par exemple).
L'effet antiseptique et caustique, qui empêche la croissance des agents pathogènes et des moisissures , est la raison pour laquelle la chaux éteinte était auparavant utilisée pour désinfecter les écuries (la "chaux" des écuries).
En conjonction avec de la soude et du savon lubrifiant , le calcaire coquillier éteint est transformé en Tadelakt , un enduit à la chaux hydrophobe pour pièces humides .
La chaux est utilisée pour améliorer la capacité portante du chantier. Un sol avec une teneur en eau trop élevée et la faible capacité portante résultante et la mauvaise compactabilité peuvent être améliorés en mélangeant 2 à 4 % de chaux MA. La chaux lie une partie de l'eau et améliore ainsi, entre autres, la plasticité, la compressibilité et la capacité de charge. C'est pourquoi l'amélioration du sol à la chaux est une méthode d'amélioration immédiate de la facilité d'installation et de la facilitation des travaux de construction.
La chaux éteinte est utilisée comme alternative au calcaire dans la désulfuration des fumées , car elle forme du sulfate de calcium (gypse) avec l'acide sulfurique . La quantité utilisée est environ 1,8 fois moindre que pour le calcaire. Le plâtre obtenu a une blancheur de 80% et peut être utilisé commercialement. En raison de sa grande réactivité, des quantités de consommation plus faibles sont nécessaires. L'inconvénient est le prix plus élevé par rapport au calcaire.
Dans l'industrie alimentaire, il est ajouté aux aliments en tant que régulateur d'acidité et est généralement approuvé dans l' UE en tant qu'additif alimentaire avec la désignation E 526 sans restriction de quantité maximale ( quantum satis ) pour les aliments.
Il est également utilisé comme médicament en dentisterie , principalement pour désinfecter les canaux radiculaires et les caries et pour stimuler la formation d' une nouvelle dentine .
Il fait partie de la chaux sodée , qui est utilisée dans les appareils d'anesthésie ou les machines de plongée avec réinspiration pour éliminer le dioxyde de carbone de l'air expiré.
L'hydroxyde de calcium est également utilisé comme pesticide dans la culture fruitière . Ici, il est utilisé, par exemple, comme fongicide (un agent contre les infestations fongiques, comme le cancer des arbres ).
L'eau de chaux est la solution (presque) saturéed'hydroxyde de calcium et sert de liquide clair pour la détection du dioxyde de carbone grâce à la formation de carbonate de calcium , qui précipite et rend la solution trouble.
Les suspensions dans l'eau sont :
- Chaux grasse ( puisard chaux ) : une masse onctueuse et raide - matériau de construction : mortier de chaux
- Lait de chaux : un liquide blanchâtre et laiteux qui se sépare en puisard chaux et chaux eau- couleur chaux , neutralisation des acides, décarbonisation , désulfuration des fumées
L'hydroxyde de calcium est utilisé comme produit intermédiaire dans la production de chaux chlorée et de soude caustique à partir de la soude .
consignes de sécurité
La chaux brûlée (non éteinte) ( oxyde de calcium , chaux vive) et la chaux éteinte sont irritantes, le contact avec les yeux peut entraîner de graves lésions oculaires. Une solution aqueuse d'hydroxyde de calcium est alcaline et légèrement corrosive. La chaux non éteinte peut provoquer des incendies lorsqu'elle est exposée à l'eau en raison du développement de la chaleur.
Historique
La réaction exothermique de la chaux éteinte était considérée comme l'une des plus grandes énigmes quotidiennes de l' Antiquité au début de l'ère moderne et a trouvé une grande variété d'explications : Alors que le père de l' église Augustin d'Hippone (354-430) dans son « état de Dieu » (21 , 4) le phénomène comme regardant une sorte de preuve de Dieu , les philosophes de la nature se sont efforcés d'interpréter le phénomène selon leurs idées respectives. Des exemples marquants sont :
Sénèque le Jeune et la Stoa
Selon la cosmologie stoïcienne , le philosophe romain Sénèque le Jeune († 65 après JC) interpréta l'abattage à la chaux selon la théorie des quatre éléments d' Aristote . L' oxyde de calcium est pour lui une sorte de "pierre de feu" après avoir brûlé, qui dégage de la chaleur à l'eau qui le pénètre.
Vitruve et matériaux de construction anciens
Dans le deuxième livre de ses « Dix Livres sur l'Architecture » écrit vers 30 avant JC, l' ancien maître d'œuvre Vitruve a formulé une science des matériaux de construction qui correspondait à la compréhension de son temps . Là, dans les 2e et 5e sections, il essaie de trouver une explication concluante de l'extinction de la chaux. Pour ce faire, il combine l' atomisme grec de Démocrite et d' Épicure avec les modèles géométriques de la matière de Pythagore pour créer une théorie de la matière complètement séparée : Pour Vitruve le monde se compose à la fois d'« atomes » et de vide (selon Démocrite/Épicure) et quatre éléments, qui pourtant (selon Pythagore) sont des solides géométriques. Donc pour lui les "atomes" sont identiques aux corps pythagoriciens et se meuvent dans le vide. Lors de la combustion de la chaux, les "atomes d'eau et d'air" quittent le calcaire, qui est considéré comme une structure en treillis constituée de corps pythagoriciens , de sorte que des "trous" sont créés. Vitruve explique la perte de poids lors de la combustion. Les « atomes de feu », en revanche, sont stockés. Lors de l'extinction, des "atomes d'eau" pénètrent par les "trous" du bloc de chaux et le "feu" stocké s'échappe. Le matériau lui-même restant inchangé, l'adhérence du sable dans le mortier se fait uniquement à travers les pores ainsi créés. Alors que cette explication était suffisante pour la pratique de la construction pure, l'incompatibilité des systèmes combinés par Vitruve - l' atomistique ne connaît pas de "corps atomiques" géométriquement différents, ressemblant à des blocs de construction - en particulier les théoriciens de l'architecture de la Renaissance qui l'ont mentionné, comme Cesare Cesariano et Daniele Barbaro , ont posé des énigmes supplémentaires.
Scaliger et Cardano
Au XVIe siècle, deux des plus grands mathématiciens de leur temps, Julius Caesar Scaliger et Gerolamo Cardano , se sont disputés pendant plusieurs années et ont publié des livres sur la nature exacte du monde. Alors que Gerolamo Cardano considérait la matière comme un continuum infini, dont la « densité » ne variait que d'un endroit à l'autre, Scaliger considérait que le « vide » était le facteur déterminant du cosmos et la cause de tout mouvement. Dans son ouvrage principal, De subtilitate ad Cardanum (1557), qui est dirigé contre l'adversaire , Scaliger introduit cette compréhension de la matière ( Exercitatio, 5,8-9 ) en n'utilisant rien d'autre que « l'énigme de la chaux éteinte » : le morceau de chaux absorbe de l'eau lorsqu'il s'éteint, ses pores ne peuvent contenir qu'un "vide", car "l'air" ne peut pas s'échapper vers le haut devant lui, car il rencontrerait immédiatement un autre "air" et serait ainsi bloqué.
Preuve individuelle
- ↑ Entrée sur HYDROXYDE CALCIUM dans la base de données CosIng de la Commission européenne, consulté le 24 Février, à 2020.
- ↑ Entrée sur E 526: hydroxyde de calcium dans la base de données européenne pour les additifs alimentaires, accès le 27 Juin, à 2020.
- ↑ a b c d e data sheet hydroxyde de calcium (PDF) de Merck , consulté le 4 avril 2012.
- ↑ a b c d e Entrée sur l'hydroxyde de calcium dans la base de données des substances GESTIS de l' IFA , consultée le 10 janvier 2017. (JavaScript requis)
- ↑ Caisse suisse d'assurance contre les accidents (Suva): Valeurs limites - valeurs MAK et BAT actuelles (recherche 1305-62-0 ou hydroxyde de calcium ), consulté le 2 novembre 2015.
- ↑ a b c Georg Brauer (Ed.), Avec la collaboration de Marianne Baudler et autres : Handbook of Preparative Inorganic Chemistry. 3e édition revue et corrigée. Tome II. Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , p. 926.
- ↑ Roland Pfestorf, Heinz Kadner : Chimie : Un manuel pour les collèges. ISBN 978-3-81711783-3 , page 368.
- ↑ Broché Chemical Substances , 3e édition. Harri Deutsch, Francfort a. M., 2007.
- ↑ Dr-Luthardt.de : valeur du pH et produit de solubilité de l'hydroxyde de calcium , consulté le 21 novembre 2019.
- ^ Article de l'asphalte 4/2010 sur schaeferkalk.de : Chaux hydratée dans l'asphalte. , récupéré le 28 février 2017.
- ↑ Felix Henke / Laura Thiemann, Vitruvius sur stuc et plâtre - les passages pertinents du 'decem libri de architectura' , in : Firmitas et Splendor. Vitruve et les techniques de la décoration murale , éd. par Erwin Emmerling, Andreas Grüner et al., Munich 2014 (études de la Chaire de restauration, Université technique de Munich , Faculté d'architecture) ISBN 978-3-935643-62-7 , pp. 13-125, y p. 55 .
- ↑ Thomas Reiser, la lixiviation de la chaux selon les théories anciennes et rinascimental de la matière. Notes sur Vitruve 2, 2 et 2, 5. Par Cesariano et Barbaro sur la querelle entre Scaliger et Cardano , dans : Firmitas et Splendor (2014), pp. 299-319, là pp. 303-304.
- ↑ Henke / Thiemann (2014), p. 57-59 ; Reiser (2014), p. 306-312.
- ↑ Reiser (2014), p. 314-317.