Trypanosomiase africaine
| Classification selon la CIM-10 | |
|---|---|
| B56.0 | Trypanosomiase gambiensis |
| B56.1 | Trypanosomiase rhodesiensis |
| B56.9 | Trypanosomiase africaine, sans précision |
| CIM-10 en ligne (version OMS 2019) | |
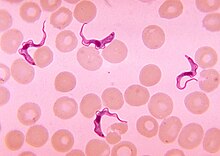
La trypanosomose africaine est un sous-type de brucei, une maladie tropicale déclenchée par Trypanosoma , également appelée maladie du sommeil (africaine) . Elle est présente dans les régions tropicales d'Afrique et est transmise par la mouche tsé-tsé . La maladie, une maladie protozoaire chronique, comporte trois stades : quelques semaines après l' infection , il y a de la fièvre , des frissons , un œdème , un gonflement des ganglions lymphatiques, ainsi qu'une éruption cutanée et des démangeaisons. Au deuxième stade, après quelques mois, les symptômes du système nerveux sont au premier plan : confusion, troubles de la coordination et du sommeil ainsi que des convulsions . Au stade final, le patient tombe dans un état crépusculaire somnolent ( somnolence ), qui a donné son nom à la maladie. L'agent pathogène est détecté au microscope dans le sang ou le liquide céphalo-rachidien et avec des méthodes immunologiques . Il existe plusieurs ingrédients actifs disponibles pour le traitement.
Agent pathogène
La maladie du sommeil est un protozoaire pathogène ( protozoaires ) du groupe des trypanosomes causés. Il existe deux types d'agents pathogènes :
- Trypanosoma brucei gambiense (agent causal de la maladie du sommeil ouest-africaine)
- Trypanosoma brucei rhodesiense (agent causal de la maladie du sommeil en Afrique de l'Est)
Le génome de Trypanosoma brucei a été séquencé en 2005 .
transmission
Les humains, les bovins et les antilopes servent de réservoirs pathogènes pour les trypanosomes . Contrairement au paludisme , les vecteurs de la maladie du sommeil sont des glossines diurnes , piqueuses et hématophages . En Afrique tropicale, on les trouve principalement dans les zones humides (rivières, marécages), mais aussi dans les paysages de savane sèche (ex. Kalahari ). La piqûre est très douloureuse et peut également se faire à travers les vêtements. Les agents pathogènes pénètrent dans le canal de piqûre avec la salive de la mouche. Il est sécrété par la mouche pour empêcher les processus de coagulation. Plusieurs milliers d'agents pathogènes sont transmis par une seule piqûre. Un seul trypanosome transféré pourrait suffire à déclencher la maladie. Les mouches freinantes et piqueuses pourraient (dans des cas particuliers) éventuellement jouer un rôle par transmission mécanique.
Risque d'infection
Toutes les mouches tsé-tsé ne sont pas porteuses de trypanosomes, de sorte que chaque morsure n'entraîne pas inévitablement une infection. Le risque d'infection par morsure varie fortement d'une région à l'autre et est en moyenne de l'ordre de 1 %, car le taux d'infection des glossines varie également fortement. Le risque augmente donc avec le nombre de piqûres. L'infection touche principalement la population locale, moins souvent les touristes.
Épidémiologie
La maladie du sommeil se produit avec un modèle de distribution régionale qui est difficile à déterminer dans toute la ceinture tropicale de l'Afrique. Selon les estimations de l' OMS , la maladie du sommeil touche plus de 500 000 personnes. En raison de la situation politique instable dans de nombreuses régions et des mouvements de réfugiés qui en résultent , le taux de maladie a augmenté ces dernières années.
Le réservoir du parasite de T. b. Selon Dönges (1988), gambiense se compose principalement de personnes infectées, peut-être seulement de manière latente, de certains animaux domestiques, en particulier de porcs domestiques (également dans Desowitz (1981) ) et du rat hamster géant Cricetomys gambianus ( souris à longue queue ). Piekarski (1962) nomme l'antilope parmi les animaux sauvages. Souvent T. b. gambiense n'est pas diagnostiqué chez l'homme au cours du 1er stade et le deuxième stade, plus difficile à traiter, suit (souvent seulement après des années).
T. b. rhodesiense a également été trouvé le plus fréquemment chez la Schirrantilope , suivie par les bovins domestiques , le bubale , le buffle d'Afrique , la hyène tachetée et le lion ( Dönges ). Dans une mesure plus limitée que dans T. b. gambiense , ici aussi, le malade est un réservoir d'agents pathogènes. Piekarski mentionne les chèvres et les moutons pour les deux sous - espèces de trypanosomes .
Quelles espèces animales jouent le rôle le plus important dans la transmission à l'homme n'a pas été clarifiée de manière concluante, car un réseau complexe d'autres paramètres épidémiologiques doit être pris en compte (par exemple 31 espèces de glossines avec des préférences pour certains animaux hôtes, ainsi que les saisons des pluies, facteurs sociaux, différentes souches pathogènes, etc.). Le risque d'infection est donc très différent localement et régionalement. Les réservoirs de parasites sont dans une large mesure également pertinents pour les trypanosomes qui causent ce que l'on appelle le nagana chez les animaux domestiques et de ferme africains .
Symptômes
L'évolution de la maladie dépend de l'agent causal. Dans le cas d'une infection à Trypanosoma brucei gambiense , l'évolution de la maladie est plus lente ; dans le cas d'une infection à Trypanosoma brucei rhodesiense , elle est généralement plus rapide et plus prononcée.
Stade I (phase hémolymphatique) : les trypanosomes pénètrent les cellules parenchymateuses du cerveau à partir du sang après seulement quelques heures sans aucun symptôme. Au cours de la première semaine suivant l'infection, une tuméfaction douloureuse avec une vésicule centrale, appelée chancre trypanosomienne , peut survenir au site d'injection . Cependant, ce symptôme ne survient que chez une fraction des personnes infectées (5 à 20 %). 1-3 semaines après l'infection commence la parasitémie réelle qui s'accompagne de fièvre, frissons, maux de tête et courbatures, œdème, démangeaisons, éruption cutanée et gonflement des ganglions lymphatiques . Souvent, ce gonflement des ganglions lymphatiques se produit à l'arrière des ganglions lymphatiques cervicaux ou sur le cou et est alors appelé signe Winterbottom . En outre, il existe une anémie et une thrombocytopénie , ainsi qu'une augmentation des taux d' immunoglobulines .
Stade II (phase méningo-encéphalitique) : Les premiers symptômes de pénétration dans le système nerveux central apparaissent environ 4 à 6 mois après l'infection (souvent après quelques semaines chez T. b. Rhodesiense) . Les patients souffrent d'états croissants de confusion, de troubles de la coordination et du sommeil, de convulsions , d' apathie et de perte de poids. Il peut se produire un trouble extrapyramidal ou une maladie semblable à la maladie de Parkinson.
Au stade terminal, les patients tombent dans un état crépusculaire continu qui a donné son nom à la maladie. La prolifération cellulaire ( pléocytose ) peut être détectée dans le liquide céphalo-rachidien . Après des mois ou des années, la maladie est mortelle.
Réponse immunitaire
Les trypanosomes sont entourés de glycoprotéines , appelées « glycoprotéines de surface variable » (VSG). Les VSG sont constamment modifiées par les organismes unicellulaires au cours de la reproduction, ce qui signifie qu'elles échappent à la réponse immunitaire de l'hôte ( variation antigénique ). Le génome du trypanosome code pour plus de 1000 gènes VSG différents qui sont exprimés alternativement . Bien que le système immunitaire humain puisse produire des anticorps contre les antigènes prédominants, il ne peut éliminer qu'une partie des agents pathogènes car de nouvelles variantes circulent déjà dans la circulation sanguine.
Une autre méthode de défense découverte par des scientifiques de la TU Darmstadt et de l'Institut Max Planck pour la dynamique et l'auto-organisation est l'absorption des anticorps par l'agent pathogène au moyen d'une fonction dynamique de flux. Les trypanosomes avancent dans la circulation sanguine à grande vitesse et dirigent les anticorps vers le pôle cellulaire arrière, où ils sont absorbés par endocytose , décomposés et donc privés de leur efficacité.
Diagnostic
Au stade I, les agents pathogènes sont détectés au microscope dans le sang (« goutte épaisse »), dans la ponction du chancre, dans l'aspirat de moelle osseuse ou au moyen d'une biopsie ganglionnaire . Pour exclure le stade II, si des parasites sont détectés, le liquide céphalo-rachidien est également examiné. ELISA , IFT et PHA/IHA sont utilisés comme méthodes d'immunodiagnostic . Surtout avec le T. b. gambiense à un stade avancé, la détection de l'agent pathogène dans le sang peut échouer.
la prévention
À l'heure actuelle, ni la prophylaxie médicamenteuse de la maladie du sommeil ni la vaccination préventive ne sont disponibles. Au milieu du siècle dernier, la pentamidine , injectée par voie intramusculaire , était utilisée avec succès comme prophylaxie. Cela a été efficace pendant au moins six mois ( T. b. Gambiense ). La seule prévention possible aujourd'hui est d'éviter les piqûres d'insectes. Les touristes doivent se protéger avec des répulsifs , des moustiquaires et des vêtements à manches longues. Il peut également être important de porter des vêtements de couleur claire, car la mouche tsé-tsé est particulièrement attirée par le bleu et le noir. Cependant, ces mesures ne réussissent que partiellement, car les glossines agissent de manière agressive et trouvent rapidement une place non protégée sur le corps.
thérapie
En raison de la toxicité des médicaments disponibles, la maladie du sommeil est traitée comme un patient hospitalisé dans la plupart des cas. Au stade II, des composés d'arsenic sont utilisés, ce qui déclenche des effets secondaires prononcés. La létalité ici peut aller jusqu'à 10 %.
- Stade I : administration de suramine ( T. b. Rhodesiense / gambiense ) ou de pentamidine ( T. b. Gambiense ). Les deux médicaments n'ont aucun effet sur les agents pathogènes du système nerveux central car ils ne traversent pas la barrière hémato-encéphalique .
- Stade II : Administration de mélarsoprol ou d' éflornithine , auparavant également de tryparsamide ( T. b. Gambiense ). Les deux médicaments agissent contre les agents pathogènes du système nerveux central, mais sont neurotoxiques .
En novembre 2018, un médicament avec l'ingrédient actif fexinidazole a été recommandé pour approbation en Europe , qui peut être pris sous forme de comprimé et guérit les patients dans les deux stades en dix jours. Le principe actif avait déjà été testé avec succès sur 750 patients en Afrique.
l'histoire
David Bruce a été l'un des premiers à faire des recherches sur l'épidémiologie de la maladie en Afrique.
L'agent pathogène ( Trypanosoma gambiense ) a été découvert par RM Forde et JE Dutton en 1901.
Sur la base des travaux de Harold Wolferstan Thomas et Anton Breinl , Robert Koch a étudié l'effet de l' Atoxyl contre la maladie. À partir de là, Paul Ehrlich a développé l' arsphénamine , qui a été testée pour la première fois par Werner von Raven au Togo . Avant la découverte des antibiotiques, le médicament contenant de l'arsenic, le stovarsolan, était utilisé comme agent chimiothérapeutique préventif .
Le premier médicament efficace contre la maladie du sommeil est la suramine ( Germanin , Bayer 205 ), développée par Bayer vers les années 1920 , dont la découverte a été utilisée à des fins de propagande en Allemagne à l' époque du national-socialisme .
Voir également
Littérature
- Sarah Ehlers : L' Europe et la maladie du sommeil. Lutte contre les maladies coloniales, identités européennes et médecine moderne 1890–1950 . Göttingen 2019, ISBN 978-3-525-31068-7 .
- Peter GE Kennedy : Caractéristiques cliniques, diagnostic et traitement de la trypanosomose humaine africaine (maladie du sommeil). Dans : The Lancet Neurology . 12, 2013, p. 186-194. doi: 10.1016 / S1474-4422 (12) 70296-X
- Stefan Winkle : Fléaux de l'humanité - histoire culturelle des épidémies. 3. Édition. Artemis & Winkler Verlag, 2005, ISBN 3-538-07159-4 .
liens web
- Trypanosomiase africaine. Dans : Orphanet (Base de données sur les maladies rares).
- Fiche d'information de l' OMS
- Informations sur la maladie du sommeil de Médecins Sans Frontières
- Informations du CDC (Anglais)
Preuve individuelle
- ↑ M. Berriman et al. Le génome du trypanosome africain Trypanosoma brucei. Dans : Sciences. 15 juillet 2005, 309 (5733), pp. 416-422. PMID 16020726
- ↑ T. Cherenet et al. : Prévalence saisonnière de la trypanosomose bovine dans une zone infestée de glossines et une zone indemne de glossines de la région d'Amhara, au nord-ouest de l'Éthiopie. Dans : Onderstepoort J Vet Res., décembre 2004, 71 (4), pp. 307-312. PMID 15732457 .
- ↑ C. Moll-Merks, H. Werner, J. Donges : Adéquation du xénodiagnostic in vitro : développement de Trypanosoma cruzi chez Triatoma infestans en fonction du stade larvaire des punaises et du nombre de trypomastigotes prélevés lors du repas sanguin in vitro. Dans : Zentralbl Bakteriol Mikrobiol Hyg [A]. mars 1988, 268 (1), p. 74-82. IDPM 3134769
- ↑ U. Frevert, A. Movila et al. Invasion précoce de parenchyme cérébral par les trypanosomes africains. Dans : PloS un. Volume 7, numéro 8, 2012, page E43913. doi: 10.1371 / journal.pone.0043913 . PMID 22952808 . PMC 3432051 (texte intégral gratuit).
- ↑ M. Engstler, T. Pfohl, S. Herminghaus, M. Boshart, G. Wiegertjes, N. Heddergott, P. Overath : tri hydrodynamique des protéines à médiation par le flux sur la surface cellulaire des trypanosomes. Dans : Cellule. Volume 131, numéro 3, novembre 2007, pp. 505-515, doi: 10.1016 / j.cell.2007.08.046 , PMID 17981118 .
- ↑ Le CHMP recommande le premier traitement par voie orale uniquement pour la maladie du sommeil | Agence européenne des médicaments. Consulté le 23 novembre 2018 .
- ↑ Céline Müller : Première thérapie orale contre la maladie du sommeil. Dans : Deutsche Apotheker Zeitung. 19 novembre 2018. Consulté le 20 novembre 2018 .
- ↑ Donald G. McNeil Jr. : Traitement rapide approuvé pour la maladie du sommeil, une maladie horrible. Dans : New York Times. 16 novembre 2018, consulté le 20 novembre 2018 .
- ↑ Werner Köhler : Maladies infectieuses. Dans : Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (dir.) : Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4 , pp. 667-671 ; ici : page 671.
- ↑ JL Kritschewsky, KA Friede: Les chimioprophylaxie de la fièvre récurrente et les maladies trypanosomes par la stovarsolan. Leipzig 1925.
- ^ Eva Anne Jacobi : Le médicament contre la maladie du sommeil Germanin comme instrument de propagande : Réception dans la littérature et le cinéma à l'époque du national-socialisme. Dans : Rapports sur les antécédents médicaux de Würzburg. Tome 29, 2010, p. 43-72.