Ligne spectrale
En tant que raies spectrales ou raies de résonance, des raies nettement séparées dans un spectre d' ondes électromagnétiques émises ( raies d'émission ) ou absorbées ( raies d'absorption ) , au sens plus étroit dans la gamme de longueurs d'onde de la lumière visible ( spectre lumineux ). Les raies spectrales sont caractérisées par leur longueur d' onde , leur intensité et leur largeur . La cause des raies spectrales sont les transitions électroniques excitées par la lumière dansAtomes ou molécules .
Le nom de ligne spectrale remonte historiquement au fait qu'il existe une fente d' entrée dans les spectromètres conventionnels , dont la forme se reflète sur l'écran ou dans l'œil du spectateur. Le nom a ensuite été également transféré aux pics (c'est-à-dire maxima) dans un spectre enregistré sous forme de courbe d'intensité.
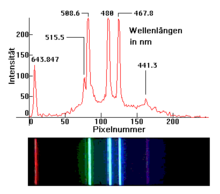
Les raies spectrales se produisent en spectroscopie atomique instrumentale (comme la spectroscopie par résonance magnétique nucléaire ) ou en coloration de flamme . Ils sont utilisés, entre autres, en astronomie pour analyser la structure moléculaire des étoiles , des planètes et de la matière interstellaire , ce qui serait autrement impossible. Ils étaient dans la réfraction de la lumière du soleil à travers un prisme découvert au 19ème siècle, à partir duquel se sont alors développés des spectroscopes qui permettent un large champ d'applications pour l' analyse spectrale .
Basiques
Une raie spectrale est la lumière d' une fréquence définie avec précision qui est émise (émise) ou absorbée (absorbée) par un atome ou une molécule en raison d'une transition d'un niveau d'énergie à un autre. La fréquence est déterminée par l' énergie du photon émis ou absorbé ; ceci est égal à la différence entre les énergies des deux états de la mécanique quantique . La fréquence est caractéristique de cette transition particulière dans le type d'atome donné. Par conséquent, on peut distinguer les types d'atomes en observant les raies spectrales.
Ligne d'émission
Une raie d' émission apparaît comme une raie lumineuse dans le spectre. Elle survient lors du passage d'un niveau d' énergie supérieur à un niveau d' énergie inférieur , par exemple lorsqu'un électron passe d'un état excité à l' état fondamental . Un photon est émis ici. Cela peut se produire soit spontanément ( émission spontanée ), soit, par exemple. B. avec laser , sont excités par la lumière d'une fréquence appropriée ( émission stimulée ).
Ligne d'absorption
Lorsque la lumière est irradiée avec un spectre continu (c'est-à-dire un mélange de fréquences), l'absorption par résonance des photons d'une fréquence appropriée se traduit par une raie d'absorption dans laquelle une transition d'un niveau d'énergie inférieur à un niveau d'énergie plus élevé est induite - par exemple, lorsqu'un électron passe à travers le photon de la bande de valence dans la bande de conduction est "soulevé" (voir effet photoélectrique ).
En retombant au niveau d'énergie inférieur, les photons deviennent isotropes , i. H. dans n'importe quelle direction, émis.
Ces deux éléments conduisent à la diffusion de la lumière par le matériau irradié à cette fréquence . Tant qu'il y a suffisamment d'atomes absorbants, cela se produit
- une ligne sombre dans le spectre continu de la lumière qui brille à travers ( ligne de Fraunhofer ); c'est généralement ce que l'on entend par le terme ligne d'absorption
- une ligne claire sur un fond sombre lors de l'analyse de la lumière diffusée sortant du côté du gaz; ce type de ligne lumineuse n'est pas appelé une ligne d' émission en raison de la terminologie historique ; Les lignes ne sont désignées comme telles que si l'excitation n'a pas été faite par la lumière de la même fréquence .
Profils d'émission
La lumière d'une raie spectrale ne contient pas une seule fréquence nettement définie, mais comprend une plage de fréquences (étroite). La demi- largeur de cette zone est appelée largeur de ligne . La largeur de ligne d'une raie d'émission est composée de plusieurs contributions:
- Profil de Lorentz
- La largeur de ligne naturelle résulte de la durée de vie de l' état initial selon le principe d'incertitude de Heisenberg . Cela a la forme d'une courbe de Lorentz . Il n'est pas possible de réduire cela.
- Profil gaussien
- Le mouvement thermique des atomes crée un effet Doppler qui déplace la lumière d'un atome ou d'une molécule individuelle vers le rouge ou le bleu, selon la direction du mouvement. Le mouvement statistique conduit à une distribution de fréquence plus large dans l'ensemble. Cet effet est appelé élargissement Doppler . Il a la forme d'une courbe gaussienne et dépend de la température . Habituellement, la largeur Doppler domine clairement la largeur de ligne naturelle. Le mécanisme est également connu sous le terme d' élargissement de ligne non homogène .
- Profil Voigt
- Lors d'une mesure, une courbe de Lorentz de largeur finie semble avoir changé de sa forme connue si la fonction d'appareil du dispositif de mesure a une demi- largeur de l'ordre de grandeur de la courbe de Lorentz considérée. La forme de la ligne peut alors être décrite par la convolution de la courbe de Lorentz et la fonction de l'appareil. Si la fonction de l'appareil est une courbe gaussienne, le résultat de la convolution est appelé un profil de Voigt .
l'histoire
Les raies d'absorption ont été découvertes pour la première fois en 1802 par William Hyde Wollaston et en 1814, indépendamment de lui, par Joseph von Fraunhofer dans le spectre du soleil . Ces lignes sombres du spectre solaire sont également appelées lignes de Fraunhofer .
Les raies spectrales, entre autres effets, ont contribué au développement de la mécanique quantique . Selon l'électrodynamique classique , un électron lié dans un atome pouvait émettre des ondes électromagnétiques de n'importe quelle fréquence; l'existence de lignes discrètes ne peut être expliquée de manière classique. La découverte que les fréquences des raies spectrales de l' atome d'hydrogène sont proportionnelles à une expression de la forme avec des entiers et a conduit au concept de nombre quantique et a finalement amené Niels Bohr à son modèle de Bohr de l'atome , le premier - désormais obsolète - modèle atomique de mécanique quantique. La mécanique quantique moderne peut prédire les raies spectrales des atomes avec un très haut degré de précision.
Littérature
- Heinz Haferkorn : Optique. Bases et applications physico-techniques. 4e édition, Wiley-VCH 2003, ISBN 3-527-40372-8
- Ingolf Volker Hertel , Claus-Peter Schulz: Atomes, molécules et physique optique 1 . Springer 2008, ISBN 978-3-540-30617-7
- Peter M. Skrabal: Spectroscopie , vdf Verlag, 2009, ISBN 978-3-8252-8355-1




