Angle de liaison
En chimie et en physique moléculaire, l' angle de liaison est l' angle entre les liaisons covalentes d' un atome avec deux atomes voisins. Il dépend essentiellement des orbitales atomiques impliquées dans les liaisons, mais peut être influencé dans une certaine mesure par des interactions stériques . Les angles de liaison et donc les structures géométriques d'une molécule peuvent être expliqués à l'aide du modèle VSEPR . Pour les composés qui contiennent des éléments des sous-groupes, cependant, le modèle VSEPR échoue généralement.
Pour les angles de liaison entre atomes dans les molécules dont les orbitales sont hybridées, il existe des angles théoriques spécifiques (pseudostructure):
- sp 3 - les orbitales hybrides dans les molécules s'alignent les unes avec les autres à un angle tétraédrique de 109,5 °.
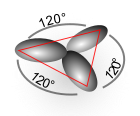
- Les orbitales hybrides sp 2 sont planes-trigonales l'une par rapport à l'autre et forment un angle de 120 °.
- Les orbitales hybrides sp s'alignent linéairement, ce qui donne un angle de liaison de 180 °.
Pseudo structure à
SP 3 - orbitales hybrides
Les angles de liaison réels (structure réelle) dans de nombreuses molécules qui ont une structure tétraédrique, trigonale ou linéaire, diffèrent cependant à des degrés différents des angles mentionnés ci-dessus (pseudo structure). L'angle de liaison réel dans la molécule d'eau n'est pas de 109,5 °, mais de 104,45 °, car les paires d'électrons non liées repoussent légèrement celles qui se lient. Il existe également un angle différent de 107 ° dans la molécule d'ammoniaque . L'écart est plus petit que dans la molécule d'eau, car l'ammoniac n'a qu'une seule paire d'électrons libres.
Une méthode pour mesurer les angles de liaison est la spectroscopie RMN . La dépendance de la constante de couplage et de l'angle de liaison entre deux liaisons CH qui se produit en RMN est appelée relation Karplus d' après son découvreur Martin Karplus . Les vibrations moléculaires impliquent généralement une déformation périodique des angles de liaison.
Voir également
Preuve individuelle
- ↑ a b c d Theodore L. Brown, Bruce Edward Bursten, Harold Eugene LeMay: Compact d'étude de chimie . Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-122-7 , pp. 343 ( aperçu limité dans la recherche de livres Google).
- ↑ Richard E. Dickerson: Principes de chimie . Walter de Gruyter, 1988, ISBN 978-3-11-009969-0 , p. 488 ( aperçu limité dans la recherche de livres Google).
- ↑ Erwin Riedel , Christoph Janiak : Chimie inorganique . Walter de Gruyter GmbH & Co KG, 2015, ISBN 978-3-11-035528-4 , p. 106 ( aperçu limité dans la recherche de livres Google).
- ^ Thomas Hill: Connaissance de l'examen Physikum . Georg Thieme Verlag, 2009, ISBN 3-13-152131-7 , p. 399 ( aperçu limité dans la recherche de livres Google).
- ↑ Arthur Beiser: Atomes, molécules, solides . Springer-Verlag, 2013, ISBN 978-3-322-91105-6 , p. 134 ( aperçu limité dans la recherche de livres Google).
- ↑ Paula Yurkanis Bruice: étude compacte de chimie organique . Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-102-9 , p. 491, 551 ( aperçu limité dans la recherche de livres Google).