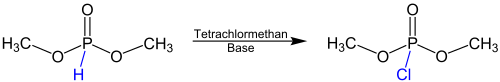
Réaction Atherton-Todd
La réaction Atherton-Todd est une réaction de nom en chimie organique qui remonte aux chimistes britanniques FR Atherton, HT Openshaw et AR Todd . Ils ont d'abord décrit la réaction en 1945 comme une méthode de conversion de phosphites de dialkyle en chlorophosphates de dialkyle. Les chlorophosphates de dialkyle formés sont souvent trop réactifs pour être isolés . Pour cette raison, en présence d' alcools ou d' amines, la synthèse de phosphates ou de phosphoramidates peut suivre la réaction d'Atherton-Todd.
Réaction d'ensemble
L'équation de réaction suivante donne un aperçu de la réaction d'Atherton-Todd en utilisant l'exemple du diméthylphosphite comme réactif :
La réaction a lieu avec l'addition de tétrachlorure de carbone et d'une base . Cette base est généralement une amine primaire , secondaire ou tertiaire . Au lieu des groupes méthyle , d'autres groupes alkyle ou groupes benzyle peuvent également être présents.
Mécanisme de réaction
Un mécanisme de réaction possible pour la réaction d'Atherton-Todd sera expliqué conformément à la réaction d'ensemble en utilisant l'exemple du composé de départ diméthylphosphite:
Tout d'abord, une amine tertiaire est utilisée pour séparer un groupe méthyle du diméthylphosphite . L'étape intermédiaire 1 résulte de cette étape de réaction .
Ceci est suivi par la protonation de l'intermédiaire 1 par le composé de départ diméthylphosphite. À son tour, celui-ci est déprotoné, de sorte que l'étage intermédiaire 2a et l'étage intermédiaire 2b sont formés. Puis l' étage intermédiaire 1 est récupéré de l'étage intermédiaire 2a .
Enfin, l'intermédiaire 2b est chloré à l' aide de tétrachlorure de carbone et du diméthyl chlorophosphate 3 se forme .
Déroulement ultérieur possible de la réaction
Après la synthèse du diméthyl chlorophosphate, une autre réaction, par exemple avec une amine primaire (par exemple l' aniline ), est possible selon l'équation de réaction suivante:
Économie atomique
En plus du phosphite de dialkyle, le composé de départ utilisé dans cette réaction est le tétrachlorométhane en quantité stoechiométrique et une base (amine). En même temps, le composé de départ lui-même est utilisé comme réactif , mais pas en quantité stoechiométrique. Ainsi, seul le chloroforme , qui émerge du tétrachlorure de carbone après deux étapes de réaction, est pertinent comme déchet pour évaluer l' économie atomique . Il faut également garder à l'esprit que le produit de la réaction a une masse molaire plus grande que le composé de départ. L'économie atomique de cette réaction peut donc être qualifiée de relativement bonne.
Voir également
La réaction d'Atherton-Todd est liée à la réaction d'Appel . Ici aussi, le tétrachlorométhane est utilisé pour la chloration .
Preuve individuelle
- ^ FR Atherton, HT Openshaw, AR Todd: 174. Études sur la phosphorylation. Partie II: La réaction des dialkylphosphites avec des composés polyhalogénés en présence de bases. Une nouvelle méthode pour la phosphorylation des amines . Dans: Journal of the Chemical Society (Resumé) . 1945, p. 660-663 , doi : 10.1039 / jr9450000660 .
- ↑ a b Zerong Wang: Réactions et réactifs de nom organique complet Volume 1 . John Wiley, Hoboken (NJ) 2009, ISBN 978-0-470-28662-3 , pp. 114-118 .
- ^ Stéphanie S. Le Corre, Mathieu Berchel, Hélène Couthon-Gourvès, Jean-Pierre Haelters, Paul-Alain Jaffrès: Atherton - réaction Todd: mécanisme, la portée et les applications . Dans: Beilstein Journal of Organic Chemistry . ruban 10 , non. 1 , 2014, p. 1166-1196 , doi : 10.3762 / bjoc.10.117 .