Oxyde de cuivre
| Structure en cristal | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| __ Cu 2+ __ O 2− | ||||||||||||||||||||||
| Système de cristal |
monoclinique |
|||||||||||||||||||||
| Groupe d'espace |
C 2 / c (n° 15) |
|||||||||||||||||||||
| Général | ||||||||||||||||||||||
| Nom de famille | Oxyde de cuivre | |||||||||||||||||||||
| Autres noms |
|
|||||||||||||||||||||
| Formule de ratio | CuO | |||||||||||||||||||||
| Brève description |
solide noir, amorphe ou cristallin |
|||||||||||||||||||||
| Identifiants externes / bases de données | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propriétés | ||||||||||||||||||||||
| Masse molaire | 79,545 g mol -1 | |||||||||||||||||||||
| État physique |
fixé |
|||||||||||||||||||||
| densité |
6,48 g cm -3 |
|||||||||||||||||||||
| Point de fusion |
1326°C |
|||||||||||||||||||||
| point d'ébullition |
décomposition thermique : 1026°C |
|||||||||||||||||||||
| solubilité |
presque insoluble dans l'eau, soluble dans les acides dilués, soluble dans l'hydroxyde d'ammonium |
|||||||||||||||||||||
| consignes de sécurité | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
0,1 mg m -3 (mesuré en tant que fraction d'aérosol inhalable) |
|||||||||||||||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | ||||||||||||||||||||||
Cuivre (II) oxyde (anciennement connu sous le carbonate de cuivre , la rouille du cuivre , du cuivre brûlé et cuivre marteau coup ou cuivre soufflage , ainsi que de la chaux de cuivre et latine aes ustum ) est un composé chimique qui contient du cuivre et de l' oxygène . Dans cet oxyde de formule empirique CuO, le cuivre est divalent . L'oxyde de cuivre (II) est un solide noir, amorphe ou cristallin.
Arriver
L'oxyde de cuivre (II) se produit naturellement sous forme de ténorite minérale . La ténorite est formée à partir de l' altération des sulfures de cuivre et se trouve donc généralement dans les parties oxydées des gisements de cuivre. Le minéral porte le nom du botaniste italien Michele Tenore .
Extraction et présentation
L'oxyde de cuivre (II) peut être produit par décomposition thermique ( pyrolyse ) du nitrate de cuivre (II) ou du carbonate basique de cuivre .
L'oxyde de cuivre (II) peut également être produit en chauffant de l' hydroxyde de cuivre (II) (fraîchement précipité) . L'hydroxyde de cuivre (II) est précipité en ajoutant des hydroxydes de métaux alcalins à une solution de sel de Cu (II).
L'oxyde de cuivre (II) se forme avec l'oxyde de cuivre (I) lorsque le cuivre métallique est chauffé à la chaleur rouge dans l'air.
Anciennement Aes ustum obtenu en plaçant des feuilles de cuivre en couches avec du sel de table dans un creuset refermable et en recuit pendant douze heures. Le résidu à l'allumage a été pulvérisé et lessivé avec de l'eau.
Propriétés
L'oxyde de cuivre (II) est insoluble dans l' eau et les alcools . En revanche, il est soluble dans les acides dilués . Les sels de cuivre (II) correspondants peuvent être obtenus par évaporation. L'oxyde de cuivre (II) est soluble dans l' eau ammoniacale , formant des complexes.
L'oxyde de cuivre (II) adsorbe facilement l'oxygène, l' azote , le dioxyde de carbone et d'autres gaz .
Lorsqu'il est chauffé au-dessus d'environ 800°C, l'oxyde de cuivre (II) est réduit en oxyde de cuivre (I) avec dégagement d'oxygène.
Si le cuivre métallique et l'oxyde de cuivre (II) sont chauffés ensemble , de l'oxyde de cuivre (I) se forme également.
À des températures élevées, l'oxyde de cuivre (II) est réduit en cuivre métallique par divers agents réducteurs (par exemple le carbone , le monoxyde de carbone , l' hydrogène ).
Lorsque l'oxyde de cuivre (II) est chauffé avec du fluorure d'hydrogène à 400 ° C, il se forme du fluorure de cuivre (II) .
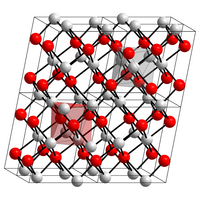
Il a une monoclinique structure cristalline avec le groupe d' espace C 2 / c (groupe spatial no. 15) (a = 4,683 Å , b = 3,423 Â, c = 5,129 Å, β = 95,54 °). Son enthalpie de formation est de −155,8 kJ/mol.
utilisation
L'oxyde de cuivre (II) est utilisé comme pigment pour colorer le verre , la céramique , la porcelaine et les pierres précieuses artificielles . De plus, il est utilisé comme matériau cathodique dans les batteries , comme catalyseur , pour la désulfuration du pétrole brut et des peintures antifouling. L'oxyde de cuivre (II) est également utilisé comme matière première pour la production de divers composés du cuivre. Depuis la découverte de la supraconductivité des composés de La 2 CuO 4 (dopé au strontium) et la découverte ultérieure de plus d'une centaine de composés similaires, dont la plupart ne peuvent se passer de cuivre et d'oxygène, l'oxyde de cuivre (II) est également utilisé pour la Supraconducteurs céramiques utilisés, qui sont considérés comme des matériaux d'avenir.
Preuve individuelle
- ↑ a b c d e f g Entrée sur l'oxyde de cuivre (II) dans la base de données des substances GESTIS de l' IFA , consultée le 7 décembre 2019. (JavaScript requis)
- ↑ Entrée sur les oxydes de cuivre. Dans : Römpp en ligne . Georg Thieme Verlag, consulté le 13 juin 2014.
- ↑ Entrée sur l'oxyde de cuivre (II) dans l' inventaire des classifications et étiquetages de l' Agence européenne des produits chimiques (ECHA), consulté le 17 juin 2017. Les fabricants ou les distributeurs peuvent étendre la classification et l'étiquetage harmonisés .
- ↑ Emil Ernst Ploß : Un livre aux couleurs anciennes. Technologie des couleurs textiles au Moyen Âge avec un regard sur les couleurs unies. 6e édition Munich 1989, ISBN 978-3-89164-060-9 .
- ^ Wolfgang Schneider : Produits chimiques et minéraux pharmaceutiques. Suppléments (au tome III du Lexique pour l'histoire des médicaments). Francfort-sur-le-Main 1975, page 85.
- ↑ Otto Zekert (Ed.) : Dispensatorium pro pharmacopoeis Viennensibus en Autriche 1570. Edité par l'Association des pharmaciens autrichiens et la Société pour l'histoire de la pharmacie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, page 133 ( Aes ).
- ↑ Mindat: Tenorite (Eng.)
- ↑ Otto Zekert (Ed.) : Dispensatorium pro pharmacopoeis Viennensibus en Autriche 1570. Edité par l'Association des pharmaciens autrichiens et la Société pour l'histoire de la pharmacie. Deutscher Apotheker-Verlag Hans Hösel, Berlin 1938, page 133.
- ↑ Georg Brauer (Ed.), Avec la collaboration de Marianne Baudler et autres : Handbook of Preparative Inorganic Chemistry. 3e édition revue et corrigée. Tome II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , page 979.












