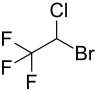
Halothane
| Formule structurelle | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Formule développée sans stéréochimie | ||||||||||||||||||||||
| Général | ||||||||||||||||||||||
| Dénomination commune | Halothane | |||||||||||||||||||||
| Autres noms |
2-bromo-2-chloro-1,1,1-trifluoroéthane |
|||||||||||||||||||||
| Formule moléculaire | C 2 HBrClF 3 | |||||||||||||||||||||
| Brève description |
liquide incolore et volatil avec une odeur sucrée |
|||||||||||||||||||||
| Identifiants externes / bases de données | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Informations sur les médicaments | ||||||||||||||||||||||
| code ATC | ||||||||||||||||||||||
| Classe de médicament | ||||||||||||||||||||||
| Propriétés | ||||||||||||||||||||||
| Masse molaire | 197,39 g mol -1 | |||||||||||||||||||||
| État physique |
fluide |
|||||||||||||||||||||
| densité |
1,871 g cm -3 |
|||||||||||||||||||||
| Point de fusion |
-118 °C |
|||||||||||||||||||||
| point d'ébullition |
50,2 °C |
|||||||||||||||||||||
| La pression de vapeur |
324 h Pa (20 ° C) |
|||||||||||||||||||||
| solubilité |
|
|||||||||||||||||||||
| Indice de réfraction |
1.3697 |
|||||||||||||||||||||
| consignes de sécurité | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
|
|||||||||||||||||||||
| Données toxicologiques |
29 000 ppm ( CL 50 , rat , inhalation ) |
|||||||||||||||||||||
| Potentiel de réchauffement planétaire |
50 (basé sur 100 ans) |
|||||||||||||||||||||
| Propriétés thermodynamiques | ||||||||||||||||||||||
| H f 0 |
−720,0 kJ / mol |
|||||||||||||||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . Indice de réfraction : raie Na-D , 20°C | ||||||||||||||||||||||
L'halothane est un hydrocarbure halogéné qui a été synthétisé par Charles Suckling en 1951 pour Imperial Chemical Industries . Depuis sa première application clinique sous le nom commercial de Fluothane le 20 janvier 1956 par J. Raventos et Michael Johnstone à Manchester , il a été utilisé comme le premier anesthésique halogéné par inhalation après le chloroforme à être administré par les voies respiratoires et largement remplacé. éther dès 1957 . En Europe et aux États - Unis , 20 à 25 ans plus tard, l' halothane a été largement remplacé par les nouveaux anesthésiques halogénés ( flurans tels que l' isoflurane , le sévoflurane et le desflurane ). L' halothane a été ajouté à la liste des médicaments essentiels de l' Organisation mondiale de la santé en 1997 .
L'utilisation d'halothane peut entraîner une hyperthermie maligne .
Extraction et présentation
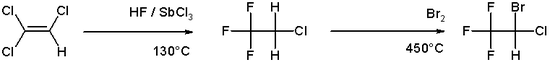
La synthèse industrielle de l'halothane est basée sur le trichloroéthylène , qui réagit avec le fluorure d'hydrogène en présence de trichlorure d'antimoine à 130°C pour former le 2-chloro-1,1,1-trifluoroéthane . Celui-ci réagit alors avec le brome à 450°C pour former de l'halothane.
Propriétés
Propriétés recherchées
L'halothane est un liquide incolore avec une odeur sucrée. L'halothane étant très sensible à la lumière, il est généralement stocké dans des bouteilles brunes. L'halothane est facilement soluble dans le sang et les graisses. L'halothane monte et descend très rapidement dans le sang , c'est pourquoi il convient particulièrement comme anesthésique . De plus, il ne forme pas de mélanges explosifs, peut être combiné avec du protoxyde d'azote (N 2 O) (réduction de dose possible) et est un anesthésique par inhalation extrêmement puissant. La plage thérapeutique est d'environ 0,5 à 1 % atm. Concentration alvéolaire.
Propriétés indésirables
Comme presque tous les stupéfiants, l'halothane a un index thérapeutique étroit et provoque une chute dose-dépendante de la pression artérielle. La fréquence cardiaque reste la même ou diminue avec l'halothane. De plus, l'halothane sensibilise le myocarde aux catécholamines , c'est pourquoi des tachycardies peuvent également survenir. Lorsqu'ils sont métabolisés (environ 15 à 20 %) dans le foie, des ions bromure sont libérés, qui, en grande quantité, ont un effet toxique, peuvent déclencher des allergies et supprimer le système immunitaire. Dans de rares cas (1 : 10000), une hépatite à l'halothane se développe (comme une réaction allergique), c'est pourquoi il est recommandé que les patients ne soient anesthésiés à l'halothane que tous les trois mois. Il faut noter ici que le personnel, contrairement au patient, peut être très stressant.
L'halothane devient de moins en moins important en tant que stupéfiant car les éthers halogénés tels que l' enflurane , l' isoflurane ou le sévoflurane ont des propriétés pharmacologiques nettement meilleures.
La durée de vie dans l'atmosphère est d'un an, le potentiel de réchauffement global (PRP) de 50 et les émissions sont de 250 tonnes par an.
Appellations commerciales
Fluothane (D, aH), Narcotan (D, aH), Halothane BP (CH, aH)
Littérature
- Erich Kirchner (éd.) : 20 ans de Fluothane. Springer, Berlin 1978 (= Anesthesiology and Intensive Care Medicine. Volume 109), ISBN 978-3-540-08602-4 .
- Max S. Sadove, Vernon E. Wallace : Halothane. Publications scientifiques Blackwell, Oxford 1962.
Preuve individuelle
- ↑ a b c d e f g Entrée sur le 2-bromo-2-chloro-1,1,1-trifluoroéthane dans la base de données des substances GESTIS de l' IFA , consultée le 9 janvier 2019. (JavaScript requis)
- ↑ a b c Entrée sur l' halothane dans la base de données ChemIDplus de la National Library of Medicine (NLM) des États-Unis
- ↑ a b Entrée sur halothane. Dans : Römpp Online . Georg Thieme Verlag, consulté le 25 décembre 2014.
- ↑ Caisse suisse d'assurance contre les accidents (Suva) : Valeurs limites - valeurs MAK et BAT actuelles (recherche 151-67-7 ou halothane ), consulté le 2 novembre 2015.
- ↑ G. Myhre, D. Shindell et al. : Climate Change 2013 : The Physical Science Basis . Contribution du Groupe de travail I au cinquième rapport d'évaluation du GIEC. Ed. : Groupe d'experts intergouvernemental sur l'évolution du climat . 2013, Chapitre 8 : Forçage radiatif anthropique et naturel, pp. 24-39 ; Tableau 8.SM.16 ( PDF ).
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, pp. 5-21.
- ↑ M. Johnstone : La réponse cardiovasculaire humaine à l'anesthésie au fluothane. Dans : British Journal of Anesthesiology. Volume 28, n° 9, pp. 392-410.
- ↑ Otto Mayrhofer : Réflexions sur le 150e anniversaire de l'anesthésie. Dans : L'anesthésiste. Volume 45, 1996, p. 881-883, ici : p. 882.
- ↑ Suckling et al : PROCEDE DE PREPARATION DU 1,1,1-TRIFLUORO-2-BROMO-2-CHLOROETHANE. Brevet américain 2921098, accordé en janvier 1960, cédé à Imperial Chemical Industries.
- ↑ HH Frey, W. Löscher : Manuel de pharmacologie et de toxicologie pour la médecine vétérinaire. 2e édition. Enke Verlag, 2007, ISBN 3-8304-1070-0 ( aperçu limité dans la recherche de livres Google).
- ↑ Reinhard Larsen : Anesthésie et médecine intensive en chirurgie cardiaque, thoracique et vasculaire. (1ère édition 1986) 5ème édition. Springer, Berlin/Heidelberg/New York et autres 1999, ISBN 3-540-65024-5 , pp.3-6 ; ici : p.3 s.
- ↑ Martin K. Vollmer, Tae Siek Rhee, Matt Rigby, Doris Hofstetter, Matthias Hill, Fabian Schoenenberger, Stefan Reimann : Anesthésiques par inhalation modernes : Gaz à effet de serre puissants dans l'atmosphère globale . Dans : Lettres de recherche géophysique . 42, n° 5, 2015, page 1606. doi : 10.1002 / 2014GL062785 .