glucose
| Formule structurelle | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
|
D- glucose (à gauche) et L- glucose (à droite)
Projection de Fischer , représentation en chaîne ouverte | |||||||||
| Général | |||||||||
| Nom de famille | glucose | ||||||||
| Autres noms |
|
||||||||
| Formule moléculaire | C 6 H 12 O 6 | ||||||||
| Brève description |
D -glucose : |
||||||||
| Identifiants externes / bases de données | |||||||||
| |||||||||
| Informations sur les médicaments | |||||||||
| code ATC | |||||||||
| Propriétés | |||||||||
| Masse molaire | 180,16 g mol -1 | ||||||||
| État physique |
fixé |
||||||||
| densité |
1,562 g cm -3 |
||||||||
| Point de fusion | |||||||||
| solubilité |
bon dans l'eau (470 g l -1 à 20°C) |
||||||||
| consignes de sécurité | |||||||||
| |||||||||
| Données toxicologiques | |||||||||
| Dans la mesure du possible et d'usage, les unités SI sont utilisées. Sauf indication contraire, les données fournies s'appliquent à des conditions standard . | |||||||||
Le glucose (abréviation : Glc ) ou glucose (du grec γλυκύς 'sucré', et -ose comme suffixe pour sucre) est un glucide d'origine naturelle . Parmi les énantiomères du glucose , le D- glucose est la forme naturelle. Il est également connu sous le nom de glucose ou d'ingrédients alimentaires sous le nom de dextrose et est le monosaccharide le plus abondant (sucre simple). Le L- glucose peut être représenté synthétiquement, mais a peu d'importance (pour une explication des désignations « D » et « L » voir projection de Fischer ). Si le glucose est mentionné sans aucun nom supplémentaire ( préfixe ), il s'agit du D- glucose .
Dans les organismes vivants, le glucose est la principale source d'énergie. Il est stocké sous forme de glucane polymère , chez les animaux sous forme de glycogène et dans les plantes sous forme d' amidon . En tant que composant de la cellulose , c'est le composant principal des parois cellulaires végétales et donc le glucide le plus courant. Le glucose est utilisé dans les solutions de perfusion médicales et est considéré comme un médicament essentiel .
histoire
Le glucose a été isolé pour la première fois à partir de raisins secs en 1747 par Andreas Sigismund Marggraf . Il a été isolé du raisin par Johann Tobias Lowitz en 1792 et reconnu comme différent du sucre de canne ( saccharose ). Le glucose est le terme inventé par Jean Baptiste Dumas en 1838, qui s'est imposé dans la littérature chimique. Par Friedrich August Kekule, la proposition de dextrose vient (du latin dexter = droit), comme le glucose en solution aqueuse, le plan de la lumière polarisée linéairement vers la droite . En revanche, le D - fructose (un cétohexose ) et le L- glucose font tourner la lumière polarisée linéairement vers la gauche . La nomenclature précédente d et l basée sur celle-ci a été abandonnée au profit de la notation D et L , qui fait référence à la configuration absolue du centre asymétrique le plus éloigné du groupe carbonyle, et à celle des correspondances D ou L- glycéraldéhyde.
La structure du glucose et les relations structurelles avec les autres monosaccharides ont été décrites par Emil Fischer entre 1891 et 1894 à l' aide de la projection de Fischer et ont représenté une étape importante dans la chimie des produits naturels , pour laquelle il a reçu le prix Nobel de chimie en 1902 . Sa première synthèse réussie de glucose a confirmé les théories de Jacobus Henricus van 't Hoff sur l' arrangement tétraédrique des liaisons chimiques dans les composés organiques du carbone et sur la cinétique chimique . Les connaissances ainsi obtenues ont permis d'introduire une nomenclature systématique des glucides stéréoisomères utilisant des noms conventionnels en référence à leur symétrie spatiale (e.g. nomenclature Fischer, nomenclature D / L ).
Otto Meyerhof a reçu le prix Nobel de physiologie ou médecine en 1922 pour sa découverte du métabolisme du glucose . Hans von Euler-Chelpin , avec Arthur Harden, a reçu le prix Nobel de chimie en 1929 pour leurs recherches sur « la fermentation du sucre et comment les enzymes contribuent à ce processus ». En 1947, Carl et Gerty Cori ont reçu le prix Nobel de physiologie ou médecine pour leur découverte du recyclage de l'acide lactique produit dans le muscle par la glycolyse pour la gluconéogenèse et la synthèse du glycogène dans le foie, et Bernardo Houssay pour sa découverte du rôle des hormones hypophysaires. dans le métabolisme du glucose. Luis Leloir a reçu le prix Nobel de chimie en 1970 pour sa découverte des nucléotides de sucre formés à partir du glucose lors de la biosynthèse des glucides .
Propriétés
Le glucose est généralement sous forme solide sous forme d'un cycle pyrane fermé mono hydraté avant ( Hydratdextrose ). En solution aqueuse, par contre, il est à chaîne ouverte dans une faible mesure et se présente principalement sous la forme d'a- ou de -pyranose, dont certains fusionnent les uns avec les autres par mutarotation. Les trois formes connues peuvent être cristallisées à partir de solutions aqueuses : l'α-glucopyranose, l'β-glucopyranose et l'β-glucopyranose hydraté. Le glucose est un composant du double sucre lactose (sucre du lait), du saccharose (sucre de canne ou de betterave) et du maltose ainsi que des sucres multiples tels que le raffinose et des sucres multiples tels que l' amidon et l' amylopectine , le glycogène et la cellulose . La température de transition vitreuse de glucose est de 31 ° C et la constante de Gordon-Taylor (e déterminée expérimentalement constante de prédiction de la température de transition vitreuse à différentes fractions de masse de mélange de deux substances) est de 4,5.
Le glucose est probablement le monosaccharide naturel le plus courant car il réagit moins avec les protéines via la glycation que les autres monosaccharides. Une autre hypothèse est qu'avec le glucose sous forme de β- D- glucose comme seul D- aldohexose, les cinq substituants hydroxy sont en position équatoriale et sont donc plus facilement accessibles pour des réactions chimiques, par exemple pour l'estérification ou la formation d'acétal. Pour cette raison, le D- glucose est également le bloc de construction le plus préféré dans les polysaccharides naturels (glycanes).
Systématique du glucose
| Différentes formes et représentations du D- glucose en comparaison | ||
|---|---|---|
| Formule compensée | notation de Haworth | |

|
 α- D- glucofuranose |
 β- D- glucofuranose |
 α- D- glucopyranose |
 β- D- glucopyranose |
|
| α- D -glucopyranose dans (1) Tollens / Fischer (2) Haworth (3) représentation en fauteuil (4) vue stéréochimique | ||

| ||
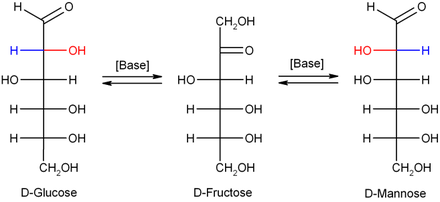
La représentation du α- montré ci-dessus D -glucose comme α- D -glucopyranose, voir 2 est, en outre, sa projection Haworth appelée et dessiné le nouvel anneau formé dans cette illustration pour plus de commodité (qui peut ne pas correspondre à la réalité, par de nombreuses fins mais est suffisant). À la suite de la fermeture du cycle, le premier atome de carbone devient un nouveau centre chiral supplémentaire , avec pour résultat qu'une paire d' anomères devient possible - des sucres stéréoisomères qui ne diffèrent par la configuration qu'au niveau de leur centre chiral nouvellement formé pendant la fermeture du cycle et donc un cas particulier Sont des épimères .
La structure dans laquelle le groupe OH nouvellement créé de l' hémiacétal pointe « vers le bas » dans sa projection de Haworth (axialement) est appelée α- D -glucose, qui avec le groupe OH (équatorial) « vers le haut » pointe comme β- D - glucose. En général, dans le cas des sucres -anomères, le groupe OH nouvellement formé lorsque le cycle se ferme se trouve dans la projection de Haworth du côté du plan du cycle opposé au groupe terminal CH 2 OH, alors que dans la forme il se trouve sur le même côté. Incidemment, cette définition s'applique également de la même manière à tous les autres sucres D et L ainsi que - à condition que le groupe terminal CH 2 OH ne soit pas également ici, comme par ex. B. dans le fructopyranose , une partie de la fermeture du cycle - tout comme pour les aldoses comme pour les cétoses.
La projection de Fischer prête à confusion pour les formes hémiacétal cycliques, voir 1 . Afin de clarifier la disposition angulaire de la chaîne de carbone, la représentation du fauteuil 3 est choisie. La représentation 4 est également courante et stéréochimiquement claire.
Comportement en solution aqueuse

Le cycle peut être ouvert et fermé en solution aqueuse de sorte qu'il y ait un équilibre entre le pyranose (cycle à six chaînons avec atome d'oxygène endocyclique, 99,75 %), la forme furanose (cycle à cinq chaînons, en traces) et la forme aldéhyde à chaîne ouverte ( 0,25%). L'ajout d'acide ou de lessive accélère ce processus. Étant donné que la forme alpha ou bêta peut survenir lors de la fermeture de l'anneau, il existe également un équilibre entre la forme alpha (36 %) et la forme bêta (63,9 %). Le solde est, comme on peut le voir au niveau des pourcentages, du côté du β- D- glucose. C'est l' anomère le plus stable , car tous les groupes hydroxyle dans la conformation de chaise sont disposés de manière équatoriale et ont ainsi la plus grande distance possible les uns des autres. Le fait que 36% de l'anomère soit toujours présent malgré son groupe OH axial indique d'autres influences ( effet anomérique ). Sans l'effet anomérique, il y aurait un rapport de 11 % de forme à 89 % de forme .
Mutarotation
La conversion entre les deux anomères peut être observée au polarimètre car le α- D -glucose pur ayant un angle de rotation spécifique de + 112,2 ° · ml · dm -1 · g -1 , a un β- D -glucose pur de +17 , 5° ml dm -1 g -1 . Si l'équilibre s'est établi après un certain temps, il existe un angle de rotation de + 52,7 ° · ml · dm −1 · g −1 . Ce changement d'angle de rotation est connu sous le nom de mutarotation . Cette conversion peut être massivement accélérée par l'ajout d' acide ou de base . L'équilibre est établi via la forme aldéhyde à chaîne ouverte.

Isomérisation
Dans une solution d'hydroxyde de sodium diluée, le mannose , le glucose et le fructose sont convertis l'un dans l'autre ( réarrangement de Lobry-de-Bruyn-Alberda-van-Ekenstein ), de sorte qu'un équilibre se forme entre ces isomères . Cette réaction s'effectue via un énédiol :
Aide-mémoire pour la stéréochimie
Afin de se souvenir de la configuration du glucose dans la projection de Fischer, il existe le pont d'âne suivant : Les positions des groupes hydroxyles à droite et à gauche de la chaîne carbonée peuvent être "symbolisées" par des onomatopées du son d'un cor de martin ("Ta-Tü-Ta-Ta") . L'arrangement des groupes hydroxyle dans le galactose , d'autre part, peut être rappelé sous forme de lumière bleue (voir illustration).
Vous pouvez utiliser le mot "HochBett" (B pour bêta) pour vous rappeler quelle forme de glucose est présente. Si le groupe hydroxyle C-1 est au sommet ("haut") dans la projection Haworth, alors c'est la forme bêta ("lit").
Occurrence
Le glucose est présent dans tous les êtres vivants car il est un élément central du métabolisme de tous les êtres vivants.
| nourriture | Glucides totaux, y compris les fibres |
Sucre total | Fructose | glucose | Saccharose | Rapport
fructose / glucose |
Saccharose en % du sucre total |
|---|---|---|---|---|---|---|---|
| fruit | |||||||
| Pomme | 13,8 | 10.4 | 5.9 | 2.4 | 2.1 | 2.0 | 19,9 |
| abricot | 11.1 | 9.2 | 0,9 | 2.4 | 5.9 | 0,7 | 63,5 |
| banane | 22,8 | 12.2 | 4.9 | 5.0 | 2.4 | 1,0 | 20,0 |
| Figue , séchée | 63,9 | 47,9 | 22,9 | 24,8 | 0,9 | 0,93 | 0,15 |
| Raisins | 18.1 | 15,5 | 8.1 | 7.2 | 0,2 | 1.1 | 1 |
| Orange ombilicale | 12,5 | 8.5 | 2,25 | 2.0 | 4.3 | 1.1 | 50,4 |
| pêche | 9.5 | 8.4 | 1.5 | 2.0 | 4.8 | 0,9 | 56,7 |
| poire | 15,5 | 9.8 | 6.2 | 2.8 | 0,8 | 2.1 | 8.0 |
| ananas | 13.1 | 9,9 | 2.1 | 1.7 | 6.0 | 1.1 | 60,8 |
| prune | 11.4 | 9,9 | 3.1 | 5.1 | 1.6 | 0,66 | 16.2 |
| les légume | |||||||
| Betterave | 9.6 | 6.8 | 0,1 | 0,1 | 6.5 | 1,0 | 96,2 |
| carotte | 9.6 | 4.7 | 0,6 | 0,6 | 3.6 | 1,0 | 77 |
| paprika | 6.0 | 4.2 | 2.3 | 1.9 | 0.0 | 1.2 | 0.0 |
| oignon | 7.6 | 5.0 | 2.0 | 2.3 | 0,7 | 0,9 | 14.3 |
| patate douce | 20.1 | 4.2 | 0,7 | 1,0 | 2.5 | 0,9 | 60,3 |
| patate douce | 27,9 | 0,5 | traces | traces | traces | - | traces |
| Canne à sucre | 13-18 | 0,2-1,0 | 0,2-1,0 | 11-16 | 1,0 | haute | |
| Betterave à sucre | 17-18 | 0,1-0,5 | 0,1-0,5 | 16-17 | 1,0 | haute | |
| grain | |||||||
| Maïs | 19,0 | 6.2 | 1.9 | 3.4 | 0,9 | 0,61 | 15,0 |
Production industrielle
Le glucose est produit industriellement à partir de l'amidon par hydrolyse enzymatique à l' aide de glucose amylase ou à l'aide d' acides , l'hydrolyse enzymatique ayant largement remplacé l'hydrolyse catalysée par un acide. Cela crée du sirop de glucose (enzymatiquement avec plus de 90 % de glucose dans la matière sèche) avec un volume de production mondial annuel de 20 millions de tonnes (à partir de 2011). C'est là que le nom "sucre d'amidon" a été utilisé dans le passé. Le maïs , les pommes de terre , le riz , le blé , le seigle , le manioc , la patate douce et le sagou sont utilisés comme sources d' amidon . Les amylases proviennent majoritairement de Bacillus licheniformis ou Bacillus subtilis (souche MN-385), qui sont plus thermostables que les enzymes utilisées précédemment. A partir de 1982, les pullulanases d' Aspergillus niger ont été utilisées dans la production de sirop de glucose pour convertir l'amylopectine en amylose, augmentant ainsi le rendement en glucose. La réaction est réalisée à un pH de 4,6-5,2 et une température de 55-60°C. Le sirop de maïs contient entre 20% et 95% de glucose dans la matière sèche. La forme japonaise de mizuame sirop de glucose est fabriqué à partir de la patate douce ou de l' amidon de riz. La maltodextrine contient environ 20 % de glucose.
Conversion en fructose
Aux États - Unis , le maïs est utilisé presque exclusivement à l'aide d'amylase et de glucose isomérase pour produire l' isoglucose sucré alimentaire , qui est un mélange de glucose et de fructose (également du sirop de maïs à haute teneur en fructose HFCS). Le fructose a une douceur plus élevée que le glucose avec le même pouvoir calorifique physiologique de 374 kilocalories pour 100 g. La production mondiale annuelle d'isoglucose est de huit millions de tonnes (en 2011).
Utilisation industrielle
Surtout, le glucose est utilisé dans la production de fructose et dans la production d' aliments contenant du glucose . Dans l'alimentation, il est utilisé comme édulcorant , comme humectant , pour augmenter le volume et créer une sensation en bouche plus douce . Diverses sources de glucose telles que le jus de raisin (pour le vin) ou le malt (pour la bière) sont utilisées pour fermenter en éthanol au cours de la production de boissons alcoolisées . La plupart des boissons gazeuses aux États-Unis utilisent du HFCS-55 (c'est-à-dire 55% de fructose) tandis que la plupart des autres aliments sucrés au HFCS aux États-Unis utilisent du HFCS-42. Au Mexique voisin , en revanche, le sucre de canne est utilisé comme édulcorant dans la boisson gazeuse Coca-Cola , qui a un pouvoir sucrant plus élevé. Le sirop de glucose est également utilisé dans la fabrication de sucreries comme les bonbons , le caramel et le fondant , entre autres . Les réactions chimiques typiques du glucose dans les techniques de cuisson à sec sont la caramélisation et, avec les acides aminés, la réaction de Maillard .
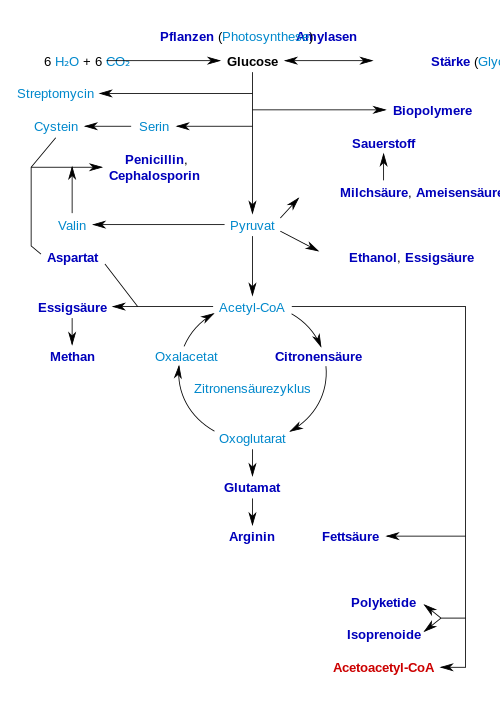
Le glucose convient comme substrat pour la fermentation industrielle , par exemple avec Clostridium thermoaceticum pour la production d' acide acétique , avec Penicillium notatum pour la production d' acide araboascorbique , avec Rhizopus delemar pour la production d' acide fumarique , avec Aspergillus niger pour la production de gluconique . acide , avec Candida brumptii pour la production d ' acide isocitrique , avec Aspergillus terreus pour la production d ' acide itaconique , avec Pseudomonas fluorescens pour la production d' acide 2-céto gluconique , avec Gluconobacter suboxydans pour la préparation d' acide 5-cétogluconique , avec Aspergillus oryzae pour la préparation d' acide kojique avec Lactobacillus delbruckii pour la préparation d' acide lactique , avec Lactobacillus brevis pour la préparation d' acide malique , avec Propionibacter shermanii pour produire de l' acide propionique , avec Pseudomonas aeruginosa pour produire de l' acide pyruvique et avec Gluconobacter suboxydans pour produire de l' acide tartrique .
Le tableau suivant donne un bref aperçu des produits importants qui peuvent être produits de manière biotechnologique. Les produits industriellement intéressants ou leurs étapes préliminaires sont marqués en gras :
L'enzyme cellulase est utilisée pour produire du glucose à partir de la cellulose pour la production d' éthanol ( cellulose-éthanol ) destiné à être utilisé comme biocarburant .
biochimie
Le glucose est principalement produit par les plantes à l' aide de la photosynthèse de la lumière du soleil, de l' eau et du dioxyde de carbone et peut être utilisé par tous les êtres vivants comme source d'énergie et de carbone. Une grande partie du glucose des plantes et des animaux n'est pas libre, mais sous forme liée, par exemple sous forme de lactose ou de sucre de betterave (saccharose) , ou sous forme de polymères tels que l'amidon ou la cellulose, qui sont des substances de réserve ou composants de la paroi cellulaire des plantes . Ces polymères sont d' abord décomposés en glucose à l'aide d' enzymes lorsque les animaux, les champignons et les bactéries les mangent . Chez l'homme, cela se produit parfois lors de la mastication, au moyen d'amylase, qui est contenue dans la salive , et au moyen de maltase . Tous les êtres vivants sont également capables de produire eux-mêmes du glucose à partir de certaines matières premières si le besoin s'en fait sentir. Les cellules nerveuses , les cellules de la médullaire rénale et les érythrocytes dépendent du glucose pour leur production d'énergie. Chez l'homme adulte, il y a environ 18 g de glucose, dont environ 4 g dans le sang. Environ 180 à 220 g de glucose se forment dans le foie d'un humain adulte en 24 heures.
Précurseurs d'autres biomolécules
Chez les êtres vivants, le glucose est converti en plusieurs autres composés chimiques qui sont le produit de départ de diverses voies métaboliques. Tous les autres monosaccharides tels que le fructose (par la voie des polyols ), le mannose (l'épimère en position 2), le galactose (l'épimère en position 4), le fucose , divers acides uroniques et les sucres aminés sont produits à partir du glucose . En plus de la phosphorylation en glucose-6-phosphate , qui fait partie de la glycolyse , le glucose peut initialement être oxydé en glucono-1,5-lactone lorsqu'il est décomposé . Chez certaines bactéries, le glucose sert de bloc de construction dans la biosynthèse du tréhalose ou de dextrane et chez les animaux comme bloc de construction pour le glycogène. Le glucose peut également être converti en fructose par la xylose isomérase bactérienne . De plus, tous les acides aminés non essentiels , les alcools de sucre tels que le mannitol et le sorbitol , les acides gras , le cholestérol et les acides nucléiques sont produits à partir des produits métaboliques du glucose . Enfin, le glucose est utilisé comme composant dans la glycosylation en glycoprotéines nécessaires au fonctionnement de nombreuses protéines et également dans d'autres substances glycosylées telles que les glycolipides , les peptidoglycanes et les glycosides . La glycosylation est catalysée par des glycosyltransférases et peut être à nouveau séparée par des glycosidases .
enregistrement
Chez l'homme, le glucose ingéré par les aliments se lie d'abord au récepteur du goût sucré sur la langue. Ce complexe des protéines T1R2 et T1R3 permet d'identifier les sources alimentaires contenant du glucose. Le glucose provient principalement des aliments - environ 300 g par jour sont produits par la conversion des aliments, mais il est également synthétisé à partir d'autres métabolites dans les cellules du corps. Le glucose est un composant de nombreux glucides et peut en être séparé à l'aide de certaines enzymes . Les glucosidases (un sous-groupe de glycosidases) catalysent d'abord l' hydrolyse des polysaccharides contenant du glucose à longue chaîne, grâce à quoi le glucose terminal est éliminé. Les disaccharides, à leur tour, sont principalement décomposés en glucose par des glycosidases spéciales . Les noms des enzymes de dégradation sont souvent dérivés du poly- et du disaccharide respectifs ; Par exemple, il existe des amylases (issues de l' amylose , partie de l' amidon ), des cellulases (issues de la cellulose ), des chitinases (issues de la chitine ) et bien d'autres encore pour la rupture des chaînes polysaccharidiques ; en outre pour le clivage des disaccharides lactase , saccharase , tréhalase et autres. Environ 70 gènes sont connus chez l' homme qui codent pour les glycosidases. Ils ont des fonctions dans la digestion et dans la dégradation du glycogène, des sphingolipides , des mucopolysaccharides et du poly (ADP-ribose) . Chez l'homme, les polysaccharides contenant du glucose sont en partie décomposés lors de la mastication par l' amylase , qui est contenue dans la salive , et par la maltase , la lactase et la saccharase dans la bordure en brosse de l' intestin grêle .
Afin d'entrer ou de sortir des cellules et des compartiments cellulaires via la membrane cellulaire , le glucose a besoin de protéines de transport spéciales de la grande superfamille des facilitateurs . Dans l'intestin grêle (plus précisément dans le jéjunum ), le glucose est capté dans les cellules épithéliales intestinales à l'aide du transporteur de glucose via un mécanisme de transport actif secondaire appelé symport ion sodium-glucose ( cotransporteur sodium/glucose 1 ) . Il est transmis sur le basolatérale côté de l'épithélium intestinal cellule par l'intermédiaire du transporteur de glucose GLUT2 , de même que son absorption dans les hépatocytes , les cellules rénales , les cellules ß des îlots de Langerhans, les neurones, les astrocytes et les tanycytes . Le glucose atteint le foie par la veine porte et y est stocké sous forme de glycogène. Dans la cellule hépatique, il est phosphorylé en glucose-6-phosphate par la glucokinase en position 6 ; elle ne peut donc plus quitter la cellule. A l'aide de la glucose-6-phosphatase , le glucose-6-phosphate est reconverti en glucose si nécessaire, exclusivement dans le foie, afin qu'il soit disponible pour maintenir une concentration sanguine suffisante. Dans d'autres cellules, l'absorption a lieu au moyen d' un transport passif à travers l'une des 14 protéines GLUT. Dans les autres types cellulaires , la phosphorylation est réalisée par une hexokinase , après quoi le glucose ne peut plus diffuser hors de la cellule.
GLUT1 est formé par la plupart des types de cellules et a une signification particulière pour les cellules nerveuses et le pancréas contient des cellules β . GLUT3 est souvent formé par des cellules nerveuses. Le glucose de la circulation sanguine est absorbé par les cellules musculaires (muscles squelettiques et muscle cardiaque) et les cellules adipeuses via GLUT4 . GLUT14 n'est produit que dans les testicules . L'excès de glucose ingéré est décomposé et converti en acides gras, qui sont stockés sous forme de triacylglycéride . Dans les reins, le glucose est absorbé par l' urine via SGLT1 et SGLT2 dans les membranes cellulaires apicales et transmis via GLUT2 dans les membranes cellulaires basolatérales. Environ 90 % de l'absorption du glucose par le rein se produit via SGLT2 et environ 3 % via SGLT1.
biosynthèse
La voie métabolique pour construire le glucose à partir de petites molécules de deux à quatre atomes de carbone, qui se termine par la molécule de glucose à six atomes de carbone, est appelée gluconéogenèse et se produit chez tous les êtres vivants. Grâce à la néoglucogenèse, l'organisme peut accumuler du glucose à partir d'autres produits métaboliques, dont le lactate ou certains acides aminés, tout en consommant de l'énergie. Les matières premières plus petites sont le résultat d'autres voies métaboliques et, chez les plantes, proviennent finalement de l' assimilation du dioxyde de carbone . En fin de compte, presque toutes les biomolécules proviennent de l'assimilation du dioxyde de carbone dans les plantes lors de la photosynthèse. L' énergie libre de formation du -D -glucose est de 917,2 kilojoules par mole.Chez l'homme, la néoglucogenèse a lieu dans le foie et les reins , mais aussi dans d'autres types cellulaires . Les cellules tubulaires des reins peuvent également produire du glucose.
La dégradation du glycogène est connue sous le nom de glycogénolyse, la dégradation de l'amidon sous forme de dégradation de l'amidon. Environ 150 g de glycogène sont stockés dans le foie et environ 250 g dans les muscles squelettiques . Le glucose libéré dans les cellules musculaires lorsque le glycogène est décomposé ne peut pas être libéré dans la circulation sanguine, cependant, comme le glucose est phosphorylé par l'hexokinase, aucune glucose-6-phosphatase n'est formée pour éliminer le groupe phosphate et pour le glucose-6-phosphate dans contrairement au glucose, aucune protéine de transport n'existe.
Démantèlement
Le glucose est décomposé dans le métabolisme via la glycolyse et la voie des pentoses phosphates. La glycolyse est utilisée par tous les organismes vivants avec de petites variations, et tous les organismes génèrent de l'énergie à partir de la dégradation des monosaccharides. Dans le cours ultérieur du métabolisme, il peut être complètement décomposé en eau et en dioxyde de carbone via la décarboxylation oxydative , le cycle de l'acide citrique et la chaîne respiratoire . S'il n'y a pas assez d'oxygène disponible pour cela, le glucose est décomposé de manière anaérobie chez les animaux par fermentation lactique jusqu'au lactate et libère moins d'énergie. Chez les mammifères, le lactate des muscles atteint le foie via la circulation sanguine, où se déroule la gluconéogenèse ( cycle de Cori ). D'autres formes de fermentation se produisent dans d'autres êtres vivants . Lorsqu'il y a un apport élevé en glucose, le métabolite acétyl-CoA est également utilisé pour la synthèse des acides gras . Le glucose reconstitue également les réserves de glycogène du corps, qui se trouvent principalement dans le foie et les muscles squelettiques. Ces processus sont régulés hormonalement.
La bactérie Escherichia coli peut se développer sur des milieux nutritifs dont le glucose est la seule source de carbone. Chez certaines bactéries et - sous une forme modifiée - également chez les archées , le glucose est décomposé par la voie Entner-Doudoroff .
Les cellules tumorales se développent souvent relativement rapidement et consomment une quantité de glucose supérieure à la moyenne via la glycolyse, ce qui conduit à la formation de lactate, le produit final de la fermentation chez les mammifères, même en présence d' oxygène . Cet effet est connu sous le nom d' effet Warburg . Divers SGLT et GLUT sont de plus en plus formés pour l'augmentation de l'absorption du glucose dans les tumeurs . Chez la levure, à des concentrations élevées de glucose, même en présence d'oxygène (conduit normalement à la respiration , mais pas à la fermentation), l' éthanol est produit par fermentation. Cet effet est connu sous le nom d' effet Crabtree .
Valeur calorifique
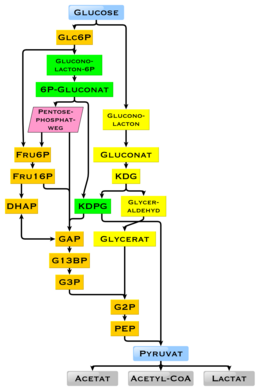
Le pouvoir calorifique physiologique du glucose est, selon la source, de 16,2 kilojoules par gramme soit 15,7 kJ/g (3,74 kcal/g). La haute disponibilité des glucides à travers la biomasse végétale a conduit à une variété de méthodes au cours de l' évolution , en particulier des micro - organismes , pour utiliser l'énergie et le stockage du carbone du glucose. Il existe des différences dans le produit final auquel le produit final qui ne peut plus être utilisé pour la production d'énergie est atteint. Ici, la présence de gènes individuels et de leurs produits géniques, les enzymes, décident des réactions possibles (voir figure). La voie métabolique de la glycolyse est utilisée par presque tous les êtres vivants. Une différence essentielle de cette manière est la production de NADP en tant qu'agent réducteur pour l' anabolisme , qui autrement devrait être produit indirectement.
Concentrations de glucose
Le glucose dans le sang est appelé sucre dans le sang . Le taux de sucre dans le sang est régulé par les cellules nerveuses de l' hypothalamus qui fixent le glucose . De plus, le glucose dans le cerveau se lie aux récepteurs du glucose dans le centre de récompense du noyau accumbens . La liaison du glucose au récepteur du goût sucré sur la langue déclenche la libération de diverses hormones du métabolisme énergétique avec et sans ingestion de glucose, ce qui entraîne une augmentation de l'absorption dans les cellules et une baisse du taux de sucre dans le sang. Les édulcorants, en revanche, n'abaissent pas le taux de sucre dans le sang.
La teneur en sucre dans le sang d'une personne en bonne santé est à jeun, c'est-à-dire. H. après une nuit à jeun , environ 70 à 100 mg/dl de sang (4 à 5,5 mM ). Les valeurs mesurées dans le plasma sanguin sont environ 10 à 15 % plus élevées. De plus, les valeurs dans le sang artériel sont supérieures aux concentrations dans le sang veineux, car le glucose est absorbé dans les tissus lors du passage dans le lit capillaire. Dans le sang capillaire également, qui est souvent utilisé pour déterminer la glycémie, les valeurs sont parfois plus élevées que dans le sang veineux. La teneur en glucose du sang est régulée par les hormones insuline , incrétine et glucagon : l'insuline abaisse le taux de glucose, le glucagon l'augmente. De plus, les hormones adrénaline , thyroxine , glucocorticoïdes , somatotrophine et adrénocorticotrophine entraînent une augmentation du taux de glucose. De plus, il existe également une régulation indépendante des hormones, appelée autorégulation du glucose . Après avoir mangé, la concentration de sucre dans le sang augmente. Les valeurs supérieures à 180 mg/dl dans le sang total veineux sont pathologiques et sont appelées hyperglycémie , les valeurs inférieures à 40 mg/dl sont appelées hypoglycémie .
Lorsqu'il est utilisé, le glucose est libéré dans la circulation sanguine par la glucose-6-phosphatase à partir du glucose-6-phosphate ainsi que par le glycogène du foie et des reins, ce qui permet d'obtenir une homéostasie de la concentration de glucose dans le sang. Chez les ruminants la concentration glycémique est faible (60 mg/dL chez les bovins et 40 mg/dL chez les ovins), car les glucides de la flore intestinale plus en acides gras à chaîne courte sont convertis.
Dans le cerveau , qui repose sur le glucose comme principal fournisseur d'énergie , la concentration en glucose est normalement de 4 à 6 mM (5 mM correspond à 90 mg/dL), mais chute à 2 à 3 mM à jeun . De faibles concentrations de glucose dans le cerveau ont un effet négatif sur la capacité de penser, la maîtrise de soi et la volonté . En dessous de 1 mM, la confusion survient et, en dessous de 1 mM, le coma survient.
L' index glycémique est un indicateur du taux d'absorption et de conversion en glucose sanguin à partir des glucides ingérés et est déterminé comme l' intégrale du taux de glucose sanguin après ingestion par rapport au glucose (le glucose ingéré est défini comme 100). La signification clinique de l'index glycémique est controversée car les aliments à haute teneur en matières grasses ralentissent l'absorption du glucose et abaissent ainsi l'index glycémique, comme la crème glacée. Une mesure alternative avec le même problème est l' indice d'insuline , mesuré comme l'influence de l'apport de glucides sur le niveau d'insuline dans le sang. La charge glycémique est un indicateur de la quantité de glucose ajoutée à la circulation sanguine après l'ingestion de glucides et est basée sur l'index glycémique et la quantité de nourriture ingérée.
Pathobiochimie
Diabète auto-immun
Au cours d'une réaction auto-immune contre les cellules β des îlots de Langerhans du pancréas , les cellules β sont tuées, ce qui signifie que l'hormone insuline n'est plus produite. Cela donne lieu au diabète sucré de type I (diabète auto-immun). L'insuline ou des analogues doivent alors être administrés régulièrement par injection sous- cutanée, en fonction du résultat d'une mesure avec un lecteur de glycémie .
Diabète acquis
Le dérèglement du taux de glucose est appelé hyperglycémie intermédiaire et, dans les formes plus sévères, diabète sucré de type II (synonyme de diabète acquis , insulinorésistance ). Une glycémie élevée répétée ou permanente indique généralement un diabète sucré. Selon la gravité, des antidiabétiques oraux peuvent être utilisés. L'exercice régulier et l'évitement de l' obésité réduisent le risque de diabète de type II, et l'exercice est également recommandé pour le traitement du diabète de type II.
Surpoids et stéatose hépatique
De plus, un apport accru de glucose conduit à l' obésité et, de ce fait, en partie au syndrome métabolique avec stéatose hépatique non alcoolique , mais pas à la consommation de glucose dans le cadre d'un apport calorique normal.
Analytique
Plus précisément, lorsqu'une molécule de glucose doit être détectée à une position particulière dans une molécule plus grosse, une spectroscopie de résonance magnétique nucléaire , une analyse de la structure cristalline aux rayons X ou une lectine - immunocoloration avec un conjugué concanavaline A - enzyme rapporteur - (se lie uniquement au glucose ou mannose) est réalisée.
Réactions de détection qualitatives classiques
Ces réactions n'ont qu'une signification historique :
La réaction de Fehling
L' échantillon Fehling est une preuve classique d'aldoses. En raison de la mutarotation , une faible proportion de glucose est toujours présente sous forme d'aldéhyde à chaîne ouverte. En ajoutant les réactifs de Fehling (solution de Fehling (I) et solution de Fehling (II)), le groupe aldéhyde est oxydé en acide carboxylique, tandis que le complexe de tartrate de Cu 2+ est réduit en Cu + et sous forme de précipité rouge brique (Cu 2 O ) échoue.
Grande réaction
Avec l' échantillon Tollens , après avoir ajouté AgNO 3 ammoniacal à la solution échantillon, Ag + est réduit du glucose en argent élémentaire.
Échantillon Barfoedsche
Dans l' échantillon de Barfoed , un mélange d' acétate de cuivre dissous , d'acétate de sodium et d'acide acétique est mélangé à la solution du sucre à examiner et chauffé au bain-marie pendant quelques minutes. Le glucose et d'autres monosaccharides développent rapidement une couleur rougeâtre et un oxyde de cuivre (I) brun rougeâtre (Cu 2 O).
Le réactif de Nylander
En tant que sucre réducteur , le glucose réagit avec le réactif de Nylander .
Une preuve supplémentaire
Lorsqu'une solution d'hydroxyde de potassium diluée avec du glucose est chauffée à 100 ° C, un fort brunissement rougeâtre et une odeur de caramel se développent. L' acide sulfurique concentré dissout le glucose sec sans noircissement à température ambiante, avec formation de sucre d'acide sulfurique . En solution avec de la levure , la fermentation alcoolique produit immédiatement du dioxyde de carbone dans le rapport de 2,0454 molécules de glucose pour une molécule de CO 2 . Le glucose forme une masse noire avec le chlorure d'étain . Dans une solution d'argent ammoniacal , le glucose (comme le lactose et la dextrine ) conduit à un dépôt d'argent sans formation de miroir d'argent . Dans une solution d'acétate de plomb ammoniacal , du glycosate de plomb blanc se forme en présence de glucose , qui devient moins soluble et brunit à la cuisson. Dans une solution de cuivre ammoniacal, de l'oxyde de cuivre jaune hydraté se forme avec du glucose à température ambiante , tandis que l'ébullition, d'autre part, forme de l'oxyde de cuivre rouge (également avec de la dextrine, à l'exception de la solution d' acétate de cuivre ammoniacal ). Avec le réactif de Hager , le glucose forme de l'oxyde de mercure lors de la cuisson . Avec une solution de bismuth alcaline, du bismuth élémentaire brun noir se dépose avec du glucose. Le glucose bouilli dans une solution de molybdate d'ammonium rend la solution bleue. Une solution avec du carmin d'indigo et du carbonate de sodium se décolore lorsqu'elle est bouillie avec du glucose.
Détermination quantitative instrumentale
Réfractométrie et polarimétrie
Dans les solutions concentrées de glucose avec une petite quantité d'autres glucides, leur concentration peut être déterminée avec un polarimètre . Dans le cas de mélanges de sucres, la concentration peut être déterminée avec un réfractomètre , par exemple lors de la détermination d' Oechsle au cours de la production de vin .
Méthode photométrique-enzymatique en solution
L'enzyme glucose oxydase (GOx) convertit le glucose en acide gluconique et en peroxyde d'hydrogène à l' aide d'oxygène . Une autre enzyme, la peroxydase, catalyse une réaction chromogène (réaction de Trinder) du phénol avec la 4-aminoantipyrine pour former un colorant violet.
Méthode de bandelette de test photométrique
La méthode de la bandelette réactive utilise la conversion enzymatique mentionnée ci-dessus du glucose en acide gluconique avec formation de peroxyde d'hydrogène. Les réactifs sont immobilisés sur une matrice polymère, appelée bandelette réactive, qui prend une couleur plus ou moins forte. Cela peut être lu par réflectométrie à l'aide d'un photomètre portable à LED à 510 nm. Cela permet des tests de glycémie de routine par des profanes. En plus de la réaction du phénol avec la 4-aminoantipyrine, de nouvelles réactions chromogènes ont été développées qui permettent la photométrie à des longueurs d'onde plus élevées (550 nm, 750 nm).
Capteurs de glucose ampérométriques
L' électroanalyse du glucose est également basée sur la conversion enzymatique évoquée plus haut. Le peroxyde d'hydrogène produit peut être quantifié ampérométriquement par oxydation anodique à un potentiel de 600 mV. Le GOx est immobilisé sur la surface de l'électrode ou dans une membrane disposée à proximité de l'électrode. En plus des métaux précieux classiques tels que le platine ou l'or, les électrodes en nanotubes de carbone ont récemment été utilisées de plus en plus fréquemment comme électrodes. B. ont été dopés au bore. Les nanofils Cu-CuO sont également utilisés comme électrodes ampérométriques sans enzyme. Une limite de détection de 50 µmol/L a ainsi été atteinte. Une méthode particulièrement prometteuse est ce qu'on appelle le "câblage enzymatique". L'électron circulant pendant l'oxydation est dévié directement de l'enzyme vers l'électrode via un fil moléculaire.
Autres méthodes sensorielles
Il existe un certain nombre d'autres capteurs chimiques pour le glucose. Compte tenu de l'importance de l'analyse du glucose dans les biosciences, de nombreuses sondes optiques pour les saccharides basées sur l'utilisation d'acides boroniques ont également été développées et sont particulièrement adaptées aux applications sensorielles intracellulaires où d'autres méthodes (optiques) n'existent pas du tout ou seulement dans une mesure limitée peut être utilisé. En plus des dérivés organiques de l'acide boronique, qui se lient souvent de manière très spécifique aux groupes 1,2-diol du sucre, il existe d'autres concepts de sonde classés selon des mécanismes fonctionnels qui utilisent des protéines sélectives de liaison au glucose (par exemple la concanavaline A) comme récepteurs. . En outre, des méthodes ont été développées qui mesurent la concentration de glucose indirectement via la concentration de produits métabolisés, par ex. B. la consommation d'oxygène à l'aide de capteurs optiques fluorescents. Enfin, il existe des concepts basés sur les enzymes qui utilisent l'absorbance ou la fluorescence intrinsèque des enzymes (marquées par fluorescence) comme supports d'information.
Iodométrie cuivre
Le glucose peut être fabriqué par le cuivre - l' iodométrie être quantifiée.
Processus chromatographique
Surtout pour l'analyse de mélanges complexes contenant du glucose, tels que. B. dans le miel , des méthodes chromatographiques telles que la chromatographie liquide à haute performance et la chromatographie en phase gazeuse sont utilisées aujourd'hui , souvent en combinaison avec la spectrométrie de masse . En tenant compte des rapports isotopiques , cette analyse peut également détecter de manière fiable l'adultération du miel causée par le sucre ajouté. Les dérivations utilisant des réactifs de silylation se sont avérées avantageuses . De cette façon, les proportions de di- et trisaccharides peuvent également être quantifiées.
Analyse in vivo
L'absorption du glucose dans les cellules des organismes est examinée avec du 2-désoxy- D- glucose ou du fluorodésoxyglucose . ( 18 F) -Le fluorodésoxyglucose est utilisé en oncologie et en neurologie comme traceur en tomographie par émission de positons , où il est de loin l'outil de diagnostic le plus utilisé.
Littérature
- Jochen Lehmann : Glucides. Chimie et biologie. 2., retravailler. et exp. Édition. Thieme, Stuttgart / New York 1996, ISBN 3-13-532902-X .
- Hans Vogel : tables des sucres et de leurs dérivés. Springer-Verlag, Berlin 2013, ISBN 978-3-642-47764-5 .
- Günther Wolff : Le métabolisme du sucre - une étude biographique. Dans : Médical mensuel . Volume 12, 1958, pp. 766-774 et 838-846.
liens web
Preuve individuelle
- ↑ Entrée sur GLUCOSE dans la base de données CosIng de la Commission européenne, accessible le 16 Février, à 2020.
- ↑ a b c d entrée pour CAS no. 50-99-7 dans la base de données des substances GESTIS de l' IFA , consulté le 18 septembre 2014. (JavaScript requis)
- ↑ Alfred Töpel: Chimie et Physique du lait: Matériel naturel - matières premières - Alimentation . Verlag DE de Behr, 2004, ISBN 3-89947-131-8 , p. 101 ( aperçu limité dans la recherche Google Book).
- ↑ David R. Lide (éd.) : CRC Handbook of Chemistry and Physics . 90e édition. (Version Internet : 2010), CRC Press / Taylor et Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-268.
- ↑ a b c entrée sur le D-glucose. Dans : Römpp Online . Georg Thieme Verlag, consulté le 31 mai 2013.
- ↑ Fiche de données sur le glucose (PDF) de Carl Roth , consultée le 24 août 2010.
- ↑ Thénard, Gay-Lussac, Biot, Dumas : Rapport sur un mémoire de M. Péligiot, intitulé : Recherches sur la nature et les propriétés chimiques des sucres . Dans : Comptes rendus , 1838, Tome 7, pp. 106-113.
- ↑ Abraham J. Domb, Joseph Kost, David Wiseman : Manuel des polymères biodégradables . CRC Press, 1998. ISBN 978-1-4200-4936-7 . P. 275.
- ↑ Kenji Kamide: dérivés de la cellulose et la cellulose . Elsevier, 2005, ISBN 978-0-08-045444-3 , p.1 .
- ^ Liste modèle OMS des médicaments essentiels. (PDF) (N'est plus disponible en ligne.) Dans : Organisation mondiale de la Santé. octobre 2013, archivé de l' original le 23 avril 2014 ; consulté le 22 avril 2014 .
- ^ Un b Benjamin Caballero, Paul Finglas, Fidel Toldrá : Encyclopédie de l'alimentation et de la santé . Presse académique (2016). ISBN 978-0-12-384953-3 , Tome 3, pp. 239, 608.
- ↑ Marggraf : Experiences chimiques faites dans le dessin de tirer un véritable sucre de plantes diverses, qui croissent dans nos contrées. « Expériences chimiques dans le but d'extraire du vrai sucre de diverses plantes poussant sur nos terres ». In : Histoire de l'académie royale des sciences et belles-lettres de Berlin (1747), p. 90 : Les raisins secs, etant humectés d'une petite quantité d'eau, de maniere qu'ils mollissent, peuvent alors etre pilés , & le suc qu'on en exprime, etant depuré & épaissi, fournissanta une espece de Sucre. « Les raisins secs, humidifiés avec un peu d'eau pour qu'ils ramollissent, peuvent être pressés, et le jus pressé, nettoyé et épaissi, fait une sorte de sucre.
- ^ Aaron J. Ihde : Le développement de la chimie moderne. Harper et Row, New York 1964.
- ↑ a b John F. Robyt : Essentiels de la chimie des glucides. (= Springer Advanced Texts in Chemistry ) 1998, ISBN 0-387-94951-8 .
- ^ Règles provisoires pour la nomenclature des glucides Journal de chimie biologique n° 247, page 613, 1972.
- ^ John F. Robyt : Essentiels de la chimie des glucides. Springer Science & Business Media, 2012, ISBN 978-1-4612-1622-3 . p. 7.
- ↑ MA Rosanoff: classement de Fischer sur des stéréo-isomères. Dans : Journal de l'American Chemical Society . 28, 1906, page 114, doi : 10.1021 / ja01967a014 .
- ^ Emil Fischer - Biographique. Dans : prix nobel.org. 15 juillet 1919, consulté le 4 juin 2018 .
- ↑ Bert Fraser-Reid : le glucose de van 't Hoff . Dans: Chem.Eng. Actualités , 1999, Volume 77, Numéro 39, p.8 ; doi: 10.1021 / cen-v077n039.p008 .
- ^ IUPAC : Nomenclature des glucides (Recommandations 1996) .
- ^ Otto Meyerhof - Faits. Dans : prix nobel.org. 15 juillet 2018, consulté le 15 juillet 2018 .
- ↑ Hans von Euler-Chelpin - Faits. Dans : prix nobel.org. Consulté le 3 septembre 2018 .
- ↑ Arthur Harden - Les faits. Dans : prix nobel.org. 17 juin 1940, consulté le 3 septembre 2018 .
- ↑ Bernardo Houssay - Les faits. Dans : prix nobel.org. 21 septembre 1971, consulté le 15 juillet 2018 .
- ^ Carl Cori - Faits. Dans : prix nobel.org. 20 octobre 1984, consulté le 15 juillet 2018 .
- ^ Gerty Cori - Faits. Dans : prix nobel.org. 26 octobre 1957, consulté le 15 juillet 2018 .
- ↑ Luis Leloir - Faits. Dans : prix nobel.org. 15 juillet 2018, consulté le 15 juillet 2018 .
- ↑ Fred W. Schenck : Glucose et sirops contenant du glucose . Dans : Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim, 2006. doi : 10.1002 / 14356007.a12_457.pub2 .
- ↑ Patrick F. Fox : Advanced Dairy Chemistry Volume 3 : Lactose, eau, sels et vitamines , Springer, 1992. Volume 3, ISBN 978-0-412-63020-0 . P. 316.
- ^ Benjamin Caballero, Paul Finglas, Fidel Toldrá : Encyclopédie de l'alimentation et de la santé . Presse académique (2016). ISBN 978-0-12-384953-3 , Tome 1, page 76.
- ↑ HF Bunn, PJ Higgins : Réaction des monosaccharides avec des protéines : importance évolutive possible . Dans : Sciences . 213, n° 4504, 1981, p. 222-224. doi : 10.1126 / science.12192669 .
- ↑ Jeremy M. Berg: Stryer biochimie. Springer-Verlag, 2017, ISBN 978-3-662-54620-8 , page 531.
- ^ Reginald H. Garrett : Biochimie. Cengage Learning, 2012, ISBN 978-1-133-10629-6 . P. 194, 199.
- ^ Donald Voet, Judith G. Voet : Biochimie, 4e édition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . P.363.
- ^ Albert L. Lehninger, Biochimie, 6e impression , Worth Publishers Inc. 1972, ISBN 0-87901-009-6 , page 228.
- ↑ a b c Peter C. Heinrich: Löffler / Petrides biochimie et Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , page 27.
- ^ Eusebio Juaristi, Gabriel Cuevas: The Anomeric Effect CRC Press, 1995. ISBN 0-8493-8941-0 . p. 9-10.
- ↑ a b Manfred Hesse, Herbert Meier, Bernd Zeeh, Stefan Bienz, Laurent Bigler, Thomas Fox : Méthodes spectroscopiques en chimie organique . 8., révisé. Édition. Georg Thieme, 2011, ISBN 978-3-13-160038-7 , p. 34 .
- ↑ Les bases de données sur la composition des aliments affichent la liste des aliments. Dans : ndb.nal.usda.gov. Consulté le 25 août 2018 .
- ^ Sucre . ( 18 Juillet, 2011 mémento sur l' Internet Archive ) Oregon State University ; consulté le 28 juin 2018.
- ↑ a b c d e f g h i P j Fellows: Food Technology Processing. Woodhead Publishing, 2016, ISBN 978-0-08-100523-1 , page 197.
- ↑ a b Thomas Becker, Dietmar Breithaupt, Horst Werner Doelle, Armin Fiechter, Günther Schlegel, Sakayu Shimizu, Hideaki Yamada : Biotechnologie . Dans : Encyclopédie d'Ullmann de chimie industrielle . 7e édition. Wiley-VCH, 2011, ISBN 978-3-527-32943-4 , tome 6, page 48.
- ↑ sucre d' amidon . Dans : Lexique des marchandises de Merck . 3e édition 1884 et suiv., P. 457 s.
- ^ Un b Alan Davidson : Le compagnon d'Oxford à la nourriture. OUP Oxford, 2014, ISBN 978-0-19-104072-6 , page 527.
- ↑ a b c La Société de recherche sur l'amylase du Japon : Manuel des amylases et des enzymes apparentées. Elsevier, 2014, ISBN 978-1-4832-9939-6 , page 195.
- ^ GB Madsen, BE Norman, S. Slott: Une nouvelle amylase bactérienne thermostable et son utilisation dans la liquéfaction à haute température . Dans : Amidon (1973), Volume 25, Numéro 9, doi : 10.1002 / star.19730250906 . P. 304-308.
- ^ BE Norman : Une nouvelle enzyme débranchante pour application dans l'industrie du sirop de glucose. Dans : Amidon - force , 34, 1982, p. 340, doi : 10.1002 / star.19820341005 .
- ↑ James N. BeMiller, Roy L. Whistler : Amidon : Chimie et technologie (= Science et technologie alimentaires), 3e. Édition, Academic Press, New York 2009, ISBN 0-08-092655-X .
- ↑ Sirop de maïs à haute teneur en fructose : Questions et réponses. (N'est plus disponible en ligne.) US Food and Drug Administration, 5 novembre 2014, archivé à partir de l' original le 25 janvier 2018 ; consulté le 18 décembre 2017 .
- ↑ Kevin Pang : Mexican Coke a hit in US ( Memento du 29 juin 2011 dans Internet Archive ) In : Seattle Times du 29 octobre 2004.
- ↑ Steve T. Beckett : Fabrication et utilisation du chocolat industriel de Beckett. John Wiley & Sons, 2017, ISBN 978-1-118-78014-5 , page 82.
- ^ Hans-Dieter Belitz , Werner Grosch , Peter Schieberle : Chimie alimentaire . Springer, Berlin 2009. ISBN 978-3-540-69935-4 . 270-289.
- ^ Nathan Myhrvold , Chris Young, Maxime Bilet : Cuisine moderniste : L'art et la science de la cuisine . Le laboratoire de cuisine 2011. ISBN 978-0-9827610-0-7 . Tome 3, p. 89ff.
- ^ James A. Kent : Manuel de chimie industrielle de Riegel. Springer Science & Business Media, 2013, ISBN 978-1-4757-6431-4 , page 938.
- ↑ Ashok Pandey : Bioraffineries industrielles et biotechnologie blanche. Elsevier, 2015, ISBN 978-0-444-63464-1 , page 488.
- ^ A b c Peter C. Heinrich: Löffler / Petrides Biochimie et Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , page 195.
- ↑ a b c d e U. Satyanarayana: Biochemistry. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7 . P. 674.
- ^ DH Wasserman : Quatre grammes de glucose. Dans : American Journal of Physiology - Endocrinologie et métabolisme. Volume 296, numéro 1, janvier 2009, pp. E11-E21, doi: 10.1152 / ajpendo.90563.2008 , PMID 18840763 , PMC 2636990 (texte intégral gratuit).
- ↑ a b c d e f g Peter C. Heinrich: Löffler / Petrides Biochimie et Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , p. 199, 200.
- ^ Un b Peter C. Heinrich : Löffler/Petrides Biochemistry and Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , page 214.
- ↑ Essentiels de la glycobiologie , Ajit Varki (éd.), 2e. Édition, Cold Spring Harbor Laboratories Press ,, ISBN 978-0-87969-770-9 . Archivé de l' original le 6 décembre 2016.
- ↑ Peter C. Heinrich : Löffler / Petrides Biochimie et Pathobiochimie . Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , page 404.
- ↑ Résultat de recherche UniProt .
- ↑ Résultat de recherche UniProt .
- ^ Harold A. Harper : Biochimie médicale. Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , page 641.
- ↑ AM Navale, AN Paranjape : Transporteurs de glucose : rôles physiologiques et pathologiques. Dans : Revues biophysiques . Volume 8, numéro 1, mars 2016, pp. 5-9, doi: 10.1007 / s12551-015-0186-2 , PMID 28510148 , PMC 5425736 (texte intégral gratuit).
- ↑ B. Thorens : GLUT2, détection du glucose et homéostasie du glucose. Dans : Diabetologia . Volume 58, numéro 2, février 2015, pp. 221-232, doi: 10.1007 / s00125-014-3451-1 , PMID 25421524 .
- ^ RC Bonadonna, S. Del Prato, E. Bonora, député Saccomani, G. Gulli, A. Natali, S. Frascerra, N. Pecori, E. Ferrannini, D. Bier, C. Cobelli, RA DeFronzo : Rôles du glucose transport et phosphorylation du glucose dans la résistance à l'insuline musculaire du NIDDM. Dans : Diabète. Volume 45, numéro 7, juillet 1996, pp. 915-925, PMID 8666143 .
- ↑ S. Huang, député tchèque : Le transporteur de glucose GLUT4. Dans : Métabolisme cellulaire . Volume 5, Numéro 4, avril 2007, pp. 237-252, doi: 10.1016 / j.cmet.2007.03.006 , PMID 17403369 .
- ↑ R. Govers : Régulation cellulaire de la captation du glucose par le transporteur de glucose GLUT4. Dans : Avancées en chimie clinique . Volume 66, 2014, p. 173-240, PMID 25344989 .
- ^ C. Ghezzi, DD Loo, EM Wright : Physiologie de la manipulation rénale du glucose via SGLT1, SGLT2 et GLUT2. Dans : Diabetologia . [Publication électronique avant mise sous presse] Août 2018, doi : 10.1007 / s00125-018-4656-5 , PMID 30132032 .
- ↑ SB Poulsen, RA Fenton, T. Rieg : Cotransport sodium-glucose. In : Opinion actuelle en néphrologie et hypertension. Volume 24, numéro 5, septembre 2015, pp. 463-469, doi: 10.1097 / MNH.00000000000000152 , PMID 26125647 , PMC 5364028 (texte intégral gratuit).
- ^ Donald Voet, Judith G. Voet : Biochimie, 4e édition . John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . P. 359.
- ^ Un b Donald Voet, Judith G. Voet : Biochimie, 4e édition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . p.59.
- ↑ a b Leszek Szablewski: glucose homéostasie et résistance à l'insuline. Bentham Science Publishers, 2011, ISBN 978-1-60805-189-2 , page 46.
- ↑ AM Smith, Caroline du Sud Zeeman, SM Smith: dégradation de l' amidon. Dans : Revue annuelle de biologie végétale . Volume 56, 2005, pp. 73-98, doi: 10.1146 / annurev.arplant.56.032604.144257 , PMID 15862090 .
- ↑ MM-Adeva tout impôt, N. Pérez-Felpete, C. Fernandez-Fernandez, C. Donapetry-García, C. Pazos-García : Métabolisme hépatique du glucose chez l'homme. Dans : Rapports bioscientifiques . Volume 36, numéro 6, 12 2016, page E00416, doi: 10.1042 / BSR20160385 , PMID 27707936 , PMC 5293555 (texte intégral gratuit).
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn et Carsten Biele (traducteur) : Biochemie . Études Pearson; 4e édition mise à jour 2008 ; ISBN 978-3-8273-7312-0 ; P. 490-496.
- ^ Un b Brian K. Hall : L'évolution de Strickberger. Jones & Bartlett Publishers, 2013, ISBN 978-1-4496-1484-3 , p. 164.
- ^ Reginald H. Garrett : Biochimie. Cengage Learning, 2012, ISBN 978-1-133-10629-6 , page 551.
- ↑ JG Jones : Métabolisme hépatique du glucose et des lipides. Dans : Diabetologia . Volume 59, numéro 6, 06 2016, pp. 1098–1103, doi: 10.1007 / s00125-016-3940-5 , PMID 27048250 .
- ↑ N. Entner, M. Doudoroff : Oxydation du glucose et de l'acide gluconique de Pseudomonas saccharophila . Dans : J Biol Chem . , 1952, 196 (2), p. 853-862 (anglais); PMID 12981024 ; jbc.org (PDF).
- ^ A. Annibaldi, C. Widmann : Métabolisme du glucose dans les cellules cancéreuses. Dans : Opinion actuelle en nutrition clinique et soins métaboliques . Volume 13, Numéro 4, juillet 2010, pp. 466-470, doi: 10.1097 / MCO.0b013e32833a5577 , PMID 20473153 .
- ↑ XD Xu, SX Shao, HP Jiang, YW Cao, YH Wang, XC Yang, Wang YL, XS Wang, HT Niu: effet Warburg ou inverser l' effet Warburg? Un examen du métabolisme du cancer. Dans : Recherche et traitement en oncologie . Volume 38, numéro 3, 2015, pp. 117-122, doi: 10.1159 / 000375435 , PMID 25792083 .
- ↑ L. Szablewski : Expression des transporteurs de glucose dans les cancers. Dans : Biochimica et Biophysica Acta . Volume 1835, numéro 2, avril 2013, pp. 164-169, doi: 10.1016 / j.bbcan.2012.12.004 , PMID 23266512 .
- ↑ K. Adekola, Rosen ST, M. Shanmugam: les transporteurs de glucose dans le métabolisme du cancer. Dans : Opinion actuelle en oncologie . Volume 24, numéro 6, novembre 2012, pp. 650-654, doi: 10.1097 / CCO.0b013e328356da72 , PMID 22913968 .
- ^ RH De Deken : L'effet Crabtree : un système de régulation dans la levure. Dans : Journal de microbiologie générale . Volume 44, numéro 2, août 1966, pp. 149-156, doi: 10.1099 / 00221287-44-2-149 , PMID 5969497 .
- ↑ E. de Old Riis, F. Cartenì, P. Parascandola, J. Serpa, S. Mazzoleni : Revisiter l'effet Crabtree / Warburg dans une perspective dynamique : un avantage de fitness contre la mort cellulaire induite par le sucre. Dans : Cycle cellulaire . Volume 17, numéro 6, 2018, pp. 688–701, doi: 10.1080 / 15384101.2018.1442622 , PMID 29509056 , PMC 5969562 (texte intégral gratuit).
- ↑ Georg Schwedt Zuckersüße chimie. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , page 100.
- ↑ Schmidt, Lang : Physiologie des Menschen, 30e édition. Springer Verlag, 2007, p.907.
- ↑ T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork : Alignement des voies : application à l'analyse comparative des enzymes glycolytiques. Dans : Biochimie. J. 343 Pt 1, 1999, pp. 115-124 ( PMID 10493919 ; PMC 1220531 (texte intégral gratuit)).
- ↑ a b c L. L. Koekkoek, JD Mul, SE la Fleur : Glucose-Sensing dans le système de récompense. Dans : Frontières en neurosciences . Volume 11, 2017, p. 716, doi : 10.3389 / fnins.2017.00716 , PMID 29311793 , PMC 5742113 (texte intégral gratuit).
- ↑ a b R. M. Tucker, SY Tan : Les édulcorants non nutritifs influencent-ils l'homéostasie aiguë du glucose chez l'homme ? Une revue systématique. Dans : Physiologie & Comportement . Volume 182, décembre 2017, pp. 17-26, doi: 10.1016 / j.physbeh.2017.09.016 , PMID 28939430 .
- ^ SE La Fleur, E. Fliers, A. Kalsbeek : Neuroscience de l'homéostasie du glucose. Dans : Manuel de neurologie clinique . Volume 126, 2014, pp. 341-351, doi: 10.1016 / B978-0-444-53480-4.00026-6 , PMID 25410233 .
- ^ PH Bisschop, E. Fliers, A. Kalsbeek : Régulation autonome de la production hépatique de glucose. Dans : Physiologie complète . Volume 5, numéro 1, janvier 2015, pp. 147-165, doi: 10.1002 / cphy.c140009 , PMID 25589267 .
- ^ WA Scherbaum, BM Lobnig, Dans : Hans-Peter Wolff, Thomas R. Weihrauch : Thérapie interne 2006, 2007. 16e édition. Elsevier, Munich 2006, ISBN 3-437-23182-0 , p. 927, 985.
- ^ Harold A. Harper : Biochimie médicale. Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , page 294.
- ↑ a b c Donard Dwyer: métabolisme du glucose dans le cerveau. Academic Press, 2002, ISBN 978-0-12-366852-3 , page XIII.
- ↑ SH Fairclough, K. Houston : Une mesure métabolique de l'effort mental. Dans : Psychologie Biologique . Volume 66, Numéro 2, avril 2004, pp. 177-190, doi: 10.1016 / j.biopsycho.2003.10.001 , PMID 15041139 .
- ↑ MT Gailliot, RF Baumeister: La physiologie de la volonté: relier la glycémie à l' auto-contrôle. Dans : Personality and social psychologie review : an official journal of the Society for Personality and Social Psychology, Inc. Volume 11, Numéro 4, novembre 2007, pp. 303-327, doi : 10.1177 / 1088868307303030 , PMID 18453466 .
- ^ Un b Richard A. Harvey, Denise R. Ferrier : Biochimie. 5e édition, Lippincott Williams & Wilkins, 2011, ISBN 978-1-60831-412-6 , page 366.
- ↑ a b U. Satyanarayana: biochimie. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7 , page 508.
- ↑ SH Holt, JC Miller, P. Petocz : Un indice d'insuline des aliments : la demande en insuline générée par des portions de 1000 kJ d'aliments courants. Dans : The American Journal of Clinical Nutrition . Volume 66, numéro 5, novembre 1997, pp. 1264-1276, doi: 10.1093 / ajcn / 66.5.1264 , PMID 9356547 .
- ^ P. Concannon, SS Rich, GT Nepom : Génétique du diabète de type 1A. Dans : The New England Journal of Medicine . Volume 360, numéro 16, avril 2009, pp. 1646-1654, doi: 10.1056 / NEJMra0808284 , PMID 19369670 .
- ↑ R. Goyal, I. Jialal: intolérance au glucose. Dans : StatPearls [Internet]. Treasure Island (FL), 2018. PMID 29763085 .
- ↑ R. Buresh : Exercice et contrôle de la glycémie. Dans : The Journal of Sports Medicine and Physical Fitness . Volume 54, numéro 4, août 2014, pp. 373-382, PMID 25034542 .
- ↑ H. Yki-Järvinen : La stéatose hépatique non alcoolique comme cause et conséquence du syndrome métabolique. Dans : Le Lancet . Diabète et endocrinologie. Volume 2, numéro 11, novembre 2014, pp. 901-910, doi: 10.1016 / S2213-8587 (14) 70032-4 , PMID 24731669 .
- ↑ H. Fehling : Détermination quantitative du sucre dans l'urine. Dans : Archive for Physiological Medicine (1848), Volume 7, pp. 64-73.
- ↑ B. Tollens : À propos de la solution d'argent ammoniacal comme réactif pour l'aldéhyde . Dans : Rapports de la Société chimique allemande . 15, 1882, pages 1635-1639.
- ↑ C. Barfoed : A propos de la détection du sucre de raisin en plus de la dextrine et des corps apparentés . Dans : Journal de chimie analytique . 12, n° 1, 1873, page 27. doi : 10.1007 / BF01462957 .
- ^ Emil Nylander : À propos de la solution alcaline de bismuth comme réactif pour le glucose dans l'urine , magazine de chimie physiologique . Volume 8, numéro 3, 1884, pp. 175-185 ( résumé ).
- ↑ a b c d e f g h i j k Georg Schwedt : Chimie Zuckersweet. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , page 102.
- ↑ P. Trinder : Détermination du glucose dans le sang à l'aide de la glucose oxydase avec un accepteur d'oxygène alternatif. Dans : Annales de biochimie clinique . 6, 1969, p. 24-27; doi: 10.1177/000456326900600108 .
- ↑ M. Mizoguchi, M. Ishiyama, M. Shiga, K. Sasamoto : Réactif chromogénique hydrosoluble pour la détection colorimétrique du peroxyde d'hydrogène - une alternative à la 4-aminoantipyrine fonctionnant à grande longueur d'onde. Dans : Communications analytiques . 35, 1998, p. 71-73; doi: 10.1039/A709038B .
- ^ J. Wang : Biocapteurs électrochimiques de glucose. Dans : Chem. Rev. 108, 2008, pp. 814-825; PMID 18154363 .
- ↑ X. Chen, J. Chen, Ch. Deng, Ch. Xiao, Y. Yang, Z. Nie, S. Yao : Biocapteur de glucose ampérométrique basé sur une électrode modifiée par des nanotubes de carbone dopés au bore. Dans : Talanta . 76, 2008, pages 763-767 ; doi : 10.1016 / j.talanta.2008.04.023 ; PMID 18656655 .
- ↑ G. Wang, Y. Wei, W. Zhang, X. Zhang, B. Fang, L. Wang: Enzyme sans détection ampérométrique du glucose en utilisant des composites de nanofils Cu-CuO. Dans : Microchimica Acta . 168, 2010, p. 87-92 ; doi: 10.1007 / s00604-009-0260-1 .
- ^ TJ Ohara, R. Rajagopaian, A. Heller : Électrodes enzymatiques « câblées » pour la détermination ampérométrique du glucose ou du lactate en présence de substances interférentes. Dans : Anal. Chem.66 , 1994, pages 2451-2457; doi : 10.1021 / ac00087a008 ; PMID 8092486 .
- ↑ a b c S. M. Borisov, OS Wolfbeis: biocapteurs optiques. Dans : Chem. Rev. 108, 2008, pp. 423-461; doi : 10.1021 / cr068105t ; PMID 18229952 .
- ^ S. Ferri, K. Kojima, K. Sode : Examen des glucose oxydases et des glucose déshydrogénases : une vue plongeante sur les enzymes de détection du glucose. Dans : Journal of Diabetes Science and Technology . Volume 5, numéro 5, septembre 2011, pp. 1068-1076, doi: 10.1177 / 19322968110500507 , PMID 22027299 , PMC 3208862 (texte intégral gratuit).
- ↑ HS Mader, OS Wolfbeis : Sondes à base d'acide boronique pour la microdétermination des saccharides et des biomolécules glycosylées. Dans : Microchimica Acta , 162, 2008, p. 1-34 ; doi: 10.1007 / s00604-008-0947-8 .
- ^ OS Wolfbeis, I. Oehme, N. Papkovskaya, I. Klimant: Biocapteurs de glucose à base de sol-gel employant des transducteurs optiques d'oxygène et une méthode de compensation pour le fond d'oxygène variable. Dans : Biocapteurs & Bioélectronique . 15, 2000, p. 69-76 ; doi: 10.1016 / S0956-5663 (99) 00073-1 .
- ↑ a b A. L. Galant, RC Kaufman, JD Wilson: Glucose: Détection et analyse. Dans : Chimie alimentaire . Volume 188, décembre 2015, pp. 149-160, doi: 10.1016 / j.foodchem.2015.04.071 , PMID 26041177 .
- ↑ ML Sanz, J. Sanz, I. Martínez-Castro : Méthode par chromatographie en phase gazeuse et spectrométrie de masse pour la détermination qualitative et quantitative des disaccharides et trisaccharides dans le miel. Dans : Journal of Chromatography A 1059 (1-2), 2004, pp. 143-148; PMID 15628134 .
- ↑ hummel@mpimp-golm.mpg.de : GMD - Glucose (1MEOX) (5TMS) BP - InChI = 1S / C22H55NO6Si5 / c1-24-23-17-19 (26-31 (5,6) 7) 21 ( 28- 33 (11,12) 13) 22 (29-34 (14,15) 16) 20 (27-32 (8,9) 10) 18-25-30 (2,3) 4/h17,19- 22H. Dans : gmd.mpimp-golm.mpg.de. 19 juillet 2007. Consulté le 4 juin 2018 .
- ^ AI Cabañero, JL Recio, M. Rupérez : Chromatographie liquide couplée à la spectrométrie de masse du rapport isotopique : une nouvelle perspective sur la détection de la falsification du miel. Dans : J Agric Food Chem . 54 (26), 27 décembre 2006, p. 9719-9727 ; PMID 17177492 .
- ↑ M. Becker, F. Ler, T. Rosenau, A. Potthast : Approche d'éthoximation-silylation analyse des mono- et disaccharides fiebnor et caractérisation de leurs paramètres d'identification par GC/MS. Dans : Talanta . 115, 2013, p. 642-651 ; PMID 24054643 .
- ^ Society of German Chemists: Annexes to the position paper of the Nuclear Chemistry Section ( Memento du 31 mars 2010 dans Internet Archive ), février 2000.
- ↑ Simone Maschauer, Olaf Prante : Édulcorer la radiochimie pharmaceutique par 18 F-Fluoroglycosylation : une brève revue . Dans : BioMed Research International , Volume 2014, Numéro d'article 214748 ; doi : 10.1155 / 2014/214748 ; PMID 24991541 ; PMC 4058687 (texte intégral gratuit).