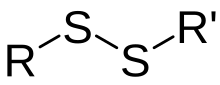Pont disulfure
En chimie, un pont disulfure , liaisons disulfure ou liaisons disulfure représente une liaison covalente entre deux atomes de soufre dont la valence libre seulement est saturé avec un radical organyle . En biochimie , la liaison disulfure est la liaison covalente (une liaison atomique ) entre les atomes de soufre de deux molécules de cystéine qui apparaissent dans la chaîne latérale des acides aminés d' une protéine .
Deux résidus cystéine dans des protéines liées au moyen d'une liaison disulfure sont également connus sous le nom de ponts cystine .
fonction
Les ponts disulfure forment et stabilisent la structure protéique tridimensionnelle (structure tertiaire) par la formation de boucles dans les chaînes d'acides aminés ou relient plusieurs chaînes d'acides aminés pour former une protéine fonctionnelle . En tant que liaisons covalentes, les ponts disulfure ont un effet fixateur significativement plus important que, par exemple, les liaisons hydrogène qui existent également dans la molécule et qui sont considérées comme des liaisons de valence mineures .
La formation de liaisons disulfure peut être une étape distincte dans le repliement d'une protéine sans retarder les étapes de pliage ultérieures .
Exemples
Les liaisons disulfure sont typiques des protéines sécrétoires car elles ne peuvent pas se former dans le cytosol.
insuline
La proteohormone insuline se compose de deux chaînes d'acides aminés différentes, appelées chaînes A et B, la chaîne A étant reliée par voie intrachénarique par une et interchénarly avec la chaîne B par deux liaisons disulfure.
Lipase
Une lipase , une enzyme lipolytique du pancréas ( pancréas ) du porc, possède sept ponts disulfure.
GPCR
Les récepteurs couplés aux protéines G sont des protéines liées à la membrane qui sont stabilisées par un pont disulfure entre la troisième hélice transmembranaire et la deuxième boucle extracellulaire. Les études de mutation montrent que le récepteur n'est plus exprimé lorsque l'une des cystéines impliquées est mutée en sérine .
Formation de liaison
réaction
Les groupes fonctionnels impliqués dans la formation d'une liaison disulfure sont appelés groupes thiol (groupes mercapto). En termes simplifiés, la formation d'une telle liaison SS peut être comprise comme une oxydation (libération d' hydrogène ou d'électrons):
Oxydation: R-SH + HS-R '→ RSSR' + 2 H + + 2e -
Réduction: 2 Fe 3+ + 2 e - → 2 Fe 2+
En biochimie, R et R 'désignent les cystéines sur le peptide / protéine. Les deux atomes d'hydrogène en excès sont liés par un accepteur d'hydrogène (la notation [H] indique clairement qu'ils ne sont pas libérés sous forme d'hydrogène gazeux). Ils peuvent finalement être transférés à l' oxygène , par exemple .
- 4 [H] + O 2 → 2 H 2 O
temps
Des ponts disulfures sont insérés dans les protéines pendant la traduction si des parties de celles-ci sont déjà dans le réticulum endoplasmique (RE) (chez les eucaryotes) pendant leur synthèse , ou après, s'ils sont complètement dans le RE ou un autre organite cellulaire recouvert de membrane , quel représente alors une modification post-traductionnelle . Dans le cas des procaryotes, cela s'applique de manière analogue à la traduction dans le périplasme.
Puisque la formation d'un pont disulfure à partir de deux groupes mercapto est une oxydation, la réaction ne peut avoir lieu que dans un environnement oxydant. Le cytoplasme est un environnement réducteur, de sorte que les protéines cytoplasmiques ne contiennent généralement pas de ponts disulfure.
Les enzymes
La formation de liaisons disulfure n'est pas un processus spontané; c'est une réaction redox qui nécessite un partenaire réactionnel approprié pour le transfert d'électrons. La formation est catalysée par une enzyme. Si une protéine contient également plus de deux cystéines, il est possible que la liaison des «mauvaises» cystéines aboutisse à des ponts disulfure qui ne correspondent pas à l'état natif de la protéine. Les mauvais ponts disulfure doivent être refixés ( remaniement ).
Isomérases disulfure de protéine
Les eucaryotes ont des protéines disulfure isomérases (PDI) dans le réticulum endoplasmique (RE ). Le pliage progressif amène lentement les cystéines qui vont ensemble dans la proximité spatiale, ce qui rend de plus en plus probable des connexions correctes.
Thio-disulfure oxydoréductases
Le pendant procaryote des protéines disulfure isomérases est le système Dsb périplasmique et permanent de la membrane interne (dsb de la liaison disulfure), qui contrôle la formation et l'isomérisation des disulfures.
Système GSH / GSSG
Le glutathion (GSH) est un isopeptide présent dans le cytoplasme des procaryotes et des eucaryotes et qui participe à la formation de ponts disulfure. Il réagit dans une réaction d'échange de disulfure:
R et R 'sont à nouveau les cystéines dans le squelette protéique, GSSG est le dimère GSH avec un pont disulfure (exprimé par les atomes de soufre «SS» écrits côte à côte).
- R-SH + GSSG → RSSG + GSH
La gauche des deux produits est appelée disulfure mixte. Il continuera à être mis en œuvre:
- RSSG + HS-R '→ RSSR' + GSH
Dans le cytosol, il est (enzymatiquement) conservé sous forme réduite (GSH). On parle de «conditions réductrices».
Ces conditions peuvent être illustrées par les rapports de concentration relative de GSH et du dimère ponté disulfure GSSG correspondant:
| Compartiment cellulaire | GSH | GSSG |
|---|---|---|
| Cytosol | 60 | 1 |
| IL | 1 | 2 |
Les conditions dans le RE correspondent au milieu extracellulaire en présence d' oxygène (la lumière du RE est topologiquement équivalente à l'espace extra-atmosphérique).
Le GSH joue également un rôle dans le stress oxydatif .
Importance pour l'expression de protéines recombinantes
Les ponts disulfure dans les protéines limitent leur expression recombinante , i. H. leur production biotechnologique .
Chez les eucaryotes, des ponts disulfure se forment dans le réticulum endoplasmique. Cependant, les systèmes d'expression sont souvent des procaryotes qui n'ont pas de RE. Si la protéine est traduite dans le cytosol, aucun pont disulfure ne peut se former (voir système GSH / GSSG).
Formation de corps d'inclusion
Sans ponts disulfure, le repliement de la protéine est perturbé. Outre la dégradation protéolytique , une production excessive (surexpression) de la protéine, souhaitée pour des raisons de rendement, peut conduire à la formation de corps d'inclusion ( agrégation de protéines pour former le corps dit d' inclusion ). L'intérieur du corps d'inclusion est protégé de la réduction et forme par conséquent des ponts disulfure arbitraires avec d'autres protéines. Le mauvais repliement et la formation de corps d'inclusion rendent des étapes de travail supplémentaires nécessaires pour la purification de la protéine et dans certains cas ne fournissent qu'une quantité limitée de protéine fonctionnelle.
Resolubilisation avec des agents réducteurs
Le DTT (dithiothréitol) , le mercaptoéthanol , la tris (2-carboxyéthyl) phosphine et le DTE (dithioérythritol) sont des agents réducteurs des liaisons disulfure. Ils sont utilisés en biochimie pour rompre les liaisons disulfure arbitrairement formées dans les corps d'inclusion.
Cela se fait en les réduisant, comme le montre l'image. Les protéines individuelles sont ainsi séparées les unes des autres et se dissolvent à nouveau. On parle de la résolubilisation (anglais soluble = soluble) des protéines.
Réoxydation avec le glutathion
Les protéines issues de ce processus ne contiennent que des liaisons disulfure réduites. Afin d'obtenir une protéine fonctionnelle, la protéine doit être correctement repliée. Pour ce faire, les liaisons disulfure doivent être rétablies et ceci de manière contrôlée afin que seules les paires de cystéines «désirées» se lient entre elles.
Pour y parvenir, les protéines sont traitées avec du glutathion (GSH). Les liaisons disulfure sont réoxydées à leur état natif (= "back-oxydation" à l'état de liaison de cette protéine fournie par la nature). Au cours de ce processus, diverses conditions doivent être adaptées et respectées afin d'éviter une nouvelle agrégation de protéines (voir formation de corps d'inclusion). Pour ce faire, les concentrations en protéines et en GSH, le pH de la solution, la température et les temps de réaction sont variés et optimisés.
Il est également possible d'ajouter des additifs de pliage tels que l'arginine, qui favorisent également la formation correcte de liaisons disulfure. Avec ce que l'on appelle la renaturation par impulsion , la totalité de la protéine n'est pas ajoutée à la solution de renaturation au début de la renaturation . Au lieu de cela, après avoir ajouté de petites portions, il y a une courte attente pour donner aux protéines déjà dans la solution le temps de se replier. Les protéines pliées ne s'agrègent plus, ce qui réduit le risque que les protéines dépliées se heurtent et forment des corps d'inclusion les unes avec les autres.
Expression dans le périplasme
Dans le périplasme des procaryotes, contrairement au cytosol, des conditions oxydantes prévalent. Un système GSG / GSSG n'existe pas ici, car la membrane externe est constituée de protéines de taille inférieure à 500 Da, perméables (le GSH a une masse molaire de seulement 307,3 g / mol). L'oxygène peut également se diffuser à travers la membrane externe. L'expression recombinante de protéines avec des liaisons disulfure est donc également recherchée avec le périplasme comme cible.
Preuve individuelle
- ^ Hans-Dieter Jakubke, Hans Jeschkeit: acides aminés, peptides, protéines , Verlag Chemie, Weinheim, p 101, 1982, ISBN 3-527-25892-2 .
- ^ Creighton, TE. Repliement des protéines couplé à la formation de liaisons disulfure. Biol Chem . 1997 août, 378 (8): 731-744.
Littérature
- W. Thieman, M. Palladino: Biotechnologie. Pearson Studium, Allemagne, 2007, ISBN 978-3-8273-7236-9